Гексан
 | |
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Гексан [2] | |
| Другие имена Секстан, [1] гексакарбан | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| 1730733 | |
| ЧЭБИ | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Информационная карта ECHA | 100.003.435 |
| Номер ЕС |
|
| 1985 | |
| КЕГГ | |
| МеШ | н-гексан |
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
| Номер ООН | 1208 |
Панель инструментов CompTox ( EPA ) |
|
| |
| Характеристики | |
| С 6 Н 14 | |
| Молярная масса | 86,178 г·моль −1 |
| Появление | Бесцветная жидкость. |
| Запах | Петролический |
| Плотность | 0,6606 г мл −1 [3] |
| Температура плавления | от −96 до −94 °C; от −141 до −137 °F; от 177 до 179 K |
| Точка кипения | 68,5–69,1 °C; 155,2–156,3 °F; 341,6–342,2 K |
| 9,5 мг л −1 | |
| лог P | 3.764 |
| Давление пара | 17,60 кПа (при 20,0 °C) |
Константа закона Генри ( k H ) | 7,6 нмоль Па −1 кг −1 |
| УФ-видимый (λ макс ) | 200 нм |
| −74,6·10 −6 см 3 /моль | |
Показатель преломления ( nD ) | 1.375 |
| Вязкость | 0,3 мПа·с |
| 0,08 Д | |
| Термохимия | |
Теплоемкость ( С ) | 265,2 ДжК −1 моль −1 |
Стандартная молярная энтропия ( S ⦵ 298 ) | 296,06 ДжК −1 моль −1 |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −199,4–−198,0 кДж моль −1 |
Стандартная энтальпия сгорания (Δ c H ⦵ 298 ) | −4180–−4140 кДж моль −1 |
| Опасности | |
| Охрана труда и техника безопасности (OHS/OSH): | |
Основные опасности | Репродуктивная токсичность – После аспирации , отек легких , пневмонит [4] |
| Маркировка СГС : | |
    | |
| Опасность | |
| H225 , H302 , H305 , H315 , H336 , H361fd , H373 , H411 | |
| Р201 , Р202 , Р210 , Р233 , Р235 , Р240 , Р241 , Р242 , Р243 , Р260 , Р264 , Р271 , Р273 , Р280 , Р281 , Р301+Р330+Р331 , Р302+Р352 , Р303+Р361+Р353 , Р304+Р340 , Р308+Р313 , Р310 , Р312 , Р314 , Р332+Р313 , Р363 , Р370+Р378 , Р391 , Р403+Р233 , Р405 , Р501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | −26,0 °C (−14,8 °F; 247,2 К) |
| 234,0 °C (453,2 °F; 507,1 К) | |
| Пределы взрывоопасности | 1,2–7,7% |
| Смертельная доза или концентрация (ЛД, ЛК): | |
LD 50 ( средняя доза ) | 25 г кг −1 (перорально, крыса) 28710 мг/кг (крыса, перорально) [6] |
LD Lo ( самый низкий опубликованный ) | 56137 мг/кг (крыса, перорально) [6] |
| NIOSH (пределы воздействия на здоровье в США): | |
PEL (допустимый) | TWA 500 частей на миллион (1800 мг/м 3 ) [5] |
ОТВ (рекомендуется) | TWA 50 частей на миллион (180 мг/м 3 ) [5] |
IDLH (Непосредственная опасность) | 1100 частей на миллион [5] |
| Родственные соединения | |
Родственные алканы | |
| Страница дополнительных данных | |
| Гексан (страница данных) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гексан ( / ˈhɛkseɪn / ) или н - гексан — органическое соединение , линейный алкан с шестью атомами углерода и молекулярной формулой C6H14 . [ 7 ]
Гексан — бесцветная жидкость, не имеющая запаха в чистом виде, с температурой кипения около 69 °C (156 °F). Он широко используется как дешевый, относительно безопасный, в значительной степени нереакционноспособный и легко испаряющийся неполярный растворитель , а современные бензиновые смеси содержат около 3% гексана. [8]
Термин гексаны относится к смеси , состоящей в основном (>60%) из н -гексана с различными количествами изомерных соединений 2-метилпентана и 3-метилпентана , и, возможно, меньшими количествами неизомерных C 5 , C 6 и C 7 (цикло)алканов. Эти смеси «гексанов» дешевле чистого гексана и часто используются в крупномасштабных операциях, не требующих одного изомера (например, в качестве очищающего растворителя или для хроматографии ).
Изомеры
| Общее название | Название ИЮПАК | Текстовая формула | Скелетная формула |
|---|---|---|---|
| Нормальный гексан , н -гексан | Гексан | СН 3 (СН 2 ) 4 СН 3 | 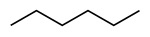 |
| Изогексан | 2-Метилпентан | (СН 3 ) 2 СН(СН 2 ) 2 СН 3 | 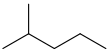 |
| 3-Метилпентан | СН 3 СН 2 СН(СН 3 )СН 2 СН 3 | 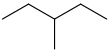 | |
| 2,3-Диметилбутан | (СН 3 ) 2 СНСН(СН 3 ) 2 | 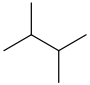 | |
| Неогексан | 2,2-Диметилбутан | (СН 3 ) 3 ССН 2 СН 3 | 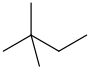 |
Использует
В промышленности гексаны используются в рецептуре клеев для обуви, изделий из кожи и кровли. Они также используются для извлечения кулинарных масел (таких как рапсовое или соевое масло ) из семян, для очистки и обезжиривания различных предметов и в текстильном производстве.
Типичное лабораторное применение гексанов — извлечение масляных и жировых загрязнений из воды и почвы для анализа. [9] Поскольку гексан не может быть легко депротонирован , он используется в лаборатории для реакций, в которых участвуют очень сильные основания, такие как получение литийорганических соединений . Например, бутиллитий обычно поставляется в виде раствора гексана. [10]
Гексаны обычно используются в хроматографии в качестве неполярного растворителя. Высшие алканы, присутствующие в качестве примесей в гексанах, имеют схожее время удерживания с растворителем, что означает, что фракции, содержащие гексан, также будут содержать эти примеси. В препаративной хроматографии концентрация большого объема гексанов может привести к образцу, который будет заметно загрязнен алканами. Это может привести к получению твердого соединения в виде масла , и алканы могут помешать анализу.
В качестве топлива для двигателей внутреннего сгорания н-гексан имеет низкие исследовательские и моторные октановые числа 25 и 26 соответственно. [11] В 1983 году его доля в японском бензине колебалась около 6%, [12] в 1992 году он присутствовал в американском бензине от 1 до 3%, [13] а в шведском автомобильном топливе в том же году доля была постоянно ниже 2%, часто ниже 1%. [14] К 2011 году его доля в американском бензине составляла от 1 до 7%. [15]
Производство
Гексан в основном получают путем переработки сырой нефти . Точный состав фракции во многом зависит от источника нефти (сырая или реформированная) и ограничений переработки. [16] Промышленный продукт (обычно около 50% по весу изомера с прямой цепью) представляет собой фракцию, кипящую при 65–70 °C (149–158 °F).
Физические свойства
Все алканы бесцветны. [17] [18] Температуры кипения различных гексанов несколько схожи и, как и для других алканов, обычно ниже для более разветвленных форм. Температуры плавления совершенно разные, и тенденция неочевидна. [19]
| Изомер | МП (°С) | МП (°F) | БП (°С) | АД (°F) |
|---|---|---|---|---|
| н -гексан | −95,3 | −139,5 | 68.7 | 155,7 |
| 3-метилпентан | −118.0 | −180,4 | 63.3 | 145,9 |
| 2-метилпентан (изогексан) | −153,7 | −244,7 | 60.3 | 140,5 |
| 2,3-диметилбутан | −128,6 | −199,5 | 58.0 | 136.4 |
| 2,2-диметилбутан (неогексан) | −99,8 | −147,6 | 49.7 | 121,5 |
Гексан имеет значительное давление паров при комнатной температуре:
| Температура (°С) | Температура (°F) | Давление пара ( мм рт.ст. ) | Давление пара ( кПа ) |
|---|---|---|---|
| −40 | −40 | 3.36 | 0,448 |
| −30 | −22 | 7.12 | 0,949 |
| −20 | −4 | 14.01 | 1.868 |
| −10 | 14 | 25.91 | 3.454 |
| 0 | 32 | 45.37 | 6.049 |
| 10 | 50 | 75.74 | 10.098 |
| 20 | 68 | 121.26 | 16.167 |
| 25 | 77 | 151.28 | 20.169 |
| 30 | 86 | 187.11 | 24.946 |
| 40 | 104 | 279,42 | 37.253 |
| 50 | 122 | 405.31 | 54.037 |
| 60 | 140 | 572.76 | 76.362 |
Реактивность
Как и большинство алканов, гексаны характеризуются низкой реакционной способностью и являются подходящими растворителями для реакционноспособных соединений. Однако коммерческие образцы н -гексана часто содержат метилциклопентан , который имеет третичные связи CH, несовместимые с некоторыми радикальными реакциями. [20]
Безопасность
Вдыхание н -гексана в концентрации 5000 ppm в течение 10 минут вызывает выраженное головокружение; 2500–1000 ppm в течение 12 часов вызывает сонливость , усталость , потерю аппетита и парестезию в дистальных отделах конечностей; 2500–5000 ppm вызывает мышечную слабость, холодную пульсацию в конечностях, нечеткость зрения, головную боль и анорексию . [21] Было показано, что хроническое профессиональное воздействие повышенных уровней н -гексана связано с периферической невропатией у автомехаников в США и нейротоксичностью у рабочих типографий, а также обувных и мебельных фабрик в Азии, Европе и Северной Америке. [22]
Национальный институт охраны труда США (NIOSH) установил рекомендуемый предел воздействия (REL) для изомеров гексана (не н -гексана) в размере 100 ppm (350 мг/м3 ( 0,15 г/куб. фут)) в течение 8-часового рабочего дня. [23] Однако для н -гексана текущий REL NIOSH составляет 50 ppm (180 мг/м3 ( 0,079 г/куб. фут)) в течение 8-часового рабочего дня. [24] Этот предел был предложен в качестве допустимого предела воздействия (PEL) Управлением охраны труда и техники безопасности в 1989 году; однако этот PEL был отменен в судах США в 1992 году. [25] Текущий PEL для н-гексана в США составляет 500 ppm (1800 мг/м3 ( 0,79 г/куб. фут)). [24]
Гексан и другие летучие углеводороды ( петролейный эфир ) представляют риск аспирации . [26] н -гексан иногда используется как денатурант для спирта и как чистящее средство в текстильной , мебельной и кожевенной промышленности. Его постепенно заменяют другими растворителями. [27]
Как и бензин, гексан очень летуч и взрывоопасен. Взрывы канализации в Луисвилле в 1981 году , которые уничтожили более 13 миль (21 км) канализационных линий и улиц в Кентукки, были вызваны возгоранием паров гексана, которые были незаконно сброшены с завода по переработке сои , принадлежащего Ralston-Purina . Гексан был назван причиной взрыва, который произошел в Национальном университете Рио-Куарто , Аргентина, 5 декабря 2007 года из-за утечки гексана вблизи отопительной машины, которая взорвалась, вызвав пожар, в результате которого погиб один студент и 24 получили ранения.
Инциденты
Профессиональное отравление гексаном произошло у японских рабочих, занимающихся изготовлением сандалий, итальянских рабочих, занимающихся обувной промышленностью, [28] тайваньских рабочих, занимающихся проверкой оттисков, и других. [29] Анализ тайваньских рабочих показал профессиональное воздействие веществ, включая н -гексан. [30] В 2010–2011 годах сообщалось о случаях отравления гексаном у китайских рабочих, занимающихся производством iPhone. [31] [32]
Биотрансформация
n- гексан биотрансформируется в 2-гексанол и далее в 2,5-гександиол в организме. Превращение катализируется ферментом цитохромом P450, использующим кислород из воздуха. 2,5-гександиол может далее окисляться до 2,5-гександиона , который является нейротоксичным и вызывает полинейропатию . [27] В связи с этим поведением обсуждалась замена n -гексана в качестве растворителя. n -гептан является возможной альтернативой. [33]
Смотрите также
Ссылки
- ↑ Хофманн, Август Вильгельм фон (1 января 1867 г.). «I. О действии трихлорида фосфора на соли ароматических моноаминов». Труды Лондонского королевского общества . 15 : 54–62 . doi :10.1098/rspl.1866.0018. S2CID 98496840.
- ^ "n-гексан – Сводка по соединению". PubChem Compound . США: Национальный центр биотехнологической информации. 16 сентября 2004 г. Идентификация и связанные с ней записи. Архивировано из оригинала 8 марта 2012 г. Получено 31 декабря 2011 г.
- ^ Уильям М. Хейнс (2016). CRC Handbook of Chemistry and Physics (97-е изд.). Boca Raton: CRC Press. стр. 3–298 . ISBN 978-1-4987-5429-3.
- ^ Классификация GHS на [PubChem]
- ^ abc NIOSH Карманный справочник по химическим опасностям. "#0322". Национальный институт охраны труда и здоровья (NIOSH).
- ^ ab "n-Hexane". Концентрации, представляющие немедленную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда (NIOSH).
- ^ PubChem. "n-HEXANE". pubchem.ncbi.nlm.nih.gov . Получено 3 ноября 2023 г. .
- ^ "n-Hexane - Hazardous Agents". Haz-Map . Получено 7 июля 2022 г.
- ^ Использование озоноразрушающих веществ в лабораториях. Kbh: Нордиск Министеррод. 2003. ISBN 92-893-0884-2. OCLC 474188215. Архивировано из оригинала 16 июля 2012 года.
- ^ Швиндеман, Джеймс А.; Вольтерманн, Крис Дж.; Летчфорд, Роберт Дж. (1 мая 2002 г.). «Безопасное обращение с литийорганическими соединениями в лаборатории». Chemical Health & Safety . 9 (3): 6– 11. doi :10.1016/s1074-9098(02)00295-2. ISSN 1074-9098.
- ^ Аль Ибрагим, Эмад; Фарук, Аамир (16 января 2020 г.). «Прогнозирование октана по данным инфракрасной спектроскопии». Энергия и топливо . 34 (1): 817– 826. doi :10.1021/acs.energyfuels.9b02816. ISSN 0887-0624.
- ^ Икеда, Масаюки; Кумай, Михо; Ватанабэ, Такао; Фудзита, Хироёси (1984). «Ароматические и другие компоненты автомобильного бензина в Японии». Industrial health . 22 (4): 235– 241. doi :10.2486/indhealth.22.235.
- ^ Доски, Пол В.; Портер, Джозеф А.; Шефф, Питер А. (ноябрь 1992 г.). «Отпечатки источников летучих неметановых углеводородов». Журнал Ассоциации управления воздухом и отходами . 42 (11): 1437–1445 . doi : 10.1080/10473289.1992.10467090. ISSN 1047-3289.
- ^ Östermark, Ulf; Petersson, Göran (1 сентября 1992 г.). «Оценка углеводородов в парах обычного и алкилатного бензина» (PDF) . Chemosphere . 25 (6): 763– 768. doi :10.1016/0045-6535(92)90066-Z. ISSN 0045-6535.
- ^ «Углеводородный состав паров бензина в выбросах из закрытых топливных баков». nepis.epa.gov . Агентство по охране окружающей среды США. 2011.
- ^ Le Van Mao, R.; Melancon, S.; Gauthier-Campbell, C.; Kletnieks, P. (1 мая 2001 г.). «Селективный глубокий каталитический крекинг-процесс (SDCC) нефтяного сырья для производства легких олефинов. I. Эффект Катлевера, полученный с помощью системы с двумя реакционными зонами при конверсии н-гексана». Catalysis Letters . 73 (2): 181– 186. doi :10.1023/A:1016685523095. ISSN 1572-879X. S2CID 98167823.
- ^ "Органическая химия-I" (PDF) . Nsdl.niscair.res.in. Архивировано из оригинала (PDF) 29 октября 2013 г. Получено 17 февраля 2014 г.
- ^ "13. Углеводороды | Учебники". Textbook.s-anand.net. Архивировано из оригинала 6 октября 2014 года . Получено 17 февраля 2014 года .
- ^ Уильям Д. Маккейн (1990). Свойства нефтяных жидкостей. PennWell. ISBN 978-0-87814-335-1.
- ^ Кох, Х.; Хааф, В. (1973). "1-Адамантанкарбоновая кислота". Органические синтезы; Собрание томов , т. 5, стр. 20.
- ^ "N-HEXANE". Сеть токсикологических данных Hazardous Substances Data Bank . Национальная медицинская библиотека . Архивировано из оригинала 4 сентября 2015 г.
- ^ Центры по контролю и профилактике заболеваний (CDC) (16 ноября 2001 г.). "периферическая невропатия, связанная с н-гексаном, среди автомехаников — Калифорния, 1999–2000 гг.". MMWR. Еженедельный отчет о заболеваемости и смертности . 50 (45): 1011– 1013. ISSN 0149-2195. PMID 11724159.
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Hexane isomers (exclusion n-Hexane)". cdc.gov . Архивировано из оригинала 31 октября 2015 г. Получено 3 ноября 2015 г.
- ^ ab CDC (28 марта 2018 г.). "n-Hexane". Центры по контролю и профилактике заболеваний . Получено 3 мая 2020 г.
- ^ "Приложение G: Проект обновления данных о загрязнителях воздуха 1989 года — пределы воздействия НЕ действуют". www.cdc.gov . 20 февраля 2020 г. . Получено 3 мая 2020 г. .
- ^ Gad, Shayne C (2005), «Нефтяные углеводороды», Энциклопедия токсикологии , т. 3 (2-е изд.), Elsevier , стр. 377–379
- ^ ab Clough, Stephen R; Mulholland, Leyna (2005). «Гексан». Энциклопедия токсикологии . Т. 2 (2-е изд.). Elsevier. С. 522–525 .
- ^ Риццуто, Н.; Де Грандис, Д.; Ди Трапани, Г.; Пасинато, Э. (1980). «N-гексановая полинейропатия. Профессиональное заболевание сапожников». Европейская неврология . 19 (5): 308–15 . doi :10.1159/000115166. PMID 6249607.
- ^ n-Hexane, Environmental Health Criteria , Всемирная организация здравоохранения, 1991, архивировано из оригинала 19 марта 2014 г.
- ^ Лю, CH; Хуан, CY; Хуан, CC (2012). «Профессиональные нейротоксические заболевания на Тайване». Безопасность и гигиена труда . 3 (4): 257– 67. doi :10.5491/SHAW.2012.3.4.257. PMC 3521924. PMID 23251841 .
- ^ "Рабочие отравлены во время производства iPhone – ABC News (Австралийская вещательная корпорация)". Австралийская вещательная корпорация. 26 октября 2010 г. Архивировано из оригинала 8 апреля 2011 г. Получено 17 марта 2015 г.
- ^ Дэвид Барбоза (22 февраля 2011 г.). «Работники заболели у поставщика Apple в Китае». The New York Times . Архивировано из оригинала 7 апреля 2015 г. Получено 17 марта 2015 г.
- ^ Filser JG, Csanády GA, Dietz W, Kessler W, Kreuzer PE, Richter M, Störmer A (1996). "Сравнительная оценка нейротоксических рисков N-гексана и N-гептана у крыс и людей на основе образования метаболитов 2,5-гександиона и 2,5-гептандиона". Биологические реактивные промежуточные вещества V. Достижения экспериментальной медицины и биологии. Т. 387. С. 411– 427. doi :10.1007/978-1-4757-9480-9_50. ISBN 978-1-4757-9482-3. PMID 8794236.
Внешние ссылки
- Международная карта химической безопасности 1262 (2-метилпентан)
- Паспорт безопасности материала для гексана
- Национальный реестр загрязняющих веществ – информационный бюллетень по н-гексану
- Фитохимическая запись в базе данных
- Центр по контролю и профилактике заболеваний
- Предупреждение от Национального совета по безопасности «РАСПРОСТРАНЕННЫЕ ХИМИЧЕСКИЕ ВЕЩЕСТВА, ОКАЗЫВАЮЩИЕ ВОЗДЕЙСТВИЕ НА АВТОМЕХАНИКУ»
- Страница Австралийского национального реестра загрязняющих веществ (NPI)
- «EPA не считает н-гексан классифицируемым как канцероген для человека». Федеральный регистр / Том 66, № 71 / Четверг, 12 апреля 2001 г. / Правила и положения



