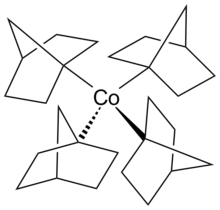
Тетранорборнил металл
В металлоорганической химии тетранорборнилы металлов представляют собой соединения с формулой M(nor) 4 (M = металл в степени окисления +4) (1-nor = 4бицикло[2.2.1]гепт-1-ил) и являются одним из крупнейших рядов тетраалкильных комплексов, полученных из идентичных лигандов . [1] [2] Тетранорборнилы металлов демонстрируют однородную стехиометрию , низкоспиновые конфигурации и высокую стабильность , что можно отнести к их металлическому центру в степени окисления +4 . Стабильность тетранорборнилов металлов в основном считается производной от неблагоприятного элиминирования β-гидрида . Вычислительные расчеты определили, что эффекты лондоновской дисперсии вносят значительный вклад в стабильность тетранорборнилов металлов. В частности, Fe(nor) 4 имеет стабилизацию 45,9 ккал/моль −1 . Известными тетранорборнилами металлов являются те, которые синтезированы с металлическими центрами кобальта , марганца или железа . [3]
Подготовка
Традиционно тетранорборнилы металлов получают путем реакции алкиллитий , таких как 1-норборниллитий, с галогенидами переходных металлов при перемешивании со стеклянными шариками в пентане . Затем следует этап фильтрации с использованием колонки с оксидом алюминия для удаления побочных продуктов пентана. Наконец, этап перекристаллизации из пентана для получения кристаллического соединения. [1]
Были предложены альтернативные методы получения тетранорборнилов металлов. В частности, комплекс тетракис(1-норборнил)хрома может быть получен в условиях инертной атмосферы с 1-норборниллитием, растворенным в гексане . Добавляют CrCl 3 (THF) 3 и оставляют перемешиваться в течение 48 часов. После этого раствор центрифугируют для удаления LiCl . Полученный супернатант наносят на колонку с оксидом алюминия, в качестве элюирующего растворителя используют гексан . Использование колонки с оксидом алюминия позволяет собирать фиолетовую фракцию, которая подвергается испарению растворителя и сублимации для получения желаемого комплекса Cr(nor) 4 . [4]
Комплекс тетракис (1-норборнил)кобальта(IV) можно получить следующим образом:
Комплекс тетракис(1-норборнил)молибдена(IV) был получен Уильямом М. Дэвисом, Ричардом Р. Шроком и Ричардом М. Колодзей следующим образом:
- MoCl 3 (ТГФ) 3 + 4norLi → [Эфир/ ТГФ ( 30 / 1 )] Mo(нор) 4 [6]
MoCl 3 (THF) 3 перемешивали с 1-норборниллитием в смеси THF и диэтилового эфира при . Затем реакционную смесь нагревали до и примерно через 90 минут наблюдали красный цвет с синим осадком . Затем реакционную смесь фильтровали для удаления синего осадка. Красный фильтрат затем восстанавливали с помощью вакуума для получения красных кристаллов Mo(nor) 4 . [6]
Структура и связь
Стабильность тетранорборнилов металлов обычно считается результатом неблагоприятного элиминирования β-водорода. Виды алкилов металлов с атомами β-водорода, присутствующими в алкильной группе, неблагоприятны из-за миграции β-водорода к металлическому центру, что приводит к элиминированию олефина и образованию соответствующего гидрида металла . 1-норборнил не подвергается миграции β-водорода, хотя он обладает 6 атомами β-водорода из-за неблагоприятного образования олефина, 1-норборнена. Согласно правилу Бредта , один из sp2 - углеродов атомов углерода с двойной связью будет расположен в головке мостика, что приведет к сильному напряжению 1-норборнена. [7] Элиминирование β-водорода не объясняет образование комплексов тетранорборнилов металлов, которые синтезируются из предшественников металлического центра с более низкой валентностью , укороченные длины связей между металлическим центром и атомами углерода 1-норборнильного лиганда или результирующую низкоспиновую тетраэдрическую молекулярную геометрию . [1] [3]

Неблагоприятная миграция β-водорода, приводящая к образованию 1-норборнена из 1-норборнилметаллического комплекса [7]
Квантово-механические расчеты показали, что силы дисперсии Лондона между норборниловыми лигандами отвечают за стабильность и молекулярную геометрию гомолептических тетранорборниловых комплексов металлов. [3] [7]
Комплексы тетранорборнилов металлов, состоящие из двухвалентных и трехвалентных видов металлических центров галогенидов Cr , Mn , Fe и Co, подвергаются образованию отрицательно заряженных комплексов с последующим окислением , которое индуцируется другими видами переходных металлов в реакции. Факторы, которые приводят к диспропорционированию, традиционно считаются производными от третичного карбаниона лиганда, 1-норборниллития, и отсутствия потенциала для пентанового растворителя действовать как лиганд. Поэтому тетранорборнилы металлов, состоящие из переходных металлов первого ряда, недоступны для проникновения небольших реагентов из-за координационной сферы металлического центра. [1]
Тетракис(1-норборнил)кобальт(IV)
Тетракис(1-норборнил)кобальт(IV) — это термически стабильный гомолептический комплекс, наблюдаемый с σ-связывающими лигандами. Металлический тетранорборниловый комплекс был первым изолированным низкоспиновым комплексом с тетраэдрической молекулярной геометрией. Комплекс тетракис(1-норборнил)кобальт(IV) был впервые синтезирован Бартоном К. Бауэром и Говардом Г. Теннентом в 1972 году. [1] [8] [9]
Состояние окисления тетракис (1-норборнил)кобальта(IV) является обратимой реакцией с использованием O2 в качестве окислителя . [10] Координационное окружение металлического центра кобальта имеет искаженную тетраэдрическую структуру. При исследовании методом рентгеновской кристаллографии металлический тетранорборнил имеет кристаллографическую симметрию Cs из - за наличия шести атомов углерода, расположенных на зеркальной плоскости. Однако четыре атома углерода, связанные с металлическим центром кобальта, напоминают тетрагонально сжатый тетраэдр, который выглядит как псевдосимметрия D2d .
Центр металла кобальта в степени окисления +4 имеет конфигурацию d 5 . [11] Обычно ожидается, что конфигурация d 5 приведет к высокоспиновому комплексу, содержащему 5 неспаренных электронов и только 1 неспаренный электрон в низкоспиновом тетраэдрическом комплексе. Единственный неспаренный электрон находится на антисвязывающей орбитали t 2 , что может привести к искажению структуры Яна-Теллера . Однако Теопольд и его коллеги предположили, что небольшое тетрагональное сжатие могло быть результатом стерических взаимодействий между норборниловыми лигандами и силами кристаллической упаковки. [10]
Тетракис(1-норборнил)железо(IV)
Комплекс тетракис(1-норборнил)железа(IV) был впервые синтезирован Бартоном К. Бауэром и Говардом Г. Теннентом в 1972 году. [1] 1-норборниловые лиганды в комплексе обладают сильным дисперсионным притяжением и высоким напряжением кольца , что, как следствие, затрудняет реакции элиминирования α- и β-гидридов. Кроме того, идентичные лиганды вызывают пониженную химическую реактивность из-за переполненной химической среды, которая затрудняет взаимодействие малых молекул со связями Fe-C. [12]
Синтезированные комплексы
Бартон К. Бауэр и Говард Г. Теннент смогли успешно синтезировать и охарактеризовать следующие металлические тетранорборнилы, полученные из переходных металлов первого , второго и третьего ряда : [1]
- тетракис(1-норборнил)гафний
- тетракис(1-норборнил)цирконий
- тетракис(1-норборнил)титан
- тетракис(1-норборнил)ванадий
- тетракис(1-норборнил)хром
- тетракис(1-норборнил)марганец
- тетракис(1-норборнил)железо
- тетракис(1-норборнил)молибден
Металлические тетранорборниловые комплексы гафния , циркония , титана и ванадия демонстрируют тетраэдрическую молекулярную геометрию , которая аналогична тетрахлоридной форме металлов. Для сравнения, комплексы кобальта , марганца и железа демонстрируют тетрагональную молекулярную геометрию. [1] Сочетание лондоновской дисперсионной силы и стерических эффектов от 1-норборниловых лигандов приводит к стабильности, наблюдаемой для металлического центра. [3]
Характеристика
Магнитные измерения
Результирующая молекулярная геометрия комплексов тетранорборнилов металлов обусловлена неспаренными и спаренными d-электронами . Магнитные измерения показали, что d-электроны тетракис(1-норборнил)хрома (d 2 ) и тетракис(1-норборнил)марганца (d 3 ) не являются спин-спаренными. Четыре d-электрона тетракис(1-норборнил)железа и тетракис(1-норборнил)кобальта являются спин-спаренными. [1]
Спектроскопия электронного парамагнитного резонанса
Тетранорборнилы металлов обычно характеризуются с помощью спектроскопии электронного парамагнитного резонанса (ЭПР). Тетракис(1-норборнил)молибден наблюдался как сигнал ЭПР при комнатной температуре, который возник из центра металла ad 2 , который, как считалось, имел два неспаренных электрона на орбитали e g . Кроме того, полученный сигнал ЭПР тетракис(1-норборнил)хрома был сопоставим. [6] [13]
Циклическая вольтамперометрия
В 1988 году Клаус Х. Теопольд и Эрин К. Бирн провели электрохимический эксперимент, циклическую вольтамперометрию , чтобы определить, насколько окислительным был металлический центр комплекса тетракис(1-норборнил)кобальта(IV). В ТГФ наблюдались две обратимые волны переноса электронов при -0,65 и -2,02 В, что прояснило, что разница в пиковых потенциалах соответствовала двум процессам одноэлектронного переноса при сравнении с парой феррицений/ ферроцен . [5] В том же году Уильям М. Дэвис, Ричард Р. Шрок и Ричард М. Колодзей получили циклическую вольтамперограмму для тетракис(1-норборнил)молибдена. В ДХМ наблюдались две волны окисления при -0,15 и +1,25 В. Окисление при -0,15 В считалось обратимым. Для сравнения, второе окисление при +1,25 В считалось необратимым. [6]
Ссылки
- ^ abcdefghi Бауэр, Бартон К.; Теннент, Говард Г. (апрель 1972 г.). «Переходные металлические бицикло[2.2.1]гепт-1-илы». Журнал Американского химического общества . 94 (7): 2512–2514. doi :10.1021/ja00762a056. ISSN 0002-7863.
- ^ Абрахамсон, Хармон Б.; Бранденбург, Кэтрин Л.; Лусеро, Барбара; Мартин, Мэри Э.; Деннис, Элеонора (сентябрь 1984 г.). «Спектроскопия и фотохимия тетранорборнильных комплексов титана и хрома». Organometallics . 3 (9): 1379–1386. doi :10.1021/om00087a010. ISSN 0276-7333.
- ^ abcd Liptrot, David J.; Guo, Jing-Dong; Nagase, Shigeru; Power, Philip P. (2016-11-14). «Силы дисперсии, диспропорционирование и стабильные высоковалентные поздние переходные металлические алкилы». Angewandte Chemie International Edition . 55 (47): 14766–14769. doi :10.1002/anie.201607360. ISSN 1433-7851. PMID 27778428.
- ^ Бранденбург, Кэтрин Линн. Фотоиндуцированные реакции комплексов органопереходных металлов VI группы. OCLC 83966357.
- ^ ab Byrne, Erin K.; Theopold, Klaus H. (февраль 1987 г.). «Окислительно-восстановительная химия тетракис(1-норборнил)кобальта. Синтез и характеристика алкильного кобальта(V) и скорость самообмена пары Co(III)/Co(IV)». Журнал Американского химического общества . 109 (4): 1282–1283. doi :10.1021/ja00238a066. ISSN 0002-7863.
- ^ abcd Колодзей, RM; Шрок, RR; Дэвис, WM (1988-12-27). "ChemInform Abstract: Synthesis and Characterization of Mo(nor)4 (nor: 1-Norbornyl)". ChemInform . 19 (52). doi :10.1002/chin.198852222. ISSN 0931-7597.
- ^ abc "Эффекты дисперсии при стабилизации металлоорганических соединений: тетра-1-норборнилпроизводные переходных металлов первого ряда как исключительные примеры". doi :10.1021/acs.jpca.9b06769.s001 . Получено 12.03.2023 .
{{cite journal}}: Цитировать журнал требует|journal=( помощь ) - ^ Бирн, Эрин К.; Ричесон, Даррин С.; Теопольд, Клаус Х. (1986). «Тетракис(1-норборнил)кобальт, низкоспиновый тетраэдрический комплекс переходного металла первого ряда». Журнал химического общества, Chemical Communications (19): 1491–1492. doi :10.1039/c39860001491. ISSN 0022-4936.
- ^ Бирн, Эрин К.; Теопольд, Клаус Х. (май 1989). «Синтез, характеристика и реакционная способность норборнильных комплексов кобальта в необычно высоких степенях окисления с переносом электронов». Журнал Американского химического общества . 111 (11): 3887–3896. doi :10.1021/ja00193a021. ISSN 0002-7863.
- ^ ab Byrne, Erin K.; Richeson, Darrin S.; Theopold, Klaus H. (1986). "Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal". Журнал химического общества, Chemical Communications (19): 1491. doi :10.1039/c39860001491. ISSN 0022-4936.
- ^ Грин, Малкольм Л. Х.; Паркин, Джерард (28.04.2014). «Применение метода классификации ковалентных связей для преподавания неорганической химии». Журнал химического образования . 91 (6): 807–816. Bibcode : 2014JChEd..91..807G. doi : 10.1021/ed400504f. ISSN 0021-9584.
- ^ Ли, Хуэйдун; Ван, Линьшэнь; Ху, Юйчэн; Чжан, Цзэ; Ван, Ди; Фань, Цюньчао; Кинг, Р. Брюс; Шефер, Генри Ф. (2020-08-27). «Сравнительное исследование термической стабильности экспериментально известных соединений высоковалентного железа (IV): Fe(1-норборнил) 4 и Fe(циклогексил) 4». Журнал физической химии A. 124 ( 34): 6867–6876. Bibcode : 2020JPCA..124.6867L. doi : 10.1021/acs.jpca.0c04055. ISSN 1089-5639. PMID 32786998. S2CID 221127617.
- ^ Уорд, GA; Бауэр, BK; Финдли, M.; Чиен, Джеймс CW (1974-05-07). "ChemInform Abstract: Electron Paramagnetic Resonance of Tetrakis(1-norbornyl)Chromium". Chemischer Informationsdienst . 5 (18). doi :10.1002/chin.197418348. ISSN 0009-2975.