Трансплантация кишечника
| Трансплантация кишечника | |
|---|---|
 Резецированная пораженная подвздошная кишка . Предшествующее удаление участков тонкой кишки для лечения предшествующих заболеваний является основной причиной синдрома короткой кишки (СКК), основной причины трансплантации кишечника. | |
| Другие имена | Трансплантация тонкой кишки |
| МКБ-9-КМ | 46.97 |
Трансплантация кишечника ( трансплантация кишечника или трансплантация тонкой кишки ) — это хирургическая замена тонкой кишки при хронических и острых случаях кишечной недостаточности . Хотя кишечную недостаточность часто можно лечить альтернативными методами лечения, такими как парентеральное питание (ПП), осложнения, такие как ПП-ассоциированное заболевание печени и синдром короткой кишки , могут сделать трансплантацию единственным приемлемым вариантом. Трансплантация кишечника, являющаяся одним из самых редких видов трансплантации органов , становится все более распространенной в качестве терапевтического варианта благодаря улучшениям в иммуносупрессивных режимах , хирургической технике, ПП и клиническом ведении пациентов до и после трансплантации. [ необходима цитата ]
История
Трансплантация кишечника началась в 1959 году, когда группа хирургов из Университета Миннесоты под руководством Ричарда К. Лиллехаи сообщила об успешной трансплантации тонкого кишечника у собак. Пять лет спустя, в 1964 году, Ральф Детерлинг в Бостоне предпринял попытку первой пересадки кишечника человеку, хотя и безуспешно. В течение следующих двух десятилетий попытки пересадки тонкого кишечника людям заканчивались всеобщей неудачей, и пациенты умирали от технических осложнений, сепсиса или отторжения трансплантата . Однако открытие иммунодепрессанта циклоспорина в 1972 году вызвало революцию в области трансплантационной медицины. Благодаря этому открытию в 1988 году первая успешная пересадка кишечника была проведена в Германии Э. Дельцем, а вскоре за ним последовали группы во Франции и Канаде. Трансплантация кишечника больше не была экспериментальной процедурой, а скорее терапией, спасающей жизни. В 1990 году на рынке появился новый иммунодепрессант, такролимус , как превосходная альтернатива циклоспорину. За два десятилетия с тех пор попытки трансплантации кишечника значительно улучшились как по количеству, так и по результатам. [1] [2]
Предтрансплантационная диагностика и синдром короткой кишки
Недостаточность тонкого кишечника опасна для жизни из-за неспособности усваивать питательные вещества , жидкости и электролиты из пищи. Без этих необходимых веществ и способности поддерживать энергетический баланс гомеостаз не может поддерживаться, и прогноз будет неутешительным. Причины кишечной недостаточности могут быть клинически сложными и могут быть результатом сочетания пищевых, инфекционных , травматических и метаболических осложнений, которые влияют на обычную анатомию и физиологию . [3] Многие основные состояния, которые служат предшественниками недостаточности, имеют генетический или врожденный характер. Например, сильное воспаление , язва , непроходимость кишечника , свищ , перфорация или другие патологии болезни Крона могут серьезно нарушить функцию кишечника. [4] Несмотря на опасность, которую эти состояния могут представлять сами по себе, они могут привести к еще более серьезным осложнениям, которые потребуют замены больного кишечника. Единственной ведущей причиной трансплантации кишечника является синдром короткой кишки , часто являющийся вторичным состоянием какой-либо другой формы кишечного заболевания. [5] [6] Синдром короткой кишки был причиной 73% трансплантаций кишечника в Америке в 2008 году, за ним следовали функциональные проблемы с кишечником в 15% и другие причины, составляющие 12% случаев. [7] Естественный синдром раздраженного кишечника встречается, к счастью, редко, по оценкам, 3 на 100 000 рождений. [8] Хирургическое удаление является наиболее распространенной причиной, выполняемой в качестве лечения различных гастроэнтерологических и врожденных состояний, таких как болезнь Крона, некротизирующий энтероколит , мезентериальная ишемия , нарушение моторики , омфалоцеле / гастрошизис , опухоли и заворот кишок . [9]
Альтернативные методы лечения

Независимо от основного состояния, потеря функции кишечника не обязательно требует трансплантации. Некоторые состояния, такие как некротизирующий энтероколит или заворот кишок, могут быть адекватно устранены другими хирургическими и нехирургическими методами лечения, особенно если SBS никогда не разовьется. Человек может получать питательные вещества внутривенно через PN, полностью минуя потребление пищи и ее последующее переваривание . Длительное выживание с SBS и без PN возможно при энтеральном питании , но этого недостаточно для многих пациентов, поскольку это зависит от способности оставшегося кишечника адаптироваться и увеличить свою всасывающую способность. [3] Хотя это сложнее и дороже в выполнении, любой человек может получить PN. Хотя PN может удовлетворить все потребности в энергии, жидкости и питательных веществах и может выполняться дома, качество жизни может быть значительно снижено. В среднем PN занимает от 10 до 16 часов, но может занять до 24 часов. За этот период повседневная жизнь может быть значительно затруднена из-за присоединения к внутривенному насосу . [5] [10] В течение длительного времени ПН может привести к многочисленным проблемам со здоровьем, включая сильное обезвоживание , инфекции, связанные с катетером , и заболевания печени. [2] [11] Заболевания печени, связанные с ПН, поражают до 50% пациентов в течение 5–7 лет, что коррелирует с уровнем смертности 2–50%. [11]
Другим альтернативным методом лечения трансплантации для пациентов с SBS является хирургическое удлинение кишечника с помощью либо последовательной поперечной энтеропластики (STEP), либо более старой техники продольного удлинения и подгонки кишечника (LILT). Хотя обе процедуры способствуют приблизительно 70% увеличению длины, STEP кажется несколько более благоприятным с точки зрения более низкой смертности и прогрессирования трансплантации. [12] Тем не менее, позитивный прием любой из этих процедур может снизить уровень необходимого PN, если не свести на нет его необходимое использование вообще. [8] [13]
Показания
Существует четыре показания, одобренных Medicare и Medicaid для трансплантации кишечника: потеря двух из шести основных путей венозного доступа , множественные эпизоды опасного для жизни сепсиса, связанного с катетером , нарушения водно-электролитного баланса на фоне максимальной медикаментозной терапии и заболевания печени, связанные с ПП. Трансплантация также может быть выполнена, если рост и развитие ребенка не наступают или в экстремальных обстоятельствах для пациентов с исключительно низким качеством жизни на ПП. [14] [15] Следует проконсультироваться с многопрофильной командой, состоящей из хирургов-трансплантологов , гастроэнтерологов , диетологов , анестезиологов , психиатров , финансовых представителей и других специалистов , чтобы оценить план лечения и убедиться, что трансплантация является наилучшим вариантом для пациента. Также следует провести психологическую подготовку для команды по трансплантации и пациента. Раннее направление требует доверия между всеми сторонами, участвующими в операции, чтобы гарантировать, что поспешное решение не приведет к преждевременной трансплантации. [11] [16]
Другие абсолютные противопоказания к получению кишечной трансплантации включают наличие системных и нелеченных местных инфекций, злокачественный рак, тяжелые неврологические нарушения и тяжелые сердечные и/или легочные заболевания . Эти критерии аналогичны установленным рекомендациям для трансплантации других типов органов. [17] ВИЧ-инфекция является относительным противопоказанием для трансплантации кишечника; отчаянные терминальные пациенты могут принять трансплантацию от ВИЧ-положительного донора, если они готовы подвергнуть себя воздействию ВИЧ. [14]
Типы трансплантации
Существует три основных типа трансплантации кишечника: изолированный кишечный трансплантат , комбинированный кишечно-печеночный трансплантат и мультивисцеральный трансплантат, при котором могут быть трансплантированы и другие органы брюшной полости . При самом простом и распространенном трансплантате, изолированном кишечном трансплантате, трансплантируются только участки тощей и подвздошной кишки . [18] Они выполняются при отсутствии печеночной недостаточности. В случае тяжелой дисфункции печени из-за ПН, дефицита ферментов или других основных факторов печень может быть трансплантирована вместе с кишечником. При мультивисцеральном трансплантате в трансплантат могут быть включены желудок , двенадцатиперстная кишка , поджелудочная железа и/или толстая кишка . Мультивисцеральные трансплантаты рассматриваются, когда основное состояние значительно ухудшает другие отделы пищеварительной системы, такие как внутрибрюшные опухоли, которые еще не дали метастазов , обширный венозный тромбоз или артериальная ишемия брыжейки и синдромы моторики. [11] [17]
Предоперационный период
Пожертвованные кишки, как и все органы, должны быть сопоставлены с реципиентом до восстановления, чтобы подготовить его или ее и минимизировать время, которое орган проводит вне тела . [5] Потенциальные реципиенты помещаются в Международный реестр трансплантации кишечника (ITR), где они вносят свой вклад в растущее в мире понимание трансплантации кишечника. Перед тем, как может быть выполнена трансплантация, орган должен быть сначала найден. В Соединенных Штатах сопоставление всех органов координируется Объединенной сетью по обмену органами (UNOS). Стандартный донор кишечника умирает с диагнозом смерть мозга . [19] С точки зрения результатов трансплантации доноры со смертью мозга гораздо предпочтительнее доноров, которые перенесли сердечно-легочную смерть . Если дыхание может быть подкреплено аппаратом искусственной вентиляции легких , доноры со смертью мозга могут демонстрировать сохраняющуюся сердечную , эндокринную и выделительную функции. При надлежащем управлении продолжение кровотока и метаболизма в организме позволяет получить более здоровые органы для забора и дополнительное время для подготовки реципиентов к трансплантации. [20] Кроме того, возможно извлечение терминальной части подвздошной кишки у живых доноров. [21] и разрабатывается лапароскопическая техника для забора ограниченных участков тонкой кишки у живых доноров. [22] При определении потенциальных совпадений донора и реципиента важными характеристиками являются размер донора, возраст, качество ткани , а также совместимость по системе ABO и гистосовместимость . [11] [21] Если кишечник слишком большой, его нельзя трансплантировать молодым или маленьким пациентам. В идеале кишечник следует выбирать у доноров с меньшим весом, чем предполагаемые реципиенты, чтобы обеспечить простое закрытие брюшной раны. [23] Если пациент слишком молод или слишком стар, он может оказаться недостаточно выносливым, чтобы пережить операцию и период восстановления. [11] Если органы донора и реципиента не соответствуют требованиям совместимости, угроза отторжения органа организмом почти неизбежна.
Отторжение органа — это неудачное обстоятельство, когда иммунная система хозяина распознает пересаженный орган как чужеродный. Это самое заметное осложнение, с которым сталкиваются реципиенты трансплантата. Благодаря рецепторам Т-клеток Т-лимфоциты способны различать свое и чужое, распознавая человеческие лейкоцитарные антигены (HLA), связанные с белком главного комплекса гистосовместимости (MHC) , расположенным на поверхности клеток органа . После идентификации чужеродного органа иммунная система приступает к его уничтожению. Тест на панельно-реактивные антитела (PRA) измеряет долю популяции, на которую реципиент будет реагировать посредством уже существующих антител к различным антигенам HLA ; другими словами, насколько вероятно, что пациент остро отторгнет свой новый трансплантат. Поэтому крайне важно, чтобы статусы HLA и PRA были проверены и продемонстрировали низкую иммунореактивность пациента к трансплантату. [2] [21] [24] В некоторых случаях реципиент может страдать от реакции «трансплантат против хозяина» , при которой клетки пересаженного органа атакуют клетки реципиента. [25]
Чтобы обеспечить надлежащую гистосовместимость, качество тканей и безопасность от инфекции, анализы крови следует собирать и тестировать в лаборатории. В дополнение к типированию HLA и PRA, как донору, так и реципиенту следует провести общий анализ крови (ОАК), коагуляционный профиль, полную метаболическую панель и тесты на определение группы крови ABO . [2] ABO-несовместимые трансплантаты иногда можно проводить у очень маленьких детей, поскольку их иммунная система еще не полностью развита и для которых смертность в листе ожидания остается высокой. [14] Кроме того, сыворотку крови следует проверять на наличие вирусов , включая ВИЧ, гепатит B и C , цитомегаловирус (ЦМВ) и антитела к вирусу Эпштейна-Барр (EBV), чтобы предотвратить инфекцию. [24] Особенно в иммунодефицитной системе, необходимой для трансплантации, эти вирусы могут нанести ущерб организму и стать чрезвычайно опасными, даже смертельными. Даже при здоровых физиологических уровнях, совместимости по системам ABO и HLA и отсутствии признаков бактериальных, вирусных и грибковых инфекций трансплантация органов не лишена экстрахирургического риска. [2]
Список ожидания и результаты пожертвований
Основной проблемой, с которой сталкивается индустрия кишечной трансплантации, является удовлетворение потребности в трансплантируемых кишечниках, особенно в Соединенных Штатах, где проводится большинство кишечных трансплантаций. [9] Существует узкий временной интервал между закупкой и трансплантацией, в течение которого любой орган остается жизнеспособным, и возникают логистические проблемы, связанные с объединением органа и реципиента. Во время закупки органы, которые извлекаются, охлаждаются и перфузируются консервирующим раствором. Это замедляет активность органа и увеличивает время, в течение которого они остаются жизнеспособными для трансплантации. [2] Хотя охлаждение и перфузия могут продлить срок службы кишечника на несколько часов, отказ все равно неизбежен, если не провести трансплантацию. Этот промежуток времени между охлаждением органа во время закупки и восстановлением физиологической температуры во время имплантации является временем холодной ишемии. Из-за чувствительности кишечника к ишемическому повреждению многие потенциальные донорские кишечники теряются в результате событий, следующих за смертью мозга и травмой. Кроме того, необратимое повреждение кишечника наблюдается примерно через 5 часов холодовой ишемии в виде повреждения слизистой оболочки и бактериальной транслокации за пределы желудочно-кишечного тракта . Поэтому обеспечение выживания сердца и близость донора и реципиента перед забором имеют важное значение, чтобы органы не ждали слишком долго вне тела и без кровотока. [11] Существует не только нехватка пригодного для трансплантации кишечника, но и дефицит числа центров, обладающих возможностью проведения сложной процедуры трансплантации. По состоянию на 2005 год [обновлять]в мире было всего 61 медицинский центр, способный выполнить трансплантацию кишечника. [9] Кроме того, многие маленькие дети, особенно те, которые весят менее 5 кг , не могут найти трансплантат из-за отсутствия доноров подходящего размера. [8]
Несмотря на эти проблемы, получение кишечника для трансплантации в Соединенных Штатах весьма вероятно. В 2008 году в списке ожидания кишечной трансплантации в США было 212 человек, 94% из которых были гражданами США. [7] Независимо от типа трансплантации, более половины новых регистрантов были в возрасте 5 лет или младше. Взрослые составляют следующую по величине когорту, за которой следуют дети в возрасте 6 лет и старше. В 2008 году этнический состав списка ожидания кишечной трансплантации был следующим: 65% белых , 18% черных , 16% латиноамериканцев , 1% азиатов и 0,5% других или смешанных рас , что напоминало демографические данные всего населения Америки в то время, за исключением когорты азиатов ниже среднего. Группы крови ABO также соответствовали общей популяции: 31% A, 14% B, 5% AB и 50% O. [7] В 2004 году средний период ожидания трансплантации составлял 220 дней, [21] при медиане 142 дня в 2008 году. [7] Скорость добавления в список ожидания менялась из года в год; прирост увеличивался до 2006 года (добавилось 317 человек), но затем снизился в 2012 году (добавилось 124 человека). [26] В 2007 году только 9% пациентов в списке ожидания в США умерли в ожидании трансплантации. [7] Смертность в списке ожидания достигла пика около 2002 года и была самой высокой среди пациентов с заболеваниями печени и кишечника (детей). Смертность среди всех детских групп, ожидающих трансплантации кишечника и печени, снизилась в годы, предшествовавшие 2014 году, тогда как смертность взрослых от заболеваний кишечника и печени снизилась не так резко. Снижение в последние годы, вероятно, связано с улучшением ухода за младенцами с кишечной недостаточностью и, как следствие, уменьшением числа направлений на трансплантацию. [26] Хотя в Штатах было достигнуто много улучшений, результаты везде по-прежнему демонстрируют большие возможности для улучшения. Во всем мире 25% детей, ожидающих кишечную трансплантацию, умирают до того, как они смогут ее получить. [8]
Протокол закупок
После подбора органа сложная закупка тонкой кишки может быть выполнена командой хирургов-трансплантологов брюшной полости. После того, как донор был выбран и одобрен для донорства, может быть начато несколько предварительных обработок для уничтожения микроорганизмов и иммунных клеток . Кишечник донора должен быть дезактивирован несколькими антибиотиками , включая неомицин , эритромицин , амфотерицин B и цефалоспорин . [18] Их также можно лечить антилимфоцитарными антителами ( антитимоцитарный глобулин , алемтузумаб ), облучением, направленным против избыточной мезентериальной лимфатической ткани , и промыванием кишечника . [17]
После завершения подготовки донора можно начинать забор, используя те же стандартные методы, что и для всех заборов органов брюшной полости. Команда обнажает брюшную полость и вставляет две канюли для инфузии раствора для консервации органов Университета Висконсина в аорту и нижнюю брыжеечную вену . Поскольку органы брюшной полости охлаждаются на месте , окружающие ткани рассекаются , чтобы их можно было быстро извлечь. На следующем этапе аорта пережимается , прекращая кровоснабжение органов. Как только подача крови и кислорода к органу прекращается, смерть органа быстро приближается, если не предпринять шаги для их сохранения до трансплантации. Поэтому органы полностью осушаются от крови , промываются прохладным консервирующим раствором и удаляются из организма. [2] [18] При изолированной кишечной трансплантации толстая кишка будет отделена от тонкой кишки. Слепая кишка и восходящая ободочная кишка деваскуляризируются, при этом принимаются меры для сохранения основных сосудов в подвздошной кишке. Тощая кишка будет отделена от двенадцатиперстной кишки, при этом сохраняя сосудистую сеть тощей кишки, подвздошной кишки, брыжейки и поджелудочной железы. Если поджелудочная железа здорова, ее часто можно извлечь в качестве дополнительной изолированной заготовки. Кишечный аллотрансплантат, когда он готов к извлечению, прикрепляется брыжеечной ножкой, где сосуды сходятся из кишечной системы. Эта ножка будет скреплена скобами и может быть отделена от тела с помощью поперечного разреза для создания сосудистой манжеты. Затем полный кишечный аллотрансплантат можно удалить и обернуть в хирургическое полотенце . [18] Протоколы для комбинированных печеночных и мультивисцеральных заготовок гораздо сложнее и тщательнее, чем для изолированного кишечника. [ требуется ссылка ]
Протокол трансплантации
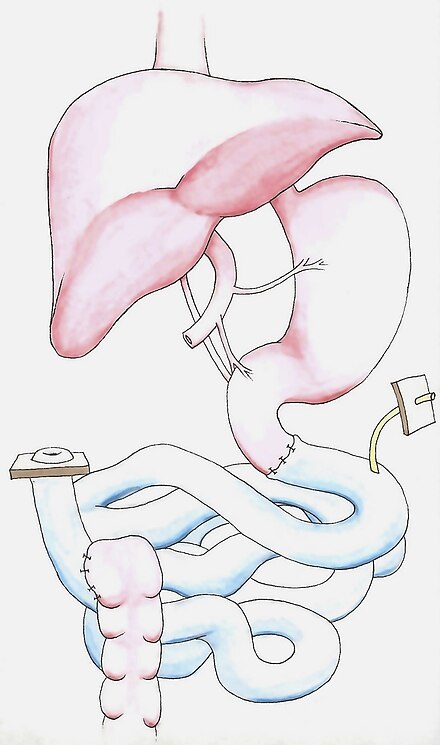
Во-первых, необходимо удалить любую рубцовую ткань брюшной полости от предыдущих операций. Аорта и нижняя полая вена рассекаются в рамках подготовки к сосудистому анастомозу , после чего следует рассечение проксимального и дистального концов пищеварительного тракта. Затем выполняется анастомоз для реваскуляризации трансплантата. Артериальные сосуды соединяются с брюшной аортой, ниже почек . Однако венозный дренаж или повторное присоединение трансплантированного органа к венозной системе может выполняться по-разному в зависимости от уникальной внутрибрюшной сосудистой сети реципиента. Трансплантат обычно дренируется системно в инфраренальную полую вену [15] , но также может дренироваться портально в печеночный порт или верхнюю брыжеечную вену [17] . Затем трансплантат реперфузируется кровью, и любое кровотечение останавливается до того, как проксимальный и дистальный концы трансплантированного кишечника будут соединены с исходным пищеварительным трактом. Затем создается петлевая илеостома , которая обеспечивает легкий доступ для будущего эндоскопического наблюдения и биопсии . Гастрономическая или еюностомическая питательная трубка может быть установлена до того, как будет закрыта брюшная стенка. [2]
Когда печень пересаживается вместе с кишечником, реципиенту сначала необходимо удалить собственную печень . После этого аорта, полая вена и воротная вена донора и реципиента анастомозируются. Затем трансплантат промывается перед снятием кавальных зажимов . Затем кишечник реконструируется как при изолированной кишечной трансплантации, прежде чем его подключат к желчному протоку, обслуживающему новую печень. [17] Мультивисцеральные трансплантации особенно сложны и подвержены осложнениям, поскольку все органы должны пережить объединенное получение, транспортировку и трансплантацию. Все три эти меры подбираются с учетом индивидуальных потребностей реципиента. [18] Сохранение нативной селезенки , поджелудочной железы и двенадцатиперстной кишки во время мультивисцеральной трансплантации может снизить риск дополнительных осложнений, связанных с этими структурами. [11]
Послеоперационный период
После процедуры пациент находится под активным наблюдением в отделении интенсивной терапии (ОИТ). Вводятся антибиотики широкого спектра действия , контролируется кровотечение, измеряются уровень pH сыворотки и лактата для подтверждения кишечной ишемии. Иммунная система пациента сильно модулируется сразу после операции. Начальная фаза лечения состоит из введения такролимуса с кортикостероидами для подавления активации Т-лимфоцитов. Затем вводятся различные наборы антагонистов рецепторов интерлейкина-2 (ИЛ-2) ( даклизумаб , базиликсимаб ), антипролиферативные агенты ( азатиоприн, микофенолата мофетил) и препараты циклофосфамид и сиролимус индивидуально для каждого пациента для дальнейшего подавления иммунной системы. [11] Биодоступность этих препаратов зависит от площади поверхности кишечника и времени транзита , и поэтому длина аллотрансплантата определяет режим иммуносупрессии. [2] Внутривенное введение простагландина E1 иногда выполняется в течение первых 5–10 дней после трансплантации для улучшения кишечного кровообращения и потенциального распределения иммунодепрессивных эффектов. [2] [11] Кишечник выборочно деконтаминируется от высокорисковой флоры , и принимаются профилактические меры против ЦМВ и грибковых инфекций. [11]
Идеально начинать энтеральное питание как можно раньше после трансплантации. Поэтому зонд для кормления, соединяющийся с желудком или тонкой кишкой, быстро устанавливается для облегчения реабилитации. [11] Если функция желудочно-кишечного тракта восстановлена, диету можно восстановить и осторожно продвигать по мере переносимости. Большинство пациентов отучаются от ПП в течение 4 недель после трансплантации, и почти все освобождаются от дополнительных энтеральных добавок в течение одного года. [14] Доказательства восстановления функции включают уменьшение возврата гастростомической трубки и увеличение газа и кишечного содержимого в илеостоме. [2] Регулярная контрольная эндоскопия и биопсия через илеостому должны проводиться с уменьшающейся частотой в течение нескольких месяцев, чтобы наблюдать признаки отторжения, в идеале до того, как проявятся клинические симптомы. Если пациент продолжает хорошо себя чувствовать в течение первого года после трансплантации, илеостома, как правило, закрывается. Если в будущем возникнет подозрение на отторжение, будут выполнены эндоскопии и будет разработана соответствующая терапия против отторжения. Среднее время выписки из больницы варьируется в зависимости от процедуры. Медианное время для изолированной кишечной, кишечно-печеночной и мультивисцеральной трансплантации составляет 30, 60 и 40 дней после операции соответственно. [14] В течение первых нескольких месяцев должна нормализоваться абсорбционная способность углеводов и аминокислот , а затем абсорбционная способность жиров. Как только энтеральное питание способно обеспечить все потребности в питании, ПП можно прекратить. [2] Почти все пациенты с успешной трансплантацией освобождаются от ПП в течение одного года. [14]
Биологические осложнения
Трансплантация кишечника является наименее выполняемым типом трансплантации из-за ряда уникальных препятствий. Наиболее важным из них является глубокая иммуносупрессия, необходимая из-за способности кишечника вызывать сильные иммунные реакции. Из-за воздействия широкого спектра кишечной флоры и потребляемого организмом материала кишечный эпителий обладает высокоразвитой врожденной иммунной системой и антигенпрезентирующими способностями. Иммуносупрессия является основным фактором, определяющим результат при трансплантации тонкой кишки; риск отторжения трансплантата увеличивается при недостаточной иммуносупрессии, а риск местной и системной инфекции — при чрезмерной иммуносупрессии. [11] Поэтому обеспечение надлежащей дозы иммунодепрессанта может быть затруднено, особенно с учетом того, что и циклоспорин (14–36%), и такролимус (8,5–22%) имеют, как правило, низкую биодоступность. [27] Основной проблемой, связанной с иммуносупрессией у пациентов с кишечной трансплантацией, является посттрансплантационное лимфопролиферативное расстройство , при котором В-лимфоциты чрезмерно размножаются из-за инфекции ВЭБ и приводят к поражениям, подобным инфекционному мононуклеозу . [7] Реципиенты кишечной трансплантации также подвержены риску хронической почечной недостаточности , поскольку ингибиторы кальциневрина токсичны для почек. Реципиент трансплантации должен принимать иммунодепрессанты до конца своей жизни. [14]
Трансплантаты кишечника очень восприимчивы к инфекции, даже больше, чем стандартный иммунодефицитный реципиент других органов из-за большого состава и разнообразия кишечной флоры. [11] Сложный набор микроорганизмов населяет пищеварительный тракт человека, с концентрацией до 10 4 –10 7 КОЕ /мл в тощей и подвздошной кишке и 10 11 –10 12 КОЕ/мл в толстой кишке. [28] Хотя подавление иммунной системы может предотвратить иммунную атаку на новый аллотрансплантат, оно также может помешать способности иммунной системы удерживать определенные популяции кишечных микробов в узде. Несмотря на предварительную и последующую дезактивацию трансплантата, реципиенты подвергаются риску местной и системной инфекции как естественной, так и внешней флорой. Распространенным симптомом дисфункции трансплантата, будь то из-за инфекции, отторжения или какого-либо другого состояния, является диарея . [15]
Результаты и влияние трансплантации
Результаты трансплантации кишечника значительно улучшились в последние годы. Несмотря на небольшие несоответствия в процентах выживаемости между центрами в Северной Америке, Европе, Австралии и других местах, трансплантация кишечника в основном приближается к показателям выживаемости трансплантации легких . [11] В течение одного года показатели выживаемости трансплантата для изолированного кишечника в настоящее время колеблются около 80% и 70% для кишечно-печеночного и мультивисцерального. За тот же период времени выживаемость пациентов для пациентов с изолированным кишечником может даже превышать 90%, в то время как более сложные трансплантации нескольких органов не показывают никакого увеличения выживаемости пациентов по сравнению с пациентами, выживающими только с кишечным трансплантатом. [14] Пятилетняя выживаемость пациентов и трансплантатов колеблется от 50 до 80% (общее среднее значение 60%), в зависимости от основного заболевания и предоперационной заболеваемости . У очень молодых (<1 года) и очень старых (>60 лет) пациентов, получающих трансплантат, наблюдаются выраженные показатели смертности. [14] [15] Через 4 года выживаемость детей значительно ухудшается по сравнению со взрослыми. [14]
Несколько факторов, связанных с превосходным прогнозом для пациента и трансплантата, оказались статистически значимыми. Пациенты, которые были госпитализированы для трансплантации непосредственно из дома, а не из больницы, молодые пациенты старше одного года, те, кто получает свою первую трансплантацию, те, кто получает трансплантацию в опытных центрах трансплантации, и те, кто получает индукционную терапию на основе антител или сиролимуса, имеют более высокие показатели выживаемости. [9] [15] Кроме того, было обнаружено, что лежащая в основе этиология , [29] наличие сопутствующих заболеваний , частота предыдущих операций, статус питания и уровень функции печени влияют на выживаемость пациента и трансплантата. [30] Было обнаружено, что пациенты с предтрансплантационным диагнозом заворота кишок имеют более низкий риск смертности. [29] По состоянию на 2008 год, самая длинная зарегистрированная выживаемость трансплантата составила 18 лет. [14] В период с 1999 по 2008 год в Соединенных Штатах было проведено 131 повторная трансплантация. [7]
Улучшение качества жизни после кишечной трансплантации является значительным. Из живых пациентов через 6 месяцев после трансплантации, 70% считаются полностью восстановившими кишечную функцию, 15% находятся на частичной функции, а 15% были удалены из трансплантатов. [9] [14] У тех, у кого полная функция, энтеральная пищевая автономия высока. [7] Возможность возобновить регулярные действия, такие как способность потреблять пищу и осуществлять контроль над пищеварительной функцией, безусловно, является желанным возвращением для пациентов. Низкое качество жизни, вызванное кишечной недостаточностью, часто дополнительно дополняется значительной психосоциальной инвалидностью и наркотической зависимостью . После трансплантации, как было обнаружено, они, как правило, уменьшаются. [15] Согласно опросам, сравнивающим пациентов, перенесших трансплантацию, и тех, кто не перенес ее, у реципиентов трансплантата, по-видимому, наблюдается значительное улучшение в таких областях, как тревожность , депрессия, внешний вид , стресс , воспитание детей , импульсивность , оптимизм , соблюдение врачебных предписаний и качество отношений . [14] [15] [31]
Финансовые соображения
Получение трансплантата любого типа является весьма значительным вложением в финансовом отношении, но успешная, хорошо функционирующая трансплантация может быть очень экономически эффективной по сравнению с альтернативными методами лечения. Общие расходы на поддержание ПП на дому могут достигать более 150 000 долларов в год, хотя фактическая стоимость питания обычно составляет всего 18–22 доллара в день. [5] [14] Это не включает расходы на дополнительную домашнюю поддержку, оборудование и уход за осложнениями, связанными с ПП. Расходы, связанные с проведением трансплантации кишечника, включая первоначальную госпитализацию для трансплантации, могут варьироваться от 150 000 до 400 000 долларов, а повторные госпитализации являются обычным явлением вплоть до второго года. Через два-три года после трансплантации финансовые расходы на трансплантацию достигают паритета с ПП и становятся более экономически эффективными в дальнейшем. [11] [14]
Ссылки
- ^ Тодо, Сатору; Цакис, Андреас; Абу-Элмагд, Карим; Рейес, Хорхе; Старзл, Томас Э. (1994). «Современное состояние трансплантации кишечника». Advances in Surgery . 27 : 295–316 . PMC 2954648. PMID 8140977 .
- ^ abcdefghijkl Трансплантация кишечника в eMedicine
- ^ ab Duran, Beyhan (2005). «Влияние длительного полного парентерального питания на иммунитет слизистой оболочки кишечника у детей с синдромом короткой кишки: систематический обзор». BMC Nursing . 4 (1): 2. doi : 10.1186/1472-6955-4-2 . PMC 549542 . PMID 15686591.
- ^ Болезнь Крона в eMedicine
- ^ abcd Бухман, Алан Л.; Сколапио, Джеймс; Фрайер, Джон (2003). «Технический обзор AGA по синдрому короткой кишки и трансплантации кишечника». Гастроэнтерология . 124 (4): 1111– 34. doi :10.1016/S0016-5085(03)70064-X. PMID 12671904.
- ^ Синдром короткой кишки в eMedicine
- ^ abcdefgh Мазариегос, Г. В.; Стеффик, Д. Э.; Хорслен, С.; Фармер, Д.; Фрайер, Дж.; Грант, Д.; Лангнас, А.; Маги, Дж. К. (2010). «Трансплантация кишечника в Соединенных Штатах, 1999–2008» (PDF) . Американский журнал трансплантологии . 10 (4 Pt 2): 1020–34 . doi : 10.1111/j.1600-6143.2010.03044.x . hdl :2027.42/79108. PMID 20420650.
- ^ abcd Мирс, Элис; Лакхулла, Кокила; Миллар, Аластер Дж. В. (2010). «Синдром короткого кишечника» (PDF) . В Аме, Эммануэль А.; Биклер, Стивен В.; Лакхулла, Кокила; Нвоме, Бенедикт К.; Поенару, Дэн (ред.). Детская хирургия: всеобъемлющий текст для Африки. Глобальная помощь. стр. 424–8 . ISBN 978-1-60189-091-7.
- ^ abcde Грант, Дэвид; Абу-Элмагд, Карим; Рейес, Хорхе; Цакис, Андреас; Лангнас, Алан; Фишбейн, Томас; Гуле, Оливье; Фармер, Дуглас (2005). «Отчет о реестре трансплантации кишечника за 2003 год». Annals of Surgery . 241 (4): 607– 13. doi :10.1097/01.sla.0000157265.85388.a1. PMC 1357064. PMID 15798462 .
- ^ Koletzko, Berthold; Goulet, Olivier; Hunt, Joanne; Krohn, Kathrin; Shamir, Raanan (2005). "1. Руководство по парентеральному питанию у детей Европейского общества детской гастроэнтерологии, гепатологии и питания (ESPGHAN) и Европейского общества клинического питания и метаболизма (ESPEN), поддержанное Европейским обществом педиатрических исследований (ESPR)". Журнал детской гастроэнтерологии и питания . 41 (Suppl 2): S1–87. doi : 10.1097/01.mpg.0000181841.07090.f4 . PMID 16254497. S2CID 42811817.
- ^ abcdefghijklmnop Garg, Mayur; Jones, Robert M; Vaughan, Rhys B; Testro, Adam G (2011). «Трансплантация кишечника: Текущее состояние и будущие направления». Журнал гастроэнтерологии и гепатологии . 26 (8): 1221– 8. doi : 10.1111/j.1440-1746.2011.06783.x . PMID 21595748.
- ^ Frongia, Giovanni; Kessler, Markus; Weih, Sandra; Nickkholgh, Arash; Mehrabi, Arianeb; Holland-Cunz, Stefan (2013). «Сравнение процедур LILT и STEP у детей с синдромом короткой кишки – систематический обзор литературы». Журнал детской хирургии . 48 (8): 1794– 805. doi :10.1016/j.jpedsurg.2013.05.018. PMID 23932625.
- ^ Бьянки, А (1997). «Продольное удлинение и подгонка кишечника: результаты у 20 детей». Журнал Королевского медицинского общества . 90 (8): 429–32 . doi :10.1177/014107689709000804. PMC 1296456. PMID 9306995 .
- ^ abcdefghijklmno Вианна, Родриго М.; Мангус, Ричард С.; Тектор, А. Джозеф (2008). «Текущий статус тонкокишечной и мультивисцеральной трансплантации». Достижения хирургии . 42 : 129–50 . дои : 10.1016/j.yasu.2008.03.008. ПМИД 18953814.
- ^ abcdefg Фишбейн, Томас М. (2009). «Трансплантация кишечника». New England Journal of Medicine . 361 (10): 998– 1008. doi :10.1056/NEJMra0804605. PMID 19726774. S2CID 205115492.
- ^ Фишбейн, Томас М.; Мацумото, Кэл С. (2006). «Заместительная кишечная терапия: сроки и показания для направления пациентов на программу кишечной реабилитации и трансплантации». Гастроэнтерология . 130 (2 Suppl 1): S147–51. doi : 10.1053/j.gastro.2005.12.004 . PMID 16473063.
- ^ abcde Троппманн, Кристоф; Грюссне, Райнер В.Г. (2001). «Трансплантация кишечника». В Хольцхаймере — Рене Г; Манник, Джон А. (ред.). Хирургическое лечение: научно обоснованное и проблемно-ориентированное . Мюнхен: Цукшвердт. ISBN 3-88603-714-2.
- ^ abcde Yersiz, Hasan; Renz, John F.; Hisatake, Garrett M.; Gordon, Sherylin; Saggi, Bob H.; Feduska, Nicholas J.; Busuttil, Ronald W.; Farmer, Douglas G. (2003). «Мультивисцеральные и изолированные методы кишечного забора». Трансплантация печени . 9 (8): 881– 6. doi : 10.1053/jlts.2003.50155 . PMID 12884206.
- ^ Грюсснер, Райнер WG; Шарп, Харви Л. (1997). «Трансплантация кишечника от живого: первый отчет о стандартизированной хирургической технике». Трансплантация . 64 (11): 1605–7 . doi : 10.1097/00007890-199712150-00019 . PMID 9415566.
- ^ Лок, Маргарет М. (2002). Дважды мертв: пересадка органов и переосмысление смерти . Издательство Калифорнийского университета. ISBN 978-0-520-22814-6.[ нужна страница ]
- ^ abcd Теста, Джулиано; Панаро, Фабрицио; Шена, Стефано; Холтерман, Марк; Абкариан, Геранд; Бенедетти, Энрико (2004). «Трансплантация тонкой кишки, связанная с жизнью». Анналы хирургии . 240 (5): 779–84 . doi :10.1097/01.sla.0000143266.59408.d7. ПМЦ 1356482 . ПМИД 15492558.
- ^ Ким, WW; Гагнер, M.; Фукуяма, S.; Хунг, TI; Бирто, L.; Якоб, BP; Джентилески, P. (2002). «Лапароскопическое взятие тонкокишечного трансплантата для трансплантации тонкого кишечника». Хирургическая эндоскопия . 16 (12): 1786– 9. doi :10.1007/s00464-001-8249-9. PMID 12239647. S2CID 9202249.
- ^ Абу-Элмагд, Карим; Фунг, Джон; Буэно, Хавьер; Мартин, Долли; Мадариага, Хуан Р.; Мазариегос, Джордж; Бонд, Джеффри; Молменти, Эрнесто; Корри, Роберт Дж.; Старзл, Томас Э.; Рейес, Хорхе (2000). «Логистика и техника получения кишечных, панкреатических и гепатотрансплантатов от одного донора». Annals of Surgery . 232 (5): 680– 7. doi :10.1097/00000658-200011000-00010. PMC 1421222. PMID 11066140 .
- ^ ab Tietz, Norbert W. (1995). Клиническое руководство по лабораторным тестам . WB Saunders. ISBN 978-0-7216-5035-7.[ нужна страница ]
- ^ Пашер, Андреас; Колер, Свен; Нойхаус, Петер; Пратшке, Иоганн (2008). «Современное состояние и будущие перспективы трансплантации кишечника». Transplant International . 21 (5): 401– 14. doi : 10.1111/j.1432-2277.2008.00637.x . PMID 18282247.
- ^ ab Khan, KM; Desai, CS; Mete, M.; Desale, S.; Girlanda, R.; Hawksworth, J.; Matsumoto, C.; Kaufman, S.; Fishbein, T. (2014). «Развивающиеся тенденции в списке ожидания кишечной трансплантации». Американский журнал трансплантологии . 14 (12): 2830– 7. doi : 10.1111/ajt.12919 . PMID 25395218. S2CID 12062834.
- ^ Хеберт, М (1997). «Вклад печеночного и кишечного метаболизма и P-гликопротеина в пероральную доставку лекарств циклоспорина и такролимуса». Advanced Drug Delivery Reviews . 27 ( 2–3 ): 201–214 . doi :10.1016/S0169-409X(97)00043-4. PMID 10837558.
- ^ О'Хара, Энн М.; Шанахан, Фергус (2006). «Флора кишечника как забытый орган». EMBO Reports . 7 (7): 688–93 . doi :10.1038/sj.embor.7400731. PMC 1500832. PMID 16819463 .
- ^ ab Lao, OB; Healey, PJ; Perkins, JD; Horslen, S.; Reyes, JD; Goldin, AB (2010). «Результаты у детей после трансплантации кишечника». Pediatrics . 125 (3): e550–8. doi :10.1542/peds.2009-1713. PMC 2854035 . PMID 20142294.
- ^ Кравинкель, Майкл Б; Шольц, Дитмар; Буш, Андреас; Коль, Мартина; Вессель, Лукас М; Циммер, Клаус-Петер (2012). «Хроническая кишечная недостаточность у детей». Deutsches Ärzteblatt International . 109 ( 22–23 ): 409–15 . doi :10.3238/arztebl.2012.0409. ПМЦ 3389745 . ПМИД 22778793.
- ^ Ровера, Джузеппе М.; ДиМартини, Андреа2; Шен, Роберт Э.; Ракела, Хорхе; Абу-Элмагд, Карим; Грэм, Тоби О. (1998). «Качество жизни пациентов после трансплантации кишечника». Трансплантация . 66 (9): 1141– 5. doi : 10.1097/00007890-199811150-00005 . PMID 9825808.
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка )
Внешние ссылки
- Трансплантация жизни
- Партнерство с вашей командой по трансплантации Архивировано 3 июня 2015 г. в Wayback Machine компанией UNOS
- Трансплантация кишечника в eMedicine
- Трансплантация кишечника при болезни Крона, WebMD