Микробиота кишечника
.jpg/440px-E._coli_Bacteria_(7316101966).jpg)
Микробиота кишечника , микробиом кишечника или флора кишечника — это микроорганизмы , включая бактерии , археи , грибы и вирусы , которые живут в пищеварительном тракте животных . [1] [2] Метагеном желудочно-кишечного тракта представляет собой совокупность всех геномов микробиоты кишечника . [ 3] [4] Кишечник является основным местом обитания микробиома человека . [5] Микробиота кишечника оказывает широкое влияние, включая влияние на колонизацию , устойчивость к патогенам , поддержание эпителия кишечника , метаболизм пищевых и фармацевтических соединений, контроль иммунной функции и даже поведение через ось кишечник-мозг . [4]
Микробный состав микробиоты кишечника различается в зависимости от области пищеварительного тракта. Толстая кишка содержит самую высокую микробную плотность из всех изученных до сих пор сообществ микробов, связанных с человеком, представляя от 300 до 1000 различных видов . [6] Бактерии являются крупнейшим и на сегодняшний день наиболее изученным компонентом, и 99% бактерий кишечника происходят из примерно 30 или 40 видов. [7] Около 55% сухой массы фекалий составляют бактерии. [8] Более 99% бактерий в кишечнике являются анаэробами , но в слепой кишке аэробные бактерии достигают высокой плотности. [5] Подсчитано, что микробиота кишечника человека имеет примерно в сто раз больше генов , чем в геноме человека .
Обзор

У людей микробиота кишечника имеет наибольшее количество и виды бактерий по сравнению с другими частями тела. [9] Приблизительное количество бактерий, составляющих микробиоту кишечника, составляет около 10 13 –10 14 (от 10 000 до 100 000 миллиардов). [10] У людей флора кишечника формируется при рождении и постепенно переходит в состояние, напоминающее таковое у взрослых, к двум годам, [11] совпадающее с развитием и созреванием кишечного эпителия и кишечного слизистого барьера . Этот барьер необходим для поддержания симбиотических отношений с флорой кишечника, обеспечивая при этом защиту от патогенных организмов. [12] [13]
Отношения между некоторыми видами кишечной микробиоты и людьми не просто комменсальные (безвредное сосуществование), а скорее мутуалистические отношения. [5] : 700 Некоторые микроорганизмы кишечника человека приносят пользу хозяину, ферментируя пищевые волокна в короткоцепочечные жирные кислоты (SCFA), такие как уксусная кислота и масляная кислота , которые затем усваиваются хозяином. [9] [14] Кишечные бактерии также играют роль в синтезе некоторых витаминов группы В и витамина К , а также в метаболизме желчных кислот , стеринов и ксенобиотиков . [5] [14] Системное значение SCFA и других соединений, которые они производят, подобно гормонам , а сама кишечная флора, по-видимому, функционирует как эндокринный орган . [14] Нарушение регуляции кишечной флоры коррелирует с множеством воспалительных и аутоиммунных состояний. [9] [15]
Состав микробиоты кишечника человека меняется со временем, при изменении рациона питания и общего состояния здоровья. [9] [15] Систематический обзор 2016 года изучил доклинические и небольшие испытания на людях, которые были проведены с определенными коммерчески доступными штаммами пробиотических бактерий, и выявил те, которые имели наибольший потенциал быть полезными при определенных расстройствах центральной нервной системы . [16] Следует также подчеркнуть, что средиземноморская диета, богатая овощами и клетчаткой, стимулирует активность и рост полезных для мозга бактерий. [17]
Классификации
Микробный состав микробиоты кишечника варьируется в зависимости от пищеварительного тракта. В желудке и тонком кишечнике обычно присутствует относительно небольшое количество видов бактерий. [6] [18] Грибы , простейшие , археи и вирусы также присутствуют в кишечной флоре, но об их активности известно меньше. [19]
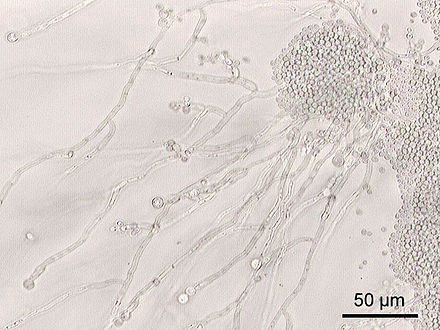
Многие виды в кишечнике не были изучены вне их хозяев, поскольку их невозможно культивировать . [18] [7] [20] Хотя существует небольшое количество основных видов микроорганизмов, общих для большинства людей, популяции микробов могут сильно различаться. [21] Внутри человека их популяции микроорганизмов остаются довольно постоянными с течением времени, некоторые изменения происходят из-за изменений в образе жизни, диете и возрасте. [6] [22] Проект «Микробиом человека» был направлен на более точное описание микробиоты кишечника человека и других частей тела. [ необходима ссылка ]
Четыре доминирующих типа бактерий в кишечнике человека — это Bacillota (Firmicutes), Bacteroidota , Actinomycetota и Pseudomonadota . [23] Большинство бактерий относятся к родам Bacteroides , Clostridium , Faecalibacterium , [6] [7] Eubacterium , Ruminococcus , Peptococcus , Peptostreptococcus и Bifidobacterium . [6] [7] Другие роды, такие как Escherichia и Lactobacillus , присутствуют в меньшей степени. [6] Виды только из рода Bacteroides составляют около 30% всех бактерий в кишечнике, что позволяет предположить, что этот род особенно важен для функционирования хозяина. [18]
Роды грибов, которые были обнаружены в кишечнике, включают Candida , Saccharomyces , Aspergillus , Penicillium , Rhodotorula , Trametes , Pleospora , Sclerotinia , Bullera и Galactomyces , среди прочих. [24] [25] Rhodotorula чаще всего встречается у людей с воспалительным заболеванием кишечника , тогда как Candida чаще всего встречается у людей с циррозом гепатита B и хроническим гепатитом B. [24]
Археи составляют еще один большой класс кишечной флоры, играющий важную роль в метаболизме бактериальных продуктов брожения.
Индустриализация связана с изменениями в микробиоте, а сокращение разнообразия может привести к вымиранию некоторых видов; в 2018 году исследователи предложили создать биобанк, хранящий микробиоту человека. [26]
Энтеротип
Энтеротип — это классификация живых организмов, основанная на их бактериологической экосистеме в микробиоме кишечника человека, не зависящая от возраста, пола, массы тела или национальных различий. [27] Имеются данные о том, что долгосрочная диета влияет на энтеротип. [28] Было предложено три человеческих энтеротипа, [27] [29], но их ценность была поставлена под сомнение. [30]
Состав
Бактериом
Желудок
Из-за высокой кислотности желудка большинство микроорганизмов не могут там выжить. Основные бактерии желудочной микробиоты принадлежат к пяти основным типам: Firmicutes , Bacteroidetes , Actinobacteria , Fusobacteriota и Proteobacteria . Доминирующими родами являются Prevotella , Streptococcus , Veillonella , Rothia и Haemophilus . [31] Взаимодействие между уже существующей желудочной микробиотой и введением H. pylori может влиять на прогрессирование заболевания . [31] При наличии H. pylori она становится доминантой микробиоты. [32]
Кишечник
| Бактерии, обычно встречающиеся в толстой кишке человека [33] | |
| Бактерия | Заболеваемость (%) |
|---|---|
| Бактероиды ломкие | 100 |
| Бактероиды меланиногеникус | 100 |
| Бактероиды оральные | 100 |
| Энтерококк фекальный | 100 |
| Escherichia coli | 100 |
| Энтеробактер сп. | 40–80 |
| Клебсиелла зр. | 40–80 |
| Бифидобактерии бифидум | 30–70 |
| Золотистый стафилококк | 30–50 |
| Лактобациллы | 20–60 |
| Клостридиум перфрингенс | 25–35 |
| Протей чудесный | 5–55 |
| Clostridium tetani | 1–35 |
| Клостридиум септикум | 5–25 |
| Синегнойная палочка | 3–11 |
| Сальмонелла энтерика | 3–7 |
| Faecalibacterium prausnitzii | ?общий |
| Пептострептококки (Peptostreptococcus sp.) | ?общий |
| Вид пептококка . | ?общий |
Тонкий кишечник содержит следовое количество микроорганизмов из-за близости и влияния желудка. Грамположительные кокки и палочковидные бактерии являются преобладающими микроорганизмами, обнаруженными в тонком кишечнике. [5] Однако в дистальной части тонкого кишечника щелочные условия поддерживают грамотрицательные бактерии Enterobacteriaceae . [ 5] Бактериальная флора тонкого кишечника помогает в широком спектре кишечных функций. Бактериальная флора обеспечивает регуляторные сигналы, которые обеспечивают развитие и полезность кишечника. Избыточный рост бактерий в тонком кишечнике может привести к кишечной недостаточности. [34] Кроме того, толстый кишечник содержит самую большую бактериальную экосистему в организме человека. [5] Около 99% флоры толстого кишечника и фекалий состоят из облигатных анаэробов, таких как Bacteroides и Bifidobacterium. [35] Факторы, которые нарушают популяцию микроорганизмов толстого кишечника, включают антибиотики, стресс и паразитов. [5]
Бактерии составляют большую часть флоры толстой кишки [ 36] и отвечают за 60% фекального азота. [6] Этот факт делает фекалии идеальным источником кишечной флоры для любых тестов и экспериментов путем извлечения нуклеиновой кислоты из образцов фекалий, а последовательности генов бактериальной 16S рРНК генерируются с помощью бактериальных праймеров. Эта форма тестирования также часто предпочтительнее более инвазивных методов, таких как биопсия.
В кишечной микробиоте доминируют пять типов : Bacteroidota , Bacillota (Firmicutes), Actinomycetota , Pseudomonadota и Verrucomicrobiota , при этом Bacteroidota и Bacillota составляют 90% состава. [37] В кишечнике обитает от 300 [6] до 1000 различных видов , [18] по большинству оценок их около 500. [38] [39] Однако вполне вероятно, что 99% бактерий относятся к 30 или 40 видам, причем Faecalibacterium prausnitzii (тип firmicutes) является наиболее распространенным видом у здоровых взрослых. [7] [40]
Исследования показывают, что отношения между кишечной флорой и людьми не просто комменсальные (безвредное сосуществование), а скорее мутуалистические , симбиотические отношения. [18] Хотя люди могут выживать без кишечной флоры, [38] микроорганизмы выполняют множество полезных функций, таких как ферментация неиспользованных энергетических субстратов, тренировка иммунной системы с помощью конечных продуктов метаболизма, таких как пропионат и ацетат , предотвращение роста вредных видов, регулирование развития кишечника, выработка витаминов для хозяина (таких как биотин и витамин К ) и выработка гормонов, направляющих хозяина на запасание жиров. [5] Обширные изменения и дисбалансы кишечной микробиоты и ее микробиома или набора генов связаны с ожирением. [41] Однако при определенных условиях считается, что некоторые виды способны вызывать заболевания , вызывая инфекцию или увеличивая риск рака у хозяина. [6] [36]
Микобиом
Грибы и простейшие также составляют часть кишечной флоры, но об их деятельности известно меньше. [42]
Из-за распространенности грибков в естественной среде сложно определить, какие роды и виды являются постоянными членами кишечной микобиомы . [43] [44] Ведутся исследования относительно того, является ли Penicillium постоянным или временным членом кишечной флоры, получаемым из пищевых источников, таких как сыр , хотя известно, что несколько видов этого рода выживают при температуре около 37 °C, что примерно соответствует температуре тела . [44] Известно, что Saccharomyces cerevisiae , пивные дрожжи, попадают в кишечник после попадания в организм и могут быть ответственны за состояние синдрома автопивоварни в случаях, когда они переизбыточны, [44] [45] [46] в то время как Candida albicans , вероятно, является постоянным членом и, как полагают, приобретается при рождении посредством вертикальной передачи . [47] [ необходима медицинская ссылка ]
Виром
Человеческий виром в основном состоит из бактериофагов . [48]
Вариация
Возраст
Существуют общие закономерности эволюции состава микробиома в течение жизни. [49] В целом, разнообразие состава микробиоты фекальных образцов значительно выше у взрослых, чем у детей, хотя межличностные различия у детей выше, чем у взрослых. [50] Большая часть созревания микробиоты до конфигурации, подобной взрослой, происходит в течение первых трех лет жизни. [50]
По мере изменения состава микробиома меняется и состав бактериальных белков, вырабатываемых в кишечнике. В микробиомах взрослых обнаружено высокое распространение ферментов, участвующих в ферментации , метаногенезе и метаболизме аргинина , глутамата , аспартата и лизина . Напротив, в микробиомах младенцев доминирующие ферменты участвуют в метаболизме цистеина и путях ферментации. [50]
География
Состав микробиома кишечника зависит от географического происхождения популяций. Изменения в компромиссе Prevotella , представленности гена уреазы и представленности генов, кодирующих глутаматсинтазу/деградацию или другие ферменты, участвующие в деградации аминокислот или биосинтезе витаминов, показывают значительные различия между популяциями из США, Малави или индейского происхождения. [50]
Население США имеет высокую представленность ферментов, кодирующих деградацию глутамина , и ферментов, участвующих в биосинтезе витаминов и липоевой кислоты ; тогда как население Малави и индейцев имеет высокую представленность ферментов, кодирующих глутаматсинтазу, а также у них в микробиомах наблюдается повышенная представленность α-амилазы . Поскольку население США имеет рацион, более богатый жирами, чем население индейцев или малавийцев, которые имеют рацион, богатый кукурузой, рацион, вероятно, является основным фактором, определяющим состав бактерий кишечника. [50]
Дальнейшие исследования показали большую разницу в составе микробиоты между европейскими и сельскими африканскими детьми. Фекальные бактерии детей из Флоренции сравнивались с бактериями детей из небольшой сельской деревни Бульпон в Буркина-Фасо . Рацион типичного ребенка, живущего в этой деревне, в значительной степени лишен жиров и животных белков и богат полисахаридами и растительными белками. Фекальные бактерии европейских детей были представлены Firmicutes и показали заметное снижение биоразнообразия, в то время как фекальные бактерии детей Бульпона были представлены Bacteroidetes . Возросшее биоразнообразие и другой состав микробиома кишечника в африканских популяциях могут способствовать перевариванию обычно неперевариваемых растительных полисахаридов, а также могут привести к снижению частоты неинфекционных заболеваний толстой кишки. [51]
В меньшем масштабе было показано, что совместное использование многочисленных общих экологических воздействий в семье является сильным фактором, определяющим индивидуальный состав микробиома. Этот эффект не имеет генетического влияния и постоянно наблюдается в культурно различных популяциях. [50]
Недоедание
У недоедающих детей микробиота кишечника менее зрелая и менее разнообразная, чем у здоровых детей, а изменения в микробиоме, связанные с дефицитом питательных веществ, могут, в свою очередь, быть патофизиологической причиной недоедания. [52] [53] У недоедающих детей также обычно больше потенциально патогенной кишечной флоры и больше дрожжей во рту и горле. [54] Изменение рациона питания может привести к изменениям в составе и разнообразии микробиоты кишечника. [55]
Раса и этническая принадлежность
Исследователи из American Gut Project и Human Microbiome Project обнаружили, что двенадцать семейств микробов различаются по численности в зависимости от расы или этнической принадлежности человека. Сила этих связей ограничена небольшим размером выборки: American Gut Project собрал данные от 1375 человек, 90% из которых были белыми. [56] Исследование Healthy Life in an Urban Setting (HELIUS) в Амстердаме показало, что у людей голландского происхождения самый высокий уровень разнообразия микробиоты кишечника, в то время как у людей южноазиатского и суринамского происхождения — самый низкий уровень разнообразия. Результаты исследования показали, что у людей одной расы или этнической принадлежности микробиомы более схожи, чем у людей разного расового происхождения. [56]
Социально-экономический статус
По состоянию на 2020 год, по крайней мере, два исследования продемонстрировали связь между социально-экономическим статусом человека (SES) и его микробиотой кишечника. Исследование в Чикаго показало, что у людей в районах с более высоким SES было большее разнообразие микробиоты. У людей из районов с более высоким SES также было больше бактерий Bacteroides . Аналогичным образом, исследование близнецов в Соединенном Королевстве показало, что более высокий SES также был связан с большим разнообразием кишечника. [56]
Использование антибиотиков
По состоянию на 2023 год исследование показывает, что антибиотики, особенно те, которые используются для лечения бактериальных инфекций широкого спектра, оказывают негативное воздействие на микробиоту кишечника. [57] В исследовании также говорится, что многие эксперты по здоровью кишечника обеспокоены тем, что использование антител привело к снижению разнообразия микробиоты кишечника, многие штаммы были утрачены, а если и происходит повторное появление бактерий, то оно является постепенным и долгосрочным. [58]
Приобретение у человеческих младенцев
Формирование кишечной флоры имеет решающее значение для здоровья взрослого человека, а также для функционирования желудочно-кишечного тракта. [59] У людей кишечная флора, похожая на взрослую, формируется в течение одного-двух лет после рождения, поскольку микробиота приобретается путем передачи от родителя к ребенку и передается через пищу, воду и другие источники окружающей среды. [60] [12]

Традиционное представление о желудочно-кишечном тракте нормального плода заключается в том, что он стерилен, хотя в последние несколько лет это представление было оспорено. [ временные рамки? ] [61] Начали появляться многочисленные линии доказательств, которые предполагают, что во внутриутробной среде могут быть бактерии. У людей исследования показали, что микробная колонизация может происходить у плода [62] при этом одно исследование показало, что виды Lactobacillus и Bifidobacterium присутствовали в биопсиях плаценты. [63] Несколько исследований на грызунах продемонстрировали присутствие бактерий в амниотической жидкости и плаценте, а также в меконии детей, рожденных путем стерильного кесарева сечения. [64] [65] В другом исследовании исследователи вводили культуру бактерий перорально беременным мышам и обнаружили бактерии у потомства, вероятно, в результате передачи между пищеварительным трактом и амниотической жидкостью через кровоток. [66] Однако исследователи предупреждают, что источник этих внутриутробных бактерий, живые ли они и их роль пока не изучены. [67] [63]
Во время родов и вскоре после этого бактерии от матери и окружающей среды колонизируют кишечник младенца. [12] Точные источники бактерий не полностью изучены, но могут включать родовые пути, других людей (родителей, братьев и сестер, работников больницы), грудное молоко, пищу и общую среду, с которой взаимодействует младенец. [68] Исследования показали, что микробиом детей, рожденных вагинально, значительно отличается от микробиома детей, рожденных с помощью кесарева сечения , и что дети, рожденные вагинально, получили большую часть своих кишечных бактерий от своей матери, в то время как микробиота детей, рожденных с помощью кесарева сечения, содержала больше бактерий, связанных с больничной средой. [69]
В течение первого года жизни состав кишечной флоры, как правило, прост и сильно меняется со временем, а также не одинаков у разных людей. [12] Первоначальная бактериальная популяция, как правило, представляет собой факультативные анаэробные организмы ; исследователи полагают, что эти первоначальные колонизаторы снижают концентрацию кислорода в кишечнике, что, в свою очередь, позволяет облигатным анаэробным бактериям, таким как Bacteroidota , Actinomycetota и Bacillota , закрепляться и развиваться. [12] У грудных детей преобладают бифидобактерии , возможно, из-за содержания факторов роста бифидобактерий в грудном молоке, а также из-за того, что грудное молоко содержит пребиотические компоненты, обеспечивающие здоровый рост бактерий. [63] [70] Грудное молоко также содержит более высокий уровень иммуноглобулина А (IgA), который помогает с толерантностью и регуляцией иммунной системы ребенка. [71] Напротив, микробиота детей, находящихся на искусственном вскармливании , более разнообразна и содержит большое количество Enterobacteriaceae , энтерококков , бифидобактерий, бактероидов и клостридий. [72]
Кесарево сечение, антибиотики и искусственное вскармливание могут изменить состав микробиома кишечника. [63] Дети, леченные антибиотиками, имеют менее стабильные и менее разнообразные цветочные сообщества. [73] Было показано, что кесарево сечение нарушает передачу бактерий от матери к потомству, что влияет на общее состояние здоровья потомства, повышая риск таких заболеваний, как целиакия , астма и диабет 1 типа . [63] Это еще раз подтверждает важность здорового микробиома кишечника. Изучаются различные методы восстановления микробиома, обычно включающие воздействие на младенца содержимого влагалища матери и пероральных пробиотиков. [63]
Функции
Когда в 1995 году началось изучение кишечной флоры, [74] считалось, что она играет три ключевые роли: прямая защита от патогенов , укрепление защиты хозяина за счет своей роли в развитии и поддержании кишечного эпителия и индукции выработки антител там, а также метаболизм в противном случае неперевариваемых соединений в пище. Последующие исследования обнаружили ее роль в обучении развивающейся иммунной системы, и еще одна работа была сосредоточена на ее роли в оси кишечник-мозг . [75]
Прямое ингибирование патогенов
Сообщество кишечной флоры играет прямую роль в защите от патогенов, полностью колонизируя пространство, используя все доступные питательные вещества и секретируя соединения, известные как цитокины, которые убивают или подавляют нежелательные организмы, которые будут конкурировать с ним за питательные вещества. [76] Различные штаммы кишечных бактерий вызывают выработку различных цитокинов. Цитокины — это химические соединения, вырабатываемые нашей иммунной системой для инициирования воспалительного ответа на инфекции. Нарушение кишечной флоры позволяет конкурирующим организмам, таким как Clostridioides difficile, закрепляться, которые в противном случае остаются в состоянии бездействия. [76]
Развитие энтеральной защиты и иммунной системы
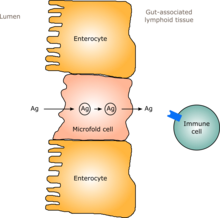
У людей кишечная флора, похожая на взрослую, формируется в течение одного-двух лет после рождения. [12] По мере того, как кишечная флора формируется, слизистая оболочка кишечника — кишечный эпителий и секретируемый им слизистый барьер кишечника — также развиваются таким образом, что становятся толерантными и даже поддерживающими комменсалистические микроорганизмы в определенной степени, а также обеспечивают барьер для патогенных микроорганизмов. [12] В частности, бокаловидные клетки , которые производят слизистую оболочку, размножаются, и слизистый слой утолщается, обеспечивая внешний слизистый слой, в котором могут закрепляться и питаться «дружественные» микроорганизмы, и внутренний слой, в который даже эти организмы не могут проникнуть. [12] [13] Кроме того, развитие лимфоидной ткани, ассоциированной с кишечником (GALT), которая является частью кишечного эпителия и которая обнаруживает и реагирует на патогены, появляется и развивается в то время, когда развивается и закрепляется кишечная флора. [12] Развивающаяся GALT толерантна к видам кишечной флоры, но не к другим микроорганизмам. [12] GALT также обычно становится толерантной к пище, которой подвергается младенец, а также к продуктам переваривания пищи и метаболитам кишечной флоры (молекулам, образующимся в результате метаболизма), вырабатываемым из пищи. [12]
Иммунная система человека вырабатывает цитокины , которые могут заставить иммунную систему вызывать воспаление, чтобы защитить себя, и которые могут подавлять иммунный ответ для поддержания гомеостаза и обеспечения заживления после инсульта или травмы. [12] Было показано, что различные виды бактерий, которые появляются в кишечной флоре, способны заставлять иммунную систему избирательно вырабатывать цитокины; например, Bacteroides fragilis и некоторые виды Clostridia, по-видимому, вызывают противовоспалительную реакцию, в то время как некоторые сегментированные нитчатые бактерии стимулируют выработку воспалительных цитокинов. [12] [77] Кишечная флора также может регулировать выработку антител иммунной системой. [12] [78] Одна из функций этой регуляции заключается в том, чтобы заставить В-клетки переключиться на IgA . В большинстве случаев В-клетки нуждаются в активации от Т-хелперных клеток , чтобы вызвать переключение класса ; однако в другом пути кишечная флора вызывает сигнализацию NF-kB кишечными эпителиальными клетками, что приводит к секреции дополнительных сигнальных молекул. [79] Эти сигнальные молекулы взаимодействуют с В-клетками, чтобы вызвать переключение класса на IgA. [79] IgA является важным типом антител, который используется в слизистых оболочках, таких как кишечник. Было показано, что IgA может помочь разнообразить сообщество кишечника и помогает избавиться от бактерий, вызывающих воспалительные реакции. [80] В конечном счете, IgA поддерживает здоровую среду между хозяином и кишечными бактериями. [80] Эти цитокины и антитела могут оказывать действие за пределами кишечника, в легких и других тканях. [12]
Иммунная система также может быть изменена из-за способности кишечных бактерий производить метаболиты , которые могут влиять на клетки иммунной системы. Например, короткоцепочечные жирные кислоты (SCFA) могут вырабатываться некоторыми кишечными бактериями посредством ферментации . [81] SCFA стимулируют быстрое увеличение производства врожденных иммунных клеток, таких как нейтрофилы , базофилы и эозинофилы . [81] Эти клетки являются частью врожденной иммунной системы, которая пытается ограничить распространение инфекции.
Метаболизм
Метаболизм триптофана микробиотой кишечника человека () Бактерии , экспрессирующие триптофаназу Кишечные иммунные клетки Гомеостаз слизистой оболочки: ↓ TNF-α ↑ мРНК , кодирующие соединительный белок Нейропротектор : ↓ Активация глиальных клеток и астроцитов ↓ Уровень 4-гидрокси-2-ноненаля ↓ Повреждение ДНК – Антиоксидант – Ингибирует образование β-амилоидных фибрилл Поддерживает реактивность слизистой оболочки: ↑ выработка ИЛ-22 Связано с сосудистыми заболеваниями : ↑ Окислительный стресс ↑ Пролиферация гладкомышечных клеток ↑ Толщина стенки аорты и кальцификация Связано с хроническим заболеванием почек : ↑ Почечная дисфункция – Уремический токсин На этой диаграмме показан биосинтез биологически активных соединений ( индола и некоторых других производных) из триптофана бактериями в кишечнике. [82] Индол вырабатывается из триптофана бактериями, которые экспрессируют триптофаназу . [82] Clostridium sporogenes метаболизирует триптофан в индол и впоследствии в 3-индолпропионовую кислоту (IPA), [83] высокоэффективный нейропротекторный антиоксидант , который удаляет гидроксильные радикалы . [82] [84] [85] IPA связывается с прегнановым X-рецептором (PXR) в клетках кишечника, тем самым способствуя гомеостазу слизистой оболочки и барьерной функции . [82] После абсорбции из кишечника и распределения в мозг IPA оказывает нейропротекторное действие против церебральной ишемии и болезни Альцгеймера . [82] Виды Lactobacillaceae ( Lactobacillus s.l. ) метаболизируют триптофан в индол-3-альдегид (I3A), который действует на арильный углеводородный рецептор (AhR) в кишечных иммунных клетках, в свою очередь, увеличивая выработку интерлейкина-22 (IL-22). [82] Сам индол запускает секрецию глюкагоноподобного пептида-1 (GLP-1) в кишечных L-клетках и действует как лиганд для AhR. [82] Индол также может метаболизироваться печенью в индоксилсульфат , соединение, которое является токсичным в высоких концентрациях и связано с сосудистыми заболеваниями и почечной дисфункцией . [82] AST-120 ( активированный уголь ), кишечный сорбент , который принимается внутрь , адсорбирует индол, в свою очередь, снижая концентрацию индоксилсульфата в плазме крови. [82] |
Без кишечной флоры организм человека не смог бы использовать некоторые непереваренные углеводы, которые он потребляет, потому что некоторые типы кишечной флоры имеют ферменты , которых не хватает человеческим клеткам для расщепления определенных полисахаридов . [14] Грызуны, выращенные в стерильной среде и лишенные кишечной флоры, должны потреблять на 30% больше калорий , чтобы оставаться того же веса, что и их нормальные сородичи. [14] Углеводы, которые человек не может переварить без помощи бактерий, включают определенные крахмалы , клетчатку , олигосахариды и сахара , которые организм не смог переварить и усвоить, такие как лактоза в случае непереносимости лактозы и сахарные спирты , слизь , вырабатываемая кишечником, и белки. [9] [14]
Бактерии превращают углеводы, которые они ферментируют, в короткоцепочечные жирные кислоты с помощью формы ферментации, называемой сахаролитической ферментацией. [39] Продукты включают уксусную кислоту , пропионовую кислоту и масляную кислоту . [7] [39] Эти материалы могут использоваться клетками-хозяевами, обеспечивая основной источник энергии и питательных веществ. [39] Газы (которые участвуют в передаче сигналов [86] и могут вызывать метеоризм ) и органические кислоты , такие как молочная кислота , также производятся путем ферментации. [7] Уксусная кислота используется мышцами , пропионовая кислота способствует выработке АТФ печенью , а масляная кислота обеспечивает энергией клетки кишечника. [39]
Кишечная флора также синтезирует витамины, такие как биотин и фолат , и способствует усвоению пищевых минералов , включая магний, кальций и железо. [6] [22] Methanobrevibacter smithii уникален, поскольку он не является видом бактерий, а скорее членом домена Archaea и является наиболее распространенным видом архей, продуцирующих метан, в микробиоте желудочно-кишечного тракта человека. [87]
Микробиота кишечника также служит источником витаминов K и B 12 , которые не вырабатываются организмом или вырабатываются в небольших количествах. [88] [89]
Деградация целлюлозы
Бактерии, которые разлагают целлюлозу (например, Ruminococcus ), распространены среди человекообразных обезьян , древних человеческих обществ, сообществ охотников-собирателей и даже современных сельских популяций. Однако они редки в индустриальных обществах. Штаммы, связанные с человеком, приобрели гены, которые могут разлагать определенные растительные волокна, такие как кукуруза , рис и пшеница . Бактериальные штаммы, обнаруженные у приматов, также могут разлагать хитин , полимер, в изобилии встречающийся в насекомых, которые являются частью рациона многих нечеловеческих приматов . Сокращение этих бактерий в кишечнике человека, вероятно, было обусловлено переходом на западный образ жизни. [90]
Фармакомикробиомика
Человеческий метагеном (т. е. генетический состав человека и всех микроорганизмов, которые находятся на теле человека или внутри него) значительно различается у разных людей. [91] [92] Поскольку общее количество микробных клеток в организме человека (более 100 триллионов) значительно превосходит количество клеток Homo sapiens (десятки триллионов), [примечание 1] [91] [93] существует значительный потенциал для взаимодействия между лекарственными средствами и микробиомом человека, включая: лекарственные средства, изменяющие состав микробиома человека , метаболизм лекарственных средств микробными ферментами, изменяющими фармакокинетический профиль лекарственного средства , и микробный метаболизм лекарственных средств, влияющий на клиническую эффективность и профиль токсичности лекарственного средства . [91] [92] [94]
Помимо углеводов, кишечная микробиота может также метаболизировать другие ксенобиотики , такие как лекарства, фитохимические вещества и пищевые токсиканты. Было показано, что более 30 лекарств метаболизируются кишечной микробиотой. [95] Микробный метаболизм лекарств иногда может инактивировать лекарство. [96]
Вклад в метаболизм лекарственных средств
Микробиота кишечника представляет собой обогащенное сообщество, содержащее разнообразные гены с огромными биохимическими возможностями для модификации лекарств, особенно тех, которые принимаются внутрь. [97] Микробиота кишечника может влиять на метаболизм лекарств через прямые и косвенные механизмы. [98] Прямой механизм опосредован микробными ферментами, которые могут изменять химическую структуру вводимых лекарств. [99] Наоборот, косвенный путь опосредован микробными метаболитами, которые влияют на экспрессию ферментов метаболизма хозяина, таких как цитохром P450 . [100] [98] Влияние микробиоты кишечника на фармакокинетику и биодоступность лекарств было исследовано несколько десятилетий назад. [101] [102] [103] Эти эффекты могут быть различными; они могут активировать неактивные лекарства, такие как ловастатин, [104] инактивировать активное лекарство, такое как дигоксин [105] или вызывать токсичность лекарств, как в случае с иринотеканом . [106] С тех пор активно изучалось влияние микробиоты кишечника на фармакокинетику многих лекарственных препаратов. [107] [97]
Микробиота кишечника человека играет решающую роль в модулировании эффекта вводимых лекарств на человека. Непосредственно микробиота кишечника может синтезировать и высвобождать ряд ферментов, способных метаболизировать лекарства, такие как микробная биотрансформация L-допы ферментами декарбоксилазы и дегидроксилазы. [99] Напротив, микробиота кишечника может также изменять метаболизм лекарств, модулируя метаболизм лекарств хозяина. Этот механизм может быть опосредован микробными метаболитами или путем модификации метаболитов хозяина, которые, в свою очередь, изменяют экспрессию ферментов, метаболизирующих хозяина. [100]
Большое количество исследований продемонстрировало метаболизм более 50 препаратов микробиотой кишечника. [107] [98] Например, ловастатин (средство для снижения уровня холестерина), который является пролекарством лактона, частично активируется микробиотой кишечника человека, образуя активные гидроксилированные кислотные метаболиты. [104] Напротив, дигоксин (препарат, используемый для лечения застойной сердечной недостаточности) инактивируется членом микробиоты кишечника (то есть Eggerthella lanta ). [108] Eggerthella lanta имеет оперон, кодирующий цитохром, который активируется дигоксином и связан с инактивацией дигоксина. [108] Микробиота кишечника также может модулировать эффективность и токсичность химиотерапевтических агентов, таких как иринотекан. [109] Этот эффект обусловлен ферментами β-глюкуронидазы, кодируемыми микробиомом, которые восстанавливают активную форму иринотекана, вызывая желудочно-кишечную токсичность. [110]
Вторичные метаболиты
Это микробное сообщество в кишечнике обладает огромной биохимической способностью производить различные вторичные метаболиты, которые иногда производятся в результате метаболического преобразования диетических продуктов, таких как волокна , эндогенные биологические соединения, такие как индол или желчные кислоты . [111] [112] [113] Микробные метаболиты, особенно короткоцепочечные жирные кислоты (КЦЖК) и вторичные желчные кислоты (ВЖК), играют важную роль для человека в состоянии здоровья и при заболеваниях. [114] [115] [116]
Одним из важнейших бактериальных метаболитов, продуцируемых микробиотой кишечника, являются вторичные желчные кислоты (BAs). [113] Эти метаболиты продуцируются путем бактериальной биотрансформации первичных желчных кислот, таких как холевая кислота (CA) и хенодезоксихолевая кислота (CDCA), во вторичные желчные кислоты (BAs), литохолевую кислоту (LCA) и дезоксихолевую кислоту (DCA) соответственно. [117] Первичные желчные кислоты, которые синтезируются гепатоцитами и хранятся в желчном пузыре, обладают гидрофобными свойствами. Эти метаболиты впоследствии метаболизируются микробиотой кишечника во вторичные метаболиты с повышенной гидрофобностью. [117] Гидролазы желчных солей (BSH), которые сохраняются во всех типах микробиоты кишечника, таких как Bacteroides , Firmicutes и Actinobacteria , отвечают за первый этап метаболизма вторичных желчных кислот. [117] Было показано, что вторичные желчные кислоты (BAs), такие как DCA и LCA, подавляют как прорастание, так и рост Clostridioides difficile . [116]
Дисбактериоз
Микробиота кишечника важна для поддержания гомеостаза в кишечнике. Развитие рака кишечника связано с дисбалансом естественной микрофлоры (дисбактериозом). [118] Вторичная желчная кислота — дезоксихолевая кислота — связана с изменениями микробного сообщества, которые приводят к усилению канцерогенеза в кишечнике. [118] Повышенное воздействие вторичных желчных кислот на толстую кишку в результате дисбактериоза может вызвать повреждение ДНК , а такое повреждение может привести к канцерогенным мутациям в клетках толстой кишки. [119] Высокая плотность бактерий в толстой кишке (около 10 12 на мл), которые подвержены дисбактериозу, по сравнению с относительно низкой плотностью в тонкой кишке (около 10 2 на мл), может объяснить более чем 10-кратную более высокую заболеваемость раком в толстой кишке по сравнению с тонкой кишкой. [119]
Ось кишечник-мозг
Микробиота кишечника способствует пищеварению и иммунной модуляции, поскольку она играет роль в оси кишечник-мозг, где микробные метаболиты, такие как короткоцепочечные жирные кислоты и нейротрансмиттеры, влияют на функцию и поведение мозга. Ось кишечник-мозг представляет собой биохимическую сигнализацию, которая происходит между желудочно-кишечным трактом и центральной нервной системой . [75] Этот термин был расширен, чтобы включить роль кишечной флоры во взаимодействии; термин «ось микробиом–мозг» иногда используется для описания парадигм, явно включающих кишечную флору. [75] [120] [121] В широком смысле ось кишечник-мозг включает центральную нервную систему, нейроэндокринную и нейроиммунную системы, включая гипоталамо-гипофизарно-надпочечниковую ось (ось HPA), симпатическую и парасимпатическую ветви автономной нервной системы , включая энтеральную нервную систему , блуждающий нерв и микробиоту кишечника . [75] [121] Исследования показывают связь между дисбактериозом кишечника и психическими заболеваниями, указывая на сложное взаимодействие, которое влияет на настроение и когнитивные функции.
Систематический обзор 2016 года изучил доклинические и небольшие испытания на людях, которые были проведены с некоторыми коммерчески доступными штаммами пробиотических бактерий, и обнаружил, что среди протестированных роды Bifidobacterium и Lactobacillus ( B. longum , B. breve , B. infantis , L. helveticus , L. rhamnosus , L. plantarum и L. casei ) имели наибольший потенциал для использования при некоторых расстройствах центральной нервной системы . [16]
Изменения баланса микробиоты
Эффекты применения антибиотиков
Изменение количества кишечных бактерий, например, путем приема антибиотиков широкого спектра действия , может повлиять на здоровье хозяина и его способность переваривать пищу. [122] Антибиотики могут вызывать диарею, связанную с антибиотиками, путем непосредственного раздражения кишечника , изменения уровня микробиоты или позволяя патогенным бактериям расти. [7] Другим вредным эффектом антибиотиков является увеличение количества устойчивых к антибиотикам бактерий, обнаруживаемых после их использования, которые, попадая в организм хозяина, вызывают заболевания, которые трудно поддаются лечению антибиотиками. [122]
Изменение количества и видов кишечной микробиоты может снизить способность организма ферментировать углеводы и метаболизировать желчные кислоты, а также может вызвать диарею . Углеводы, которые не расщепляются, могут поглощать слишком много воды и вызывать жидкий стул, или недостаток короткоцепочечных жирных кислот, вырабатываемых кишечной микробиотой, может вызвать диарею. [7]
Снижение уровня местных видов бактерий также нарушает их способность подавлять рост вредных видов, таких как C. difficile и Salmonella Kedougou, и эти виды могут выйти из-под контроля, хотя их чрезмерный рост может быть случайным и не быть истинной причиной диареи. [6] [7] [122] Новые протоколы лечения инфекций C. difficile включают трансплантацию фекальной микробиоты донорских фекалий (см. Трансплантация фекалий ). [123] Первоначальные отчеты о лечении описывают показатели успешности в 90% с небольшим количеством побочных эффектов. Предполагается, что эффективность является результатом восстановления бактериального баланса классов бактерий Bacteroides и Firmicutes. [124]
Состав микробиома кишечника также меняется при тяжелых заболеваниях, не только из-за использования антибиотиков, но и из-за таких факторов, как ишемия кишечника, отказ от еды и иммунодефицит . Отрицательные эффекты этого привели к интересу к селективной деконтаминации пищеварительного тракта, лечению, направленному на уничтожение только патогенных бактерий и позволяющему восстановить здоровые. [125]
Антибиотики изменяют популяцию микробиоты в желудочно-кишечном тракте , и это может изменить внутрисообщественные метаболические взаимодействия, изменить потребление калорий за счет использования углеводов и в целом повлиять на метаболический, гормональный и иммунный гомеостаз хозяина. [126]
Имеются обоснованные доказательства того, что прием пробиотиков, содержащих виды Lactobacillus, может помочь предотвратить диарею, связанную с приемом антибиотиков, а прием пробиотиков с Saccharomyces (например, Saccharomyces boulardii ) может помочь предотвратить инфекцию Clostridioides difficile после системного лечения антибиотиками. [127]
Беременность
Микробиота кишечника женщины меняется по мере развития беременности , причем изменения аналогичны тем, что наблюдаются при метаболических синдромах, таких как диабет. Изменение микробиоты кишечника не вызывает никаких побочных эффектов. Микробиота кишечника новорожденного напоминает образцы микробиоты матери в первом триместре. Разнообразие микробиома уменьшается от первого к третьему триместру, так как количество определенных видов увеличивается. [63] [128]
Пробиотики, пребиотики, синбиотики и фармабиотики
Пробиотики содержат живые микроорганизмы . Считается, что при употреблении они приносят пользу здоровью, изменяя состав микробиома. [129] [130] [131] Текущие исследования изучают использование пробиотиков как способ восстановления микробного баланса кишечника путем стимуляции иммунной системы и ингибирования провоспалительных цитокинов . [129]
Что касается микробиоты кишечника, пребиотики, как правило, представляют собой неперевариваемые волокнистые соединения, которые проходят непереваренными через верхнюю часть желудочно-кишечного тракта и стимулируют рост или активность полезной кишечной флоры, выступая для них в качестве субстрата . [39] [132]
Синбиотики относятся к пищевым ингредиентам или диетическим добавкам, объединяющим пробиотики и пребиотики в форме синергизма . [133]
Термин «фармабиотики» используется в различных значениях, для обозначения: фармацевтических формул (стандартизированное производство, которое может получить одобрение регулирующих органов в качестве лекарственного средства) пробиотиков, пребиотиков или синбиотиков ; [134] пробиотиков, которые были генетически модифицированы или иным образом оптимизированы для лучшей эффективности (срок хранения, выживаемость в пищеварительном тракте и т. д.); [135] и натуральных продуктов метаболизма кишечной флоры (витамины и т. д.). [136]
Есть некоторые доказательства того, что лечение некоторыми пробиотическими штаммами бактерий может быть эффективным при синдроме раздраженного кишечника , [137] [138] вздутии живота [139] и хроническом идиопатическом запоре . К числу организмов, которые с наибольшей вероятностью приведут к уменьшению симптомов, относятся:
- Бифидобактерии бреве
- Бифидобактерии инфантис
- Энтерококк фаэциум
- Lactobacillus плантарум
- Lactobacillus reuteri
- Лактобацилла рамнозус
- Lactobacillus salivarius
- Пропионибактерия freudenreichii
- Сахаромицеты Буларди
- Escherichia coli Ниссле 1917
- Термофильный стрептококк [140] [141] [142]
Фекальная флотация
Фекалии примерно 10–15% людей постоянно плавают в туалетной воде («плавающие»), в то время как остальные производят фекалии, которые тонут («тонущие»), и выработка газа заставляет фекалии плавать. [143] В то время как обычные мыши часто производят «плавающие», гнотобиотические стерильные мыши без микробиоты кишечника (выращенные в стерильном изоляторе) производят «тонущих», а колонизация микробиоты кишечника у стерильных мышей приводит к преобразованию пищи в микробную биомассу и обогащению множественными газообразующими видами бактерий, что превращает «тонущих» в «плавающих». [144]
Исследовать
Тесты на то, могут ли неантибиотические препараты влиять на кишечные бактерии человека, проводились с помощью анализа in vitro более 1000 продаваемых препаратов против 40 штаммов кишечных бактерий, показывая, что 24% препаратов подавляли рост по крайней мере одного из штаммов бактерий. [145]
Роль в заболевании
Бактерии в пищеварительном тракте могут способствовать возникновению и поражаться болезнями различными способами. Наличие или избыток некоторых видов бактерий может способствовать возникновению воспалительных заболеваний, таких как воспалительное заболевание кишечника . [6] Кроме того, метаболиты некоторых представителей кишечной флоры могут влиять на сигнальные пути хозяина, способствуя возникновению таких заболеваний, как ожирение и рак толстой кишки . [6] Некоторые кишечные бактерии также могут вызывать инфекции и сепсис , например, когда им позволяют проникать из кишечника в остальную часть тела . [6]
Язвы
Инфекция Helicobacter pylori может инициировать образование язв желудка, когда бактерии проникают в эпителиальную оболочку желудка, вызывая затем воспалительную фагоцитарную реакцию . [146] В свою очередь, воспаление повреждает париетальные клетки, которые выделяют избыточное количество соляной кислоты в желудок и производят меньше защитной слизи. [147] Повреждение слизистой оболочки желудка, приводящее к язвам , развивается, когда желудочная кислота подавляет защитные свойства клеток и подавляет синтез эндогенных простагландинов , снижает секрецию слизи и бикарбоната, снижает кровоток в слизистой оболочке и снижает устойчивость к травмам. [147] Снижение защитных свойств слизистой оболочки желудка увеличивает уязвимость к дальнейшему повреждению и образованию язв желудочной кислотой, пепсином и желчными солями. [146] [147]
Перфорация кишечника
Обычно комменсальные бактерии могут нанести вред хозяину, если они выталкиваются из кишечного тракта. [12] [13] Транслокация, которая происходит, когда бактерии покидают кишечник через его слизистую оболочку, может происходить при ряде различных заболеваний. [13] Если кишечник перфорирован, бактерии проникают в интерстиций , вызывая потенциально смертельную инфекцию . [5] : 715
Воспалительные заболевания кишечника
Два основных типа воспалительных заболеваний кишечника , болезнь Крона и язвенный колит , являются хроническими воспалительными расстройствами кишечника; причины этих заболеваний неизвестны, и проблемы с кишечной флорой и ее взаимоотношениями с хозяином были связаны с этими состояниями. [15] [148] [149] [150] Кроме того, по-видимому, взаимодействие кишечной флоры с осью кишечник-мозг играет роль в ВЗК, при этом физиологический стресс, опосредованный через гипоталамо-гипофизарно-надпочечниковую ось, приводит к изменениям в эпителии кишечника, а кишечная флора, в свою очередь, высвобождает факторы и метаболиты, которые запускают сигнализацию в энтеральной нервной системе и блуждающем нерве . [4]
Разнообразие кишечной флоры, по-видимому, значительно снижено у людей с воспалительными заболеваниями кишечника по сравнению со здоровыми людьми; кроме того, у людей с язвенным колитом, по-видимому, доминируют Proteobacteria и Actinobacteria; у людей с болезнью Крона, по-видимому, преобладают Enterococcus faecium и несколько Proteobacteria. [4]
Имеются обоснованные доказательства того, что коррекция дисбаланса кишечной флоры путем приема пробиотиков с лактобациллами и бифидобактериями может уменьшить висцеральную боль и воспаление кишечника при ВЗК. [127]
Синдром раздраженного кишечника
Синдром раздраженного кишечника является результатом стресса и хронической активации оси HPA; его симптомы включают боль в животе, изменения в дефекации и увеличение провоспалительных цитокинов. В целом, исследования показали, что люминальная и слизистая микробиота изменены у людей с синдромом раздраженного кишечника, и эти изменения могут быть связаны с типом раздражения, таким как диарея или запор . Кроме того, наблюдается снижение разнообразия микробиома с низким уровнем фекальных лактобацилл и бифидобактерий, высоким уровнем факультативных анаэробных бактерий, таких как Escherichia coli , и повышенным соотношением Firmicutes: Bacteroidetes. [121]
Астма
Что касается астмы, то для объяснения ее растущей распространенности в развитых странах были выдвинуты две гипотезы. Гигиеническая гипотеза утверждает, что дети в развитых странах не подвергаются воздействию достаточного количества микробов и, таким образом, могут содержать более низкую распространенность определенных бактериальных таксонов, которые играют защитные роли. [151] Вторая гипотеза фокусируется на западной модели питания , в которой отсутствуют цельные зерна и клетчатка и имеется переизбыток простых сахаров . [15] Обе гипотезы сходятся во мнении о роли короткоцепочечных жирных кислот (SCFA) в иммуномодуляции . Эти метаболиты бактериальной ферментации участвуют в иммунной сигнализации, которая предотвращает возникновение астмы, а более низкие уровни SCFA связаны с заболеванием. [151] [152] Отсутствие защитных родов, таких как Lachnospira , Veillonella , Rothia и Faecalibacterium , было связано со снижением уровней SCFA. [151] Кроме того, SCFA являются продуктом бактериальной ферментации клетчатки, которая низкая в западной модели питания. [15] [152] SCFAs предлагают связь между кишечной флорой и иммунными расстройствами, и по состоянию на 2016 год это было активной областью исследований. [15] Аналогичные гипотезы также были выдвинуты относительно роста пищевой и других аллергий. [153]
Сахарный диабет 1 типа
Связь между микробиотой кишечника и сахарным диабетом 1 типа также была связана с короткоцепочечными жирными кислотами, такими как бутират и ацетат. Диеты, дающие бутират и ацетат в результате бактериальной ферментации, показывают повышенную экспрессию T reg . [154] Клетки T reg подавляют эффекторные Т-клетки , что, в свою очередь, снижает воспалительную реакцию в кишечнике. [155] Бутират является источником энергии для клеток толстой кишки. Таким образом, диеты, дающие бутират, снижают проницаемость кишечника , обеспечивая достаточно энергии для образования плотных соединений . [156] Кроме того, было показано, что бутират снижает резистентность к инсулину, что позволяет предположить, что кишечные сообщества с низким содержанием микробов, продуцирующих бутират, могут повышать вероятность приобретения сахарного диабета 2 типа . [157] Диеты, дающие бутират, также могут иметь потенциальные эффекты подавления колоректального рака . [156]
Ожирение и метаболический синдром
Кишечная флора вовлечена в ожирение и метаболический синдром из-за ключевой роли в процессе пищеварения; диета западного образца, по-видимому, стимулирует и поддерживает изменения во флоре кишечника, которые, в свою очередь, изменяют количество энергии, получаемой из пищи, и то, как эта энергия используется. [150] [158] Одним из аспектов здорового питания , которого часто не хватает в диете западного образца, являются волокна и другие сложные углеводы, которые необходимы для процветания здоровой кишечной флоры; изменения кишечной флоры в ответ на диету западного образца, по-видимому, увеличивают количество энергии, вырабатываемой кишечной флорой, что может способствовать ожирению и метаболическому синдрому. [127] Также есть доказательства того, что микробиота влияет на пищевое поведение, основанное на предпочтениях микробиоты, что может привести к тому, что хозяин будет потреблять больше пищи, что в конечном итоге приведет к ожирению. В целом было замечено, что при более высоком разнообразии микробиома кишечника микробиота будет тратить энергию и ресурсы на конкуренцию с другой микробиотой и меньше на манипулирование хозяином. Противоположность наблюдается при меньшем разнообразии микробиома кишечника, и эти микробиоты могут работать вместе, создавая пищевые пристрастия хозяина. [55]
Кроме того, печень играет доминирующую роль в гомеостазе глюкозы в крови , поддерживая баланс между поглощением и хранением глюкозы через метаболические пути гликогенеза и глюконеогенеза . Липиды кишечника регулируют гомеостаз глюкозы, включающий ось кишечник–мозг–печень. Прямое введение липидов в верхний отдел кишечника увеличивает уровни длинноцепочечного жирного ацил-кофермента А (LCFA-CoA) в верхнем отделе кишечника и подавляет выработку глюкозы даже при поддиафрагмальной ваготомии или деафферентации блуждающего нерва кишечника . Это прерывает нейронную связь между мозгом и кишечником и блокирует способность липидов верхнего отдела кишечника ингибировать выработку глюкозы. Ось кишечник–мозг–печень и состав микробиоты кишечника могут регулировать гомеостаз глюкозы в печени и обеспечивать потенциальные терапевтические методы лечения ожирения и диабета. [159]
Так же, как кишечная флора может функционировать в цикле обратной связи, который может способствовать развитию ожирения, есть данные, что ограничение потребления калорий (т. е. диета ) может приводить к изменениям в составе кишечной флоры. [150]
Другие животные
Состав микробиома кишечника человека похож на состав микробиома других человекообразных обезьян. Однако, с момента нашего эволюционного отделения от Pan, разнообразие и состав кишечной биоты человека уменьшились . [160] У людей наблюдается увеличение Bacteroidetes, бактериального типа, связанного с рационом с высоким содержанием животного белка и жира, и уменьшение Methanobrevibacter и Fibrobacter, групп, которые ферментируют сложные растительные полисахариды. [160] Эти изменения являются результатом комбинированных диетических, генетических и культурных изменений, которые претерпели люди с момента эволюционного расхождения с Pan . [ требуется ссылка ]
Помимо людей и позвоночных, некоторые насекомые также имеют сложную и разнообразную микробиоту кишечника, которая играет ключевую роль в питании. [2] Микробные сообщества, связанные с термитами, могут составлять большую часть веса особей и выполнять важные роли в переваривании лигноцеллюлозы и фиксации азота . [161] Известно, что нарушение микробиоты кишечника термитов с использованием таких агентов, как антибиотики [162] или борная кислота [163] (распространенное средство, используемое при профилактическом лечении), вызывает серьезные нарушения пищеварительной функции и приводит к росту оппортунистических патогенов. [163] Эти сообщества являются специфичными для хозяина, и близкородственные виды насекомых имеют сопоставимые сходства в составе микробиоты кишечника. [164] [165] Было показано, что у тараканов микробиота кишечника собирается детерминированным образом, независимо от инокулята ; [166] причина этой специфичной для хозяина сборки остается неясной. Бактериальные сообщества, связанные с насекомыми, такими как термиты и тараканы, определяются комбинацией факторов, в первую очередь диетой, но есть некоторые указания на то, что филогения хозяина также может играть роль в выборе линий. [164] [165]
Уже более 51 года известно, что введение низких доз антибактериальных препаратов способствует росту сельскохозяйственных животных и увеличению набора веса. [126]
В исследовании, проведенном на мышах, соотношение Firmicutes и Lachnospiraceae было значительно повышено у животных, получавших субтерапевтические дозы различных антибиотиков. Анализируя калорийность фекалий и концентрацию короткоцепочечных жирных кислот (SCFA) в желудочно-кишечном тракте, был сделан вывод, что изменения в составе микробиоты приводят к повышению способности извлекать калории из неперевариваемых компонентов и к повышению продукции SCFA. Эти результаты свидетельствуют о том, что антибиотики нарушают не только состав микробиома ЖК, но и его метаболические возможности, особенно в отношении SCFA. [126]
Смотрите также
- Сопротивление колонизации
- Список человеческой флоры
- Список видов микробиоты нижних отделов репродуктивного тракта женщин
- Кожная флора
- Escherichia coli , продуцирующая веротоксин
Примечания
- ^ Существуют значительные различия в составе микробиома и концентрации микробов в зависимости от анатомического участка. [91] [92] Жидкость из толстой кишки человека, которая содержит самую высокую концентрацию микробов среди всех анатомических участков, содержит приблизительно один триллион (10^12) бактериальных клеток/мл. [91]
Ссылки
- ^ Moszak, M; Szulińska, M; Bogdański, P (15 апреля 2020 г.). «Вы — то, что вы едите — взаимосвязь между диетой, микробиотой и метаболическими нарушениями — обзор». Nutrients . 12 (4): 1096. doi : 10.3390/nu12041096 . PMC 7230850 . PMID 32326604.
- ^ ab Engel, P.; Moran, N. (2013). «Микробиота кишечника насекомых – разнообразие структуры и функций». FEMS Microbiology Reviews . 37 (5): 699–735 . doi : 10.1111/1574-6976.12025 . PMID 23692388.
- ^ Segata, N; Boernigen, D; Tickle, TL; Morgan, XC; Garrett, WS; Huttenhower, C (14 мая 2013 г.). "Вычислительная метаомика для исследований микробных сообществ". Molecular Systems Biology . 9 : 666. doi : 10.1038/msb.2013.22 . PMC 4039370. PMID 23670539 .
- ^ abcd Саксена, Р.; Шарма, В.К. (2016). «Метагеномный взгляд на микробиом человека: его влияние на здоровье и болезни». В Кумаре, Д.; С. Антонаракис (ред.). Медицинская и оздоровительная геномика . Elsevier Science. стр. 117. doi :10.1016/B978-0-12-420196-5.00009-5. ISBN 978-0-12-799922-7.
- ^ abcdefghij Шервуд, Линда; Уилли, Джоанн; Вулвертон, Кристофер Дж. (2013). Микробиология Прескотта . McGraw-Hill Education. стр. 713–721 . ISBN 978-0-07-340240-6.
- ^ abcdefghijklmn Гуарнер, Ф; Малагелада, Дж (2003). «Кишечная флора в здоровье и болезни». Ланцет . 361 (9356): 512–519 . doi :10.1016/S0140-6736(03)12489-0. ПМИД 12583961.
- ^ abcdefghij Beaugerie, Laurent; Petit, Jean-Claude (2004). «Антибиотик-ассоциированная диарея». Best Practice & Research Clinical Gastroenterology . 18 (2): 337– 352. doi :10.1016/j.bpg.2003.10.002. PMID 15123074.
- ^ Стивен, AM; Каммингс, JH (1980). «Вклад микробов в массу фекалий человека». Журнал медицинской микробиологии . 13 (1): 45–56 . doi : 10.1099/00222615-13-1-45 . PMID 7359576.
- ^ abcde Куигли, Э. М. (2013). «Кишечные бактерии в здоровье и болезни». Гастроэнтерология и гепатология . 9 (9): 560–569 . PMC 3983973. PMID 24729765 .
- ^ Turnbaugh, Peter J.; Ley, Ruth E.; Hamady, Micah; Fraser-Liggett, Claire M.; Knight, Rob; Gordon, Jeffrey I. (октябрь 2007 г.). «Проект микробиома человека». Nature . 449 (7164): 804– 810. Bibcode :2007Natur.449..804T. doi :10.1038/nature06244. PMC 3709439 . PMID 17943116.
- ^ Ма, Гуанъюй; Ши, Юйгуо; Мэн, Лулу; Фань, Хаолун; Тан, Сяомэй; Ло, Хуэйцзюань; Ван, Дунцзюй; Чжоу, Хуан; Сяо, Сяоминь (2023). «Факторы, влияющие на раннее установление неонатальной кишечной флоры, и меры ее вмешательства». Frontiers in Cellular and Infection Microbiology . 13 . doi : 10.3389/fcimb.2023.1295111 . PMC 10722192 . PMID 38106467.
- ^ abcdefghijklmnop Sommer, Felix; Bäckhed, Fredrik (2013). «Микробиота кишечника – хозяева развития и физиологии хозяина». Nature Reviews Microbiology . 11 (4): 227– 238. doi :10.1038/nrmicro2974. PMID 23435359.
- ^ abcd Фадерл, Мартин; Ноти, Марио; Корацца, Надя; Мюллер, Кристоф (2015). «Контроль над микробами: слизистый слой как критический компонент поддержания кишечного гомеостаза». IUBMB Life . 67 (4): 275–285 . doi : 10.1002/iub.1374 . PMID 25914114.
- ^ abcdef Кларк, Джерард; Стиллинг, Роман М; Кеннеди, Пол Дж; Стэнтон, Кэтрин; Крайан, Джон Ф; Динан, Тимоти Г (2014). «Мини-обзор: микробиота кишечника: забытый эндокринный орган». Молекулярная эндокринология . 28 (8): 1221– 1238. doi : 10.1210/me.2014-1108. PMC 5414803. PMID 24892638.
- ^ abcdef Шен, Sj; Вонг, Конни HY (2016). «Bugginginflammatory: Role of thegut microbiota». Клиническая и трансляционная иммунология . 5 (4): e72. doi :10.1038/cti.2016.12. PMC 4855262. PMID 27195115 .
- ^ ab Wang, Huiying; Lee, In-Seon; Braun, Christoph; Enck, Paul (2016). «Влияние пробиотиков на функции центральной нервной системы у животных и людей: систематический обзор». Journal of Neurogastroenterology and Motility . 22 (4): 589– 605. doi :10.5056/jnm16018. PMC 5056568. PMID 27413138 .
- ^ Сальвадори, М (20 марта 2024 г.). «Обновление микробиома кишечника в здоровье и болезнях». World J Methodol . 14 (1). doi : 10.5662/wjm.v14.i1.89196 . PMC 10989414. PMID 38577200 .
- ^ abcde Sears, Cynthia L. (2005). «Динамическое партнерство: чествование нашей кишечной флоры». Anaerobe . 11 (5): 247– 251. doi :10.1016/j.anaerobe.2005.05.001. PMID 16701579.
- ^ Lozupone, Catherine A.; Stombaugh, Jesse I.; Gordon, Jeffrey I.; Jansson, Janet K.; Knight, Rob (2012). «Разнообразие, стабильность и устойчивость микробиоты кишечника человека». Nature . 489 (7415): 220– 230. Bibcode :2012Natur.489..220L. doi :10.1038/nature11550. PMC 3577372 . PMID 22972295.
- ^ Шанахан, Фергус (2002). «Интерфейс хозяин–микроб в кишечнике». Best Practice & Research Clinical Gastroenterology . 16 (6): 915–931 . doi :10.1053/bega.2002.0342. PMID 12473298.
- ^ Тап, Жюльен; Мондо, Станислас; Левенес, Флоренция; Пеллетье, Эрик; Кэрон, Кристоф; Фюре, Жан-Пьер; Угарте, Эдгардо; Муньос-Тамайо, Рафаэль; Паслье, Денис Л.Е.; Налин, Рено; Доре, Джоэл; Леклерк, Мэрион (2009). «К филогенетическому ядру кишечной микробиоты человека». Экологическая микробиология . 11 (10): 2574–2584 . Бибкод : 2009EnvMi..11.2574T. дои : 10.1111/j.1462-2920.2009.01982.x . ПМИД 19601958.
- ^ ab O'Hara, Ann M; Shanahan, Fergus (2006). «Флора кишечника как забытый орган». EMBO Reports . 7 (7): 688– 693. doi :10.1038/sj.embor.7400731. PMC 1500832. PMID 16819463 .
- ^ Ханна, Сахил; Тош, Притиш К (2014). «Учебник для врачей о роли микробиома в здоровье и болезнях человека». Труды клиники Майо . 89 (1): 107– 114. doi :10.1016/j.mayocp.2013.10.011. PMID 24388028.
- ^ ab Cui, Lijia; Morris, Alison; Ghedin, Elodie (2013). «Человеческий микобиом в здоровье и болезни». Genome Medicine . 5 (7): 63. doi : 10.1186/gm467 . PMC 3978422. PMID 23899327 .
- ^ Эрдоган, Аскин; Рао, Сатиш С. К. (2015). «Избыточный рост грибков в тонком кишечнике». Current Gastroenterology Reports . 17 (4): 16. doi :10.1007/s11894-015-0436-2. PMID 25786900.
- ^ Белло, Мария Г. Домингес; Найт, Роб; Гилберт, Джек А.; Блейзер, Мартин Дж. (4 октября 2018 г.). «Сохранение микробного разнообразия». Science . 362 (6410): 33– 34. Bibcode :2018Sci...362...33B. doi :10.1126/science.aau8816. PMID 30287652.
- ^ аб Арумугам, Маниможиян; Раес, Йерун; Пеллетье, Эрик; Ле Паслье, Дени; Ямада, Такудзи; Менде, Дэниел Р.; Фернандес, Габриэль Р.; Тэп, Жюльен; Брюльс, Томас; Батто, Жан-Мишель; Берталан, Марсело; Боррюэль, Наталья; Казельяс, Франческ; Фернандес, Лейден; Готье, Лоран; Хансен, Торбен; Хаттори, Масахира; Хаяси, Тецуя; Клееребезем, Михель; Курокава, Кен; Леклерк, Марион; Левенес, Флоренция; Маничан, Чайсаван; Нильсен, Х. Бьёрн; Нильсен, Трина; Понс, Николас; Пулен, Жюли; Цинь, Цзюньцзе; Зихеритц-Понтен, Томас; Тимс, Себастьян (2011). «Энтеротипы микробиома кишечника человека». Nature . 473 (7346): 174– 180. Bibcode :2011Natur.473..174.. doi :10.1038/nature09944. PMC 3728647 . PMID 21508958.
- ^ Wu, GD; Chen, J.; Hoffmann, C.; Bittinger, K.; Chen, Y.-Y.; Keilbaugh, SA; Bewtra, M.; Knights, D.; Walters, WA; Knight, R.; Sinha, R.; Gilroy, E.; Gupta, K.; Baldassano, R.; Nessel, L.; Li, H.; Bushman, FD; Lewis, JD (2011). «Связь долгосрочных диетических схем с кишечными микробными энтеротипами». Science . 334 (6052): 105– 108. Bibcode :2011Sci...334..105W. doi :10.1126/science.1208344. PMC 3368382 . PMID 21885731.
- ^ Циммер, Карл (20 апреля 2011 г.). «Бактерии делят людей на 3 типа, говорят ученые». The New York Times . Получено 21 апреля 2011 г. Группа
ученых теперь сообщает всего о трех различных экосистемах в кишечнике людей, которых они изучали.
- ^ Найтс, Дэн; Уорд, Тоня; МакКинли, Кристофер; Миллер, Ханна; Гонсалес, Антонио; Макдональд, Дэниел; Найт, Роб (8 октября 2014 г.). «Переосмысление «энтеротипов»». Cell Host & Microbe . 16 (4): 433– 437. doi :10.1016/j.chom.2014.09.013. PMC 5558460 . PMID 25299329.
- ^ ab Nardone, G; Compare, D (июнь 2015 г.). «Микробиота желудка человека: пора ли переосмыслить патогенез заболеваний желудка?». United European Gastroenterology Journal . 3 (3): 255– 60. doi : 10.1177/2050640614566846. PMC 4480535. PMID 26137299 .
- ^ Яо, X; Смолка, AJ (июнь 2019 г.). «Физиология париетальных клеток желудка и заболевания, вызванные Helicobacter pylori». Гастроэнтерология . 156 (8): 2158– 2173. doi : 10.1053/j.gastro.2019.02.036. PMC 6715393. PMID 30831083 .
- ^ Тодар, Кеннет (2012). «Нормальная бактериальная флора человека». Онлайн-учебник бактериологии Тодара . Получено 25 июня 2016 г.
- ^ Куигли, Имонн ММ; Куэра, Родриго (2006). «Избыточный бактериальный рост в тонком кишечнике: роль антибиотиков, пребиотиков и пробиотиков». Гастроэнтерология . 130 (2): S78–90. doi : 10.1053/j.gastro.2005.11.046 . PMID 16473077.
- ^ Адамс, MR; Мосс, MO (2007). Пищевая микробиология . doi : 10.1039/9781847557940. ISBN 978-0-85404-284-5.[ нужна страница ]
- ^ ab "Нормальная кишечная флора" (PDF) (слайд-шоу). 2004. Архивировано из оригинала (PDF) 2004-05-26 . Получено 2023-01-02 – через Университет Глазго.
- ^ Браун А., Блаут М. (2016). «Виды бактерий, участвующие в преобразовании пищевых флавоноидов в кишечнике человека». Gut Microbes . 7 (3): 216– 234. doi :10.1080/19490976.2016.1158395. PMC 4939924. PMID 26963713 .
- ^ ab Steinhoff, U (2005). «Кто управляет толпой? Новые открытия и старые вопросы о кишечной микрофлоре». Immunology Letters . 99 (1): 12– 16. doi :10.1016/j.imlet.2004.12.013. PMID 15894105.
- ^ abcdef Гибсон, Гленн Р. (2004). «Клетчатка и ее воздействие на пробиотики (концепция пребиотиков)». Clinical Nutrition Supplements . 1 (2): 25–31 . doi :10.1016/j.clnu.2004.09.005.
- ^ Микель, С.; Мартин, Р.; Росси, О.; Бермудес-Умаран, Л. Г.; Шатель, Дж. М.; Сокол, Х.; Томас, М.; Уэллс, Дж. М.; Ланджелла, П. (2013). «Faecalibacterium prausnitzii и здоровье кишечника человека». Current Opinion in Microbiology . 16 (3): 255– 261. doi :10.1016/j.mib.2013.06.003. PMID 23831042.
- ^ Лей, Рут Э. (2010). «Ожирение и микробиом человека». Current Opinion in Gastroenterology . 26 (1): 5– 11. doi :10.1097/MOG.0b013e328333d751. PMID 19901833.
- ^ Nash, Andrea K; Auchtung, Thomas A; Wong, Matthew C; Smith, Daniel P; Gesell, Jonathan R; Ross, Matthew C; Stewart, Christopher J; Metcalf, Ginger A; Muzny, Donna M; Gibbs, Richard A; Ajami, Nadim J; Petrosino, Joseph F (2017). "Микобиом кишечника здоровой когорты проекта Human Microbiome". Microbiome . 5 (1): 153. doi : 10.1186/s40168-017-0373-4 . PMC 5702186 . PMID 29178920.
- ^ Халлен-Адамс, Хизер Э.; Зур, Мэллори Дж. (3 апреля 2017 г.). «Грибы в здоровом желудочно-кишечном тракте человека». Вирулентность . 8 (3): 352– 358. doi :10.1080/21505594.2016.1247140. PMC 5411236. PMID 27736307 .
- ^ abc "Какие грибы живут в кишечнике? Познакомьтесь с кишечным микобиомом". Quadram Institute . Получено 2024-07-25 .
- ^ Кляйн, Элис (20 октября 2019 г.). «Тело человека варит собственное пиво после того, как дрожжи захватывают его кишечный микробиом». New Scientist . Получено 25 июля 2024 г.
- ^ Пейнтер, Келли; Корделл, Барбара Дж.; Стикко, Кристин Л. (2024), «Синдром автопивоварни», StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 30020718 , получено 25 июля 2024 г.
- ^ Браун, Хилари П.; Шао, Янь; Лоули, Тревор Д. (октябрь 2022 г.). «Передача микробиоты человека от матери к ребенку». Current Opinion in Microbiology . 69 : 102173. doi : 10.1016/j.mib.2022.102173. PMID 35785616.
- ^ Скарпеллини, Эмидио; Яниро, Джанлука; Аттили, Фабия; Бассанелли, Кьяра; Де Сантис, Адриано; Гасбаррини, Антонио (2015). «Микробиота кишечника и виром человека: потенциальные терапевтические последствия». Болезни пищеварения и печени . 47 (12): 1007–1012 . doi : 10.1016/j.dld.2015.07.008 . ПМЦ 7185617 . ПМИД 26257129.
- ^ Герритсен, Жаколин; Смидт, Хауке; Рийкерс, Гер; де Вос, Виллем (27 мая 2011 г.). «Кишечная микробиота на здоровье и болезни человека: влияние пробиотиков». Гены и питание . 6 (3): 209–240 . doi :10.1007/s12263-011-0229-7. ПМК 3145058 . ПМИД 21617937.
- ^ abcdef Яцуненко, Т.; Рей, FE; Манари, MJ; Трехан, И.; Домингес-Белло, MG; Контрерас, М.; Магрис, М.; Идальго, G.; Балдассано, RN; Анохин, AP; Хит, AC; Уорнер, B.; Ридер, J.; Кучински, J.; Капорасо, JG; Лозупоне, CA; Лаубер, C.; Клементе, JC; Найтс, D.; Найт, R.; Гордон, JI (2012). «Микробиом кишечника человека в зависимости от возраста и географии». Nature . 486 (7402): 222– 227. Bibcode :2012Natur.486..222Y. doi :10.1038/nature11053. PMC 3376388. PMID 22699611 .
- ^ De Filippo, C; Cavalieri, D; Di Paola, M; Ramazzotti, M; Poullet, J. B; Massart, S; Collini, S; Pieraccini, G; Lionetti, P (2010). «Влияние диеты на формирование микробиоты кишечника, выявленное сравнительным исследованием у детей из Европы и сельской Африки». Труды Национальной академии наук . 107 (33): 14691– 14696. Bibcode : 2010PNAS..10714691D. doi : 10.1073/pnas.1005963107 . PMC 2930426. PMID 20679230 .
- ^ Jonkers, Daisy MAE (2016). «Микробные возмущения и модуляция при состояниях, связанных с недоеданием и мальабсорбцией». Best Practice & Research Clinical Gastroenterology . 30 (2): 161– 172. doi :10.1016/j.bpg.2016.02.006. PMID 27086883.
- ^ Миллион, Матье; Диалло, Альдиума; Рауль, Дидье (май 2017 г.). «Микробиота кишечника и неполноценное питание» (PDF) . Микробный патогенез . 106 : 127–138 . doi :10.1016/j.micpath.2016.02.003. PMID 26853753.
- ^ Риттер, Марен Йоханн Хейльсков; Колте, Лилиан; Бринд, Андре; Фриис, Хенрик; Кристенсен, Вибеке Брикс (2014). «Иммунная система у детей с недостаточностью питания – систематический обзор». ПЛОС ОДИН . 9 (8): е105017. Бибкод : 2014PLoSO...9j5017R. дои : 10.1371/journal.pone.0105017 . ПМЦ 4143239 . ПМИД 25153531.
- ^ ab Alcock, Joe; Maley, Carlo C; Aktipis, C. Athena (2014). «Манипулирует ли пищевое поведение желудочно-кишечной микробиотой? Эволюционное давление и потенциальные механизмы». BioEssays . 36 (10): 940–949 . doi :10.1002/bies.201400071. PMC 4270213. PMID 25103109 .
- ^ abc Ренсон, Одри; Херд, Памела; Дауд, Дженнифер Б. (2020). «Больные люди и больные (микробные) популяции: проблемы эпидемиологии и микробиома». Ежегодный обзор общественного здравоохранения . 41 : 63–80 . doi : 10.1146/annurev-publhealth-040119-094423 . PMC 9713946. PMID 31635533 .
- ^ Колелла, М., Чаритос, И.А., Баллини, А., Кафьеро, К., Топи, С., Пальмиротта, Р. и Сантакроче, Л. (2023). Революция микробиоты: как кишечные микробы регулируют нашу жизнь. Всемирный журнал гастроэнтерологии, 29 (28), 4368–4383. https://doi.org/10.3748/wjg.v29.i28.4368
- ^ Колелла, М., Чаритос, И.А., Баллини, А., Кафьеро, К., Топи, С., Пальмиротта, Р. и Сантакроче, Л. (2023). Революция микробиоты: как кишечные микробы регулируют нашу жизнь. Всемирный журнал гастроэнтерологии, 29 (28), 4368–4383. https://doi.org/10.3748/wjg.v29.i28.4368
- ^ Туррони, Франческа; Пеано, Клелия; Пасс, Дэниел А; Форони, Елена; Севергнини, Марко; Классон, Маркус Дж; Керр, Колм; Хурихейн, Джонатан; Мюррей, Дейдра; Фулиньи, Фабио; Гемонд, Мигель; Маргольес, Абелардо; Де Беллис, Джанлука; о'Тул, Пол В.; Ван Синдерен, Доуве; Маркези, Джулиан Р.; Вентура, Марко (2012). «Разнообразие бифидобактерий в микробиоте кишечника младенцев». ПЛОС ОДИН . 7 (5): e36957. Бибкод : 2012PLoSO...736957T. дои : 10.1371/journal.pone.0036957 . ПМК 3350489 . PMID 22606315.
- ^ Дэвенпорт, Эмили Р.; Сандерс, Джон Г.; Сонг, Се Джин; Амато, Кэтрин Р.; Кларк, Эндрю Г.; Найт, Роб (декабрь 2017 г.). «Человеческий микробиом в эволюции». BMC Biology . 15 (1): 127. doi : 10.1186/s12915-017-0454-7 . PMC 5744394 . PMID 29282061.
- ^ Перес-Муньос, Мария Элиза; Арриета, Мари-Клер; Рамер-Тайт, Аманда Э.; Уолтер, Йенс (2017). «Критическая оценка гипотез «стерильной матки» и «внутриутробной колонизации»: выводы для исследований микробиома новорожденных». Микробиом . 5 (1): 48. doi : 10.1186/s40168-017-0268-4 . PMC 5410102 . PMID 28454555.
- ^ Матаморос, Себастьян; Гра-Леген, Кристель; Ле Вакон, Франсуаза; Потель, Жиль; де ла Кошетьер, Мари-Франс (2013). «Развитие микробиоты кишечника у детей раннего возраста и ее влияние на здоровье». Тенденции в микробиологии . 21 (4): 167–173 . doi :10.1016/j.tim.2012.12.001. ПМИД 23332725.
- ^ abcdefg Мюллер, Ноэль Т.; Бакакс, Элизабет; Комбеллик, Джоан; Григорян, Зоя; Домингес-Белло, Мария Г. (2015). «Развитие микробиома младенца: мама имеет значение». Тенденции в молекулярной медицине . 21 (2): 109– 117. doi :10.1016/j.molmed.2014.12.002. PMC 4464665. PMID 25578246 .
- ^ Хименес, Эстер; Фернандес, Леонидес; Марин, Мария Л; Мартин, Росио; Одриосола, Хуан М; Нуэно-Палоп, Кармен; Нарбад, Арьян; Оливарес, Моника; Хаус, Хорди; Родригес, Хуан М (2005). «Выделение комменсальных бактерий из пуповинной крови здоровых новорожденных, рожденных путем кесарева сечения». Современная микробиология . 51 (4): 270–274 . doi :10.1007/s00284-005-0020-3. ПМИД 16187156.
- ^ Колладо, Мария Кармен; Раутава, Самули; Аакко, Юхани; Изолаури, Эрика; Салминен, Сеппо (2016). «Колонизация кишечника человека может быть инициирована in utero различными микробными сообществами в плаценте и амниотической жидкости». Scientific Reports . 6 : 23129. Bibcode :2016NatSR...623129C. doi :10.1038/srep23129. PMC 4802384 . PMID 27001291.
- ^ Хименес, Эстер; Марин, Мария Л.; Мартин, Росио; Одриосола, Хуан М.; Оливарес, Моника; Хаус, Хорди; Фернандес, Леонидес; Родригес, Хуан М. (2008). «Действительно ли меконий здоровых новорожденных стерилен?». Исследования в области микробиологии . 159 (3): 187–193 . doi : 10.1016/j.resmic.2007.12.007 . ПМИД 18281199.
- ^ Перес-Муньос, Мария Элиза; Арриета, Мари-Клер; Рамер-Тайт, Аманда Э.; Уолтер, Йенс (2017). «Критическая оценка гипотез «стерильной матки» и «внутриутробной колонизации»: выводы для исследований микробиома новорожденных». Микробиом . 5 (1): 48. doi : 10.1186/s40168-017-0268-4 . PMC 5410102 . PMID 28454555.
- ^ Адлерберт, И; Уолд, А.Е. (2009). «Создание микробиоты кишечника у западных младенцев». Acta Paediatrica . 98 (2): 229– 238. doi :10.1111/j.1651-2227.2008.01060.x. PMID 19143664.
- ^ «Кишечные бактерии младенцев, зависящие от способа доставки». ScienceDaily (пресс-релиз). Wellcome Trust Sanger Institute. 18 сентября 2019 г. Архивировано из оригинала 24 ноября 2021 г.
- ^ Коппа, ГВ; Зампини, Л.; Галеацци, Т.; Габриэлли, О. (2006). «Пребиотики в грудном молоке: обзор». Болезни пищеварения и печени . 38 : С291–294. дои : 10.1016/S1590-8658(07)60013-9. ПМИД 17259094.
- ^ Mady, Eman A.; Doghish, Ahmed S.; El-Dakroury, Walaa A.; Elkhawaga, Samy Y.; Ismail, Ahmed; El-Mahdy, Hesham A.; Elsakka, Elsayed GE; El-Husseiny, Hussein M. (июль 2023 г.). «Влияние микробиоты кишечника матери на микробиом и развитие мозга младенца». Neuroscience & Biobehavioral Reviews . 150 : 105195. doi : 10.1016/j.neubiorev.2023.105195. PMID 37100161.
- ^ Фанаро, С; Кьеричи, Р; Геррини, П; Виги, В. (2007). «Кишечная микрофлора в раннем детстве: состав и развитие». Акта Педиатрика . 92 (441): 48–55 . doi :10.1111/j.1651-2227.2003.tb00646.x. ПМИД 14599042.
- ^ Яссур, Моран; Ватанен, Томми; Сильяндер, Хели; Хямяляйнен, Ану-Маария; Харконен, Тайна; Рюханен, Самппа Дж; Францоза, Эрик А; Вламакис, Гера; Хаттенхауэр, Кертис; Геверс, Дирк; Ландер, Эрик С; Книп, Микаэль; Ксавье, Рамник Дж (2016). «Естественная история микробиома кишечника ребенка и влияние лечения антибиотиками на разнообразие и стабильность бактериальных штаммов». Наука трансляционной медицины . 8 (343): 343ра81. doi : 10.1126/scitranslmed.aad0917. ПМК 5032909 . ПМИД 27306663.
- ^ Гибсон, GR; Роберфруа, MB (1995). «Диетическая модуляция микробиоты толстой кишки человека: введение в концепцию пребиотиков». Журнал питания . 125 (6): 1401– 1412. doi :10.1093/jn/125.6.1401. PMID 7782892.
- ^ abcd Ван, Ян; Каспер, Ллойд Х (2014). «Роль микробиома в расстройствах центральной нервной системы». Мозг, поведение и иммунитет . 38 : 1– 12. doi :10.1016/j.bbi.2013.12.015. PMC 4062078 . PMID 24370461.
- ^ ab Yoon, My Young; Lee, Keehoon; Yoon, Sang Sun (2014). «Защитная роль кишечных комменсальных микробов против кишечных инфекций». Журнал микробиологии . 52 (12): 983–989 . doi :10.1007/s12275-014-4655-2. PMID 25467115.
- ^ Рейнозо Уэбб, Синтия; Кобозиев, Юрий; Фурр, Кэтрин Л.; Гришам, Мэтью Б. (2016). «Защитные и провоспалительные роли кишечных бактерий». Патофизиология . 23 (2): 67– 80. doi :10.1016/j.pathophys.2016.02.002. PMC 4867289. PMID 26947707 .
- ^ Mantis, NJ; Rol, N; Corthésy, B (2011). «Комплексные роли секреторного IgA в иммунитете и гомеостазе слизистой оболочки кишечника». Mucosal Immunology . 4 (6): 603– 611. doi :10.1038/mi.2011.41. PMC 3774538. PMID 21975936 .
- ^ ab Peterson, Lance W; Artis, David (2014). «Эпителиальные клетки кишечника: регуляторы барьерной функции и иммунного гомеостаза». Nature Reviews Immunology . 14 (3): 141– 153. doi :10.1038/nri3608. PMID 24566914.
- ^ ab Honda, Кения; Литтман, Дэн Р. (2016). «Микробиота в адаптивном иммунном гомеостазе и заболеваниях». Nature . 535 (7610): 75– 84. Bibcode :2016Natur.535...75H. doi :10.1038/nature18848. PMID 27383982.
- ^ ab Леви, М.; Тайсс, Калифорния; Элинав, Э. (2016). «Метаболиты: посредники между микробиотой и иммунной системой». Гены и развитие . 30 (14): 1589– 1597. doi :10.1101/gad.284091.116. PMC 4973288. PMID 27474437 .
- ^ abcdefghi Zhang LS, Davies SS (апрель 2016 г.). «Микробный метаболизм пищевых компонентов в биоактивные метаболиты: возможности для новых терапевтических вмешательств». Genome Med . 8 (1): 46. doi : 10.1186/s13073-016-0296-x . PMC 4840492 . PMID 27102537.
Lactobacillus
spp. преобразуют триптофан в индол-3-альдегид (I3A) с помощью неидентифицированных ферментов [125].
Clostridium sporogenes
преобразуют триптофан в IPA [6], вероятно, с помощью триптофандезаминазы. ... IPA также эффективно удаляет гидроксильные радикалы
Таблица 2: Микробные метаболиты: их синтез, механизмы действия и влияние на здоровье и болезни
Рисунок 1: Молекулярные механизмы действия индола и его метаболитов на физиологию и болезни хозяина - ^ Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, Siuzdak G (март 2009 г.). «Анализ метаболомики выявляет большое влияние микрофлоры кишечника на метаболиты крови млекопитающих». Proc. Natl. Acad. Sci. USA . 106 (10): 3698– 3703. Bibcode :2009PNAS..106.3698W. doi : 10.1073/pnas.0812874106 . PMC 2656143 . PMID 19234110.
Было показано, что производство ИПА полностью зависит от присутствия микрофлоры кишечника и может быть установлено путем колонизации бактерией
Clostridium sporogenes
.
Диаграмма метаболизма ИПА - ^ "3-Индолпропионовая кислота". База данных метаболома человека . Университет Альберты . Получено 12 июня 2018 г.
- ^ Chyan YJ, Poeggeler B, Omar RA, Chain DG, Frangione B, Ghiso J, Pappolla MA (июль 1999 г.). «Мощные нейропротекторные свойства против бета-амилоида Альцгеймера с помощью эндогенной структуры индола, связанной с мелатонином, индол-3-пропионовой кислоты». J. Biol. Chem . 274 (31): 21937– 21942. doi : 10.1074/jbc.274.31.21937 . PMID 10419516. S2CID 6630247.
[Индол-3-пропионовая кислота (ИПК)] ранее была обнаружена в плазме и спинномозговой жидкости человека, но ее функции неизвестны. ... В экспериментах по кинетической конкуренции с использованием агентов, улавливающих свободные радикалы, способность IPA удалять гидроксильные радикалы превысила способность мелатонина, индоламина, который считается самым мощным естественным поглотителем свободных радикалов. В отличие от других антиоксидантов, IPA не был преобразован в реактивные промежуточные продукты с прооксидантной активностью.
- ^ Хоппер, Кристофер П.; Де Ла Круз, Леди Кимберли; Лайлс, Кристин В.; Уэрхэм, Лорен К.; Гилберт, Джек А.; Эйхенбаум, Зехава; Магировски, Марчин; Пул, Роберт К.; Воллборн, Якоб; Ван, Бинхэ (23 декабря 2020 г.). «Роль оксида углерода в коммуникации между хозяином и микробиомом кишечника». Chemical Reviews . 120 (24): 13273– 13311. doi : 10.1021/acs.chemrev.0c00586. PMID 33089988.
- ^ Rajilić-Stojanović, Mirjana; De Vos, Willem M (2014). «Первые 1000 культивируемых видов микробиоты желудочно-кишечного тракта человека». FEMS Microbiology Reviews . 38 (5): 996–1047 . doi :10.1111/1574-6976.12075. PMC 4262072. PMID 24861948 .
- ^ Хилл, М. Дж. (март 1997 г.). «Кишечная флора и эндогенный синтез витаминов». Европейский журнал профилактики рака . 6 : S43 – S45 . doi :10.1097/00008469-199703001-00009. PMID 9167138.
- ^ "Микробиом". Tufts Now . 2013-09-17 . Получено 2020-12-09 .
- ^ Мораис, Сара; Винклер, Сара; Зореа, Альва; Левин, Лирон; Нагиес, Фальк СП; Капуст, Нильс; Ламед, Ева; Артан-Фурман, Авиталь; Болам, Дэвид Н.; Ядав, Мадхав П.; Байер, Эдвард А.; Мартин, Уильям Ф.; Мизрахи, Ицхак (15 марта 2024 г.). «Скрытое разнообразие кишечных бактерий, разрушающих целлюлозу, у индустриальных людей». Science . 383 (6688): eadj9223. Bibcode :2024Sci...383j9223M. doi :10.1126/science.adj9223. PMC 7615765 . PMID 38484069.
- ^ abcde ElRakaiby M, Dutilh BE, Rizkallah MR, Boleij A, Cole JN, Aziz RK (июль 2014 г.). «Фармакомикробиомика: влияние вариаций человеческого микробиома на системную фармакологию и персонализированную терапию». Omics . 18 (7): 402– 414. doi :10.1089/omi.2014.0018. PMC 4086029 . PMID 24785449.
- ^ abc Cho I, Blaser MJ (март 2012 г.). "Человеческий микробиом: на стыке здоровья и болезни". Nature Reviews. Genetics . 13 (4): 260– 270. doi :10.1038/nrg3182. PMC 3418802. PMID 22411464. Состав
микробиома варьируется в зависимости от анатомического местоположения (рисунок 1). Основным фактором, определяющим состав сообщества, является анатомическое местоположение: межличностные различия существенны
23,24
и выше временной изменчивости, наблюдаемой в большинстве мест у одного человека
25
.
- ^ Hutter T, Gimbert C, Bouchard F, Lapointe FJ (2015). «Быть человеком — это внутреннее чувство». Microbiome . 3 : 9. doi : 10.1186/s40168-015-0076-7 . PMC 4359430 . PMID 25774294.
- ^ Кумар, Кундан; Дхок, Гаурао В.; Шарма, Ашок К.; Джайсвал, Шубхам К.; Шарма, Винит К. (июль 2019 г.). «Механистическое выяснение метаболизма амфетамина тираминоксидазой из микробиоты кишечника человека с использованием моделирования молекулярной динамики». Журнал клеточной биохимии . 120 (7): 11206– 11215. doi : 10.1002/jcb.28396. PMID 30701587.
- ^ Соуза, Тиаго; Патерсон, Ронни; Мур, Ванесса; Карлссон, Андерс; Абрахамссон, Бертил; Басит, Абдул В. (2008). «Желудочно-кишечная микробиота как место биотрансформации лекарств». Международный журнал фармацевтики . 363 ( 1–2 ): 1–25 . doi :10.1016/j.ijpharm.2008.07.009. PMID 18682282.
- ^ Хайзер, HJ; Гутенберг, Д.Б.; Чатман, К; Сирасани, Г; Бальскус, Е.П.; Тернбо, П.Дж. (2013). «Прогнозирование и управление инактивацией сердечных препаратов кишечной бактерией Eggerthella lenta». Наука . 341 (6143): 295–298 . Бибкод : 2013Sci...341..295H. дои : 10.1126/science.1235872. ПМЦ 3736355 . ПМИД 23869020.
- ^ ab Koppel, Nitzan; Maini Rekdal, Vayu; Balskus, Emily P. (23 июня 2017 г.). «Химическая трансформация ксенобиотиков микробиотой кишечника человека». Science . 356 (6344). doi :10.1126/science.aag2770. PMC 5534341 . PMID 28642381.
- ^ abc Спаногианнопулос, Питер; Бесс, Элизабет Н.; Кармоди, Рэйчел Н.; Тернбо, Питер Дж. (май 2016 г.). «Микробные фармацевты внутри нас: метагеномный взгляд на метаболизм ксенобиотиков». Nature Reviews Microbiology . 14 (5): 273– 287. doi :10.1038/nrmicro.2016.17. PMC 5243131. PMID 26972811 .
- ^ ab Maini Rekdal, Vayu; Bess, Elizabeth N.; Bisanz, Jordan E.; Turnbaugh, Peter J.; Balskus, Emily P. (14 июня 2019 г.). «Открытие и ингибирование межвидового кишечного бактериального пути метаболизма леводопы». Science . 364 (6445). doi :10.1126/science.aau6323. PMC 7745125 . PMID 31196984.
- ^ ab Dempsey, Joseph L.; Cui, Julia Yue (декабрь 2019 г.). «Микробиом — функциональный модификатор метаболизма лекарств P450». Current Pharmacology Reports . 5 (6): 481– 490. doi :10.1007/s40495-019-00200-w. PMC 7731899. PMID 33312848 .
- ^ Бёрнер, Удо; Эбботт, Сет; Роу, Роберт Л. (январь 1975 г.). «Метаболизм морфина и героина у человека». Обзоры метаболизма наркотиков . 4 (1): 39–73 . doi :10.3109/03602537508993748. PMID 1204496.
- ^ Добкин, Джей Ф.; Саха, Джнан Р.; Батлер, Винсент П.; Ной, Гарольд К.; Линденбаум, Джон (15 апреля 1983 г.). «Бактерии, инактивирующие дигоксин: идентификация во флоре кишечника человека». Science . 220 (4594): 325– 327. doi :10.1126/science.6836275. PMID 6836275.
- ^ Sahota, SS; Bramley, PM; Menzies, IS (февраль 1982). «Ферментация лактулозы кишечными бактериями». Микробиология . 128 (2): 319– 325. doi : 10.1099/00221287-128-2-319 . PMID 6804597.
- ^ ab Yoo, Dae-Hyoung; Kim, In Sook; Van Le, Thi Kim; Jung, Il-Hoon; Yoo, Hye Hyun; Kim, Dong-Hyun (сентябрь 2014 г.). «Взаимодействие лекарственных препаратов, опосредованное кишечной микробиотой, между ловастатином и антибиотиками». Метаболизм и распределение лекарственных средств . 42 (9): 1508– 1513. doi :10.1124/dmd.114.058354. PMID 24947972.
- ^ Хайзер, Генри Дж.; Гутенберг, Дэвид Б.; Чатман, Келли; Сирасани, Гопал; Балскус, Эмили П.; Тернбо, Питер Дж. (19 июля 2013 г.). «Прогнозирование и управление инактивацией сердечных препаратов кишечной бактерией человека Eggerthella lenta». Science . 341 (6143): 295– 298. Bibcode :2013Sci...341..295H. doi :10.1126/science.1235872. PMC 3736355 . PMID 23869020.
- ^ Parvez, Md Masud; Basit, Abdul; Jariwala, Parth B.; Gáborik, Zsuzsanna; Kis, Emese; Heyward, Scott; Redinbo, Matthew R.; Prasad, Bhagwat (август 2021 г.). «Количественное исследование метаболизма иринотекана, транспорта и активации микробиома кишечника». Drug Metabolism and Disposition . 49 (8): 683– 693. doi :10.1124/dmd.121.000476. PMC 8407663. PMID 34074730 .
- ^ ab Sousa, Tiago; Paterson, Ronnie; Moore, Vanessa; Carlsson, Anders; Abrahamsson, Bertil; Basit, Abdul W. (ноябрь 2008 г.). «Желудочно-кишечная микробиота как место биотрансформации лекарств». International Journal of Pharmaceutics . 363 ( 1–2 ): 1–25 . doi :10.1016/j.ijpharm.2008.07.009. PMID 18682282.
- ^ ab Коппель, Ницан; Бисанц, Джордан Э.; Панделия, Мария-Эйрини; Тернбо, Питер Дж.; Балскус, Эмили П. (15 мая 2018 г.). «Открытие и характеристика распространенного бактериального фермента кишечника человека, достаточного для инактивации семейства растительных токсинов». eLife . 7 . doi : 10.7554/eLife.33953 . PMC 5953540 . PMID 29761785.
- ^ Александр, Джеймс Л.; Уилсон, Ян Д.; Тир, Джулиан; Марчези, Джулиан Р.; Николсон, Джереми К.; Кинросс, Джеймс М. (июнь 2017 г.). «Модуляция эффективности и токсичности химиотерапии со стороны микробиоты кишечника». Nature Reviews Gastroenterology & Hepatology . 14 (6): 356– 365. doi :10.1038/nrgastro.2017.20. hdl : 10044/1/77636 . PMID 28270698.
- ^ Брэнди, Джованни; Дабар, Жан; Райбо, Пьер; Ди Баттиста, Моника; Бридонно, Шанталь; Пизи, Анна Мария; Морселли Лабате, Антонио Мария; Панталео, Мария Аббонданса; Де Виво, Антонелло; Биаско, Гвидо (15 февраля 2006 г.). «Кишечная микрофлора и пищеварительная токсичность иринотекана у мышей». Клинические исследования рака . 12 (4): 1299–1307 . doi :10.1158/1078-0432.CCR-05-0750. ПМИД 16489087.
- ^ Кох, Ара; Де Ваддер, Филипе; Ковачева-Дачари, Петя; Бэкхед, Фредрик (июнь 2016 г.). «От пищевых волокон к физиологии хозяина: короткоцепочечные жирные кислоты как ключевые бактериальные метаболиты». Cell . 165 (6): 1332– 1345. doi : 10.1016/j.cell.2016.05.041 . PMID 27259147.
- ^ Konopelski, Piotr; Ufnal, Marcin (14 сентября 2018 г.). «Индолы — метаболиты триптофана кишечных бактерий с фармакотерапевтическим потенциалом». Current Drug Metabolism . 19 (10): 883– 890. doi :10.2174/1389200219666180427164731. PMID 29708069.
- ^ ab Коллинз, Стефани Л.; Стайн, Джонатан Г.; Бисанц, Джордан Э.; Окафор, К. Дениз; Паттерсон, Эндрю Д. (апрель 2023 г.). «Желчные кислоты и микробиота кишечника: метаболические взаимодействия и влияние на заболевания». Nature Reviews Microbiology . 21 (4): 236– 247. doi :10.1038/s41579-022-00805-x. PMID 36253479.
- ^ Ян, Вэньцзин; Ю, Тяньмин; Хуан, Сяншэн; Билотта, Энтони Дж.; Сюй, Лейци; Лу, Яо; Сунь, Цзярен; Пан, Фан; Чжоу, Цзя; Чжан, Вэньбо; Яо, Суся; Мейнард, Крейг Л.; Сингх, Нагендра; Данн, Сара М.; Лю, Чжаньцзюй; Цун, Инцзы (8 сентября 2020 г.). «Регуляция короткоцепочечных жирных кислот, полученных из кишечной микробиоты, выработки иммунными клетками IL-22 и кишечного иммунитета». Природные коммуникации . 11 (1): 4457. Бибкод : 2020NatCo..11.4457Y. дои : 10.1038/s41467-020-18262-6. ПМЦ 7478978 . PMID 32901017.
- ^ Муругесан, Сельвасанкар; Нирмалкар, Хемлал; Ойо-Вадилло, Карлос; Гарсиа-Эпития, Матильда; Рамирес-Санчес, Даниэла; Гарсия-Мена, Хайме (апрель 2018 г.). «Кишечный микробиом, производящий короткоцепочечные жирные кислоты и ожирение у детей». Европейский журнал клинической микробиологии и инфекционных заболеваний . 37 (4): 621–625 . doi : 10.1007/s10096-017-3143-0. ПМИД 29196878.
- ^ ab Thanissery, Rajani; Winston, Jenessa A.; Theriot, Casey M. (июнь 2017 г.). «Ингибирование прорастания спор, роста и токсинной активности клинически значимых штаммов C. difficile вторичными желчными кислотами, полученными из кишечной микробиоты». Anaerobe . 45 : 86– 100. doi :10.1016/j.anaerobe.2017.03.004. PMC 5466893 . PMID 28279860.
- ^ abc Jones, Brian V.; Begley, Máire; Hill, Colin; Gahan, Cormac GM; Marchesi, Julian R. (9 сентября 2008 г.). «Функциональный и сравнительный метагеномный анализ активности гидролазы желчных солей в микробиоме кишечника человека». Труды Национальной академии наук . 105 (36): 13580– 13585. Bibcode : 2008PNAS..10513580J. doi : 10.1073/pnas.0804437105 . PMC 2533232. PMID 18757757 .
- ^ ab Cao H, Xu M, Dong W, Deng B, Wang S, Zhang Y, Wang S, Luo S, Wang W, Qi Y, Gao J, Cao X, Yan F, Wang B (июнь 2017 г.). «Вторичный дисбиоз, вызванный желчными кислотами, способствует канцерогенезу кишечника». International Journal of Cancer . 140 (11): 2545– 2556. doi : 10.1002/ijc.30643 . PMID 28187526.
- ^ ab Bernstein H, Bernstein C (январь 2023 г.). «Желчные кислоты как канцерогены в толстой кишке и других отделах желудочно-кишечного тракта». Experimental Biology and Medicine . 248 (1): 79– 89. doi :10.1177/15353702221131858. PMC 9989147. PMID 36408538 .
- ^ Майер, Э. А.; Найт, Р.; Мазманян, С. К.; Крайан, Дж. Ф.; Тиллиш, К. (2014). «Кишечные микробы и мозг: смена парадигмы в нейронауке». Журнал нейронауки . 34 (46): 15490– 15496. doi :10.1523/JNEUROSCI.3299-14.2014. PMC 4228144. PMID 25392516 .
- ^ abc Динан, Тимоти Г.; Крайан, Джон Ф. (2015). «Влияние микробиоты кишечника на мозг и поведение». Current Opinion in Clinical Nutrition and Metabolic Care . 18 (6): 552– 558. doi :10.1097/MCO.00000000000000221. PMID 26372511.
- ^ abc Carman, Robert J.; Simon, Mary Alice; Fernández, Haydée; Miller, Margaret A.; Bartholomew, Mary J. (2004). «Ципрофлоксацин в низких концентрациях нарушает колонизационную резистентность человеческой фекальной микрофлоры, растущей в хемостатах». Regulatory Toxicology and Pharmacology . 40 (3): 319– 326. doi :10.1016/j.yrtph.2004.08.005. PMID 15546686.
- ^ Хвас, Кристиан Лодберг; Баунвалл, Саймон Марк Даль; Эрикструп, Кристиан (июль 2020 г.). «Трансплантация фекальной микробиоты: терапия, спасающая жизни, оспариваема коммерческими претензиями на исключительность». eClinicalMedicine . 24 : 100436. doi :10.1016/j.eclinm.2020.100436. PMC 7334803 . PMID 32642633.
- ^ Брандт, Лоуренс Дж.; Бороди, Томас Джулиус; Кэмпбелл, Джордана (2011). «Эндоскопическая трансплантация фекальной микробиоты». Журнал клинической гастроэнтерологии . 45 (8): 655– 657. doi : 10.1097/MCG.0b013e3182257d4f . PMID 21716124.
- ^ Найт, DJW; Гирлинг, KJ (2003). «Кишечная флора в здоровье и болезни». The Lancet . 361 (9371): 512– 519. doi : 10.1016/S0140-6736(03)13438-1 . PMID 12781578.
- ^ abc Cho, I.; Yamanishi, S.; Cox, L.; Methé, BA; Zavadil, J.; Li, K.; Gao, Z.; Mahana, D.; Raju, K.; Teitler, I.; Li, H.; Alekseyenko, AV; Blaser, MJ (2012). «Антибиотики в раннем возрасте изменяют микробиом толстой кишки мышей и ожирение». Nature . 488 (7413): 621– 626. Bibcode :2012Natur.488..621C. doi :10.1038/nature11400. PMC 3553221 . PMID 22914093.
- ^ abc Шнайдерхан, Дж.; Мастер-Хантер, Т.; Локк, А. (2016). «Воздействие на кишечную флору для лечения и профилактики заболеваний». Журнал семейной практики . 65 (1): 34–38 . PMID 26845162.
- ^ Бейкер, Монья (2012). «Беременность изменяет резидентные кишечные микробы». Nature . doi : 10.1038/nature.2012.11118 .
- ^ ab Horta-Baas, Gabriel; Sandoval-Cabrera, Antonio; Romero-Figueroa, María del Socorro (2021-07-03). «Модификация микробиоты кишечника при воспалительном артрите: основные моменты и будущие проблемы». Current Rheumatology Reports . 23 (8): 67. doi :10.1007/s11926-021-01031-9. ISSN 1534-6307. PMID 34218340.
- ^ Хилл, Колин; Гварнер, Франциско; Рид, Грегор; Гибсон, Гленн Р.; Меренштейн, Дэниел Дж.; Пот, Бруно; Морелли, Лоренцо; Канани, Роберто Берни; Флинт, Гарри Дж.; Салминен, Сеппо; Колдер, Филип К.; Сандерс, Мэри Эллен (2014). «Консенсусное заявление Международной научной ассоциации по пробиотикам и пребиотикам о сфере применения и надлежащем использовании термина пробиотик». Nature Reviews Gastroenterology & Hepatology . 11 (8): 506–514 . doi : 10.1038/nrgastro.2014.66 . hdl : 2164/4189 . PMID 24912386.
- ^ Rijkers, Ger T; De Vos, Willem M; Brummer, Robert-Jan; Morelli, Lorenzo; Corthier, Gerard; Marteau, Philippe (2011). «Польза для здоровья и заявления о пользе пробиотиков для здоровья: объединение науки и маркетинга». British Journal of Nutrition . 106 (9): 1291– 1296. doi : 10.1017/S000711451100287X . PMID 21861940.
- ^ Хаткинс, Роберт В.; Крамбек, Янина А.; Бинделс, Лор Б.; Кани, Патрис Д.; Фэйи, Джордж; Го, Йонг Джун; Хамакер, Брюс; Мартенс, Эрик С.; Миллс, Дэвид А.; Растал, Роберт А.; Воган, Элейн; Сандерс, Мэри Эллен (2016). «Пребиотики: почему определения имеют значение». Current Opinion in Biotechnology . 37 : 1– 7. doi :10.1016/j.copbio.2015.09.001. PMC 4744122. PMID 26431716 .
- ^ Pandey, Kavita. R; Naik, Suresh. R; Vakil, Babu. V (2015). «Пробиотики, пребиотики и синбиотики — обзор». Журнал пищевой науки и технологии . 52 (12): 7577– 7587. doi :10.1007/s13197-015-1921-1. PMC 4648921. PMID 26604335 .
- ^ Broeckx, Géraldine; Vandenheuvel, Dieter; Claes, Ingmar JJ; Lebeer, Sarah; Kiekens, Filip (2016). «Методы сушки пробиотических бактерий как важный шаг на пути к разработке новых фармабиотиков» (PDF) . International Journal of Pharmaceutics . 505 ( 1– 2): 303–318 . doi :10.1016/j.ijpharm.2016.04.002. hdl : 10067/1328840151162165141 . PMID 27050865.
- ^ Sleator, Roy D; Hill, Colin (2009). «Рациональный дизайн улучшенных фармабиотиков». Журнал биомедицины и биотехнологии . 2009 : 275287. doi : 10.1155/2009/275287 . PMC 2742647. PMID 19753318 .
- ^ Паттерсон, Элейн; Крайан, Джон Ф; Фицджеральд, Джеральд Ф; Росс, Р. Пол; Динан, Тимоти Г; Стэнтон, Кэтрин (2014). «Микробиота кишечника, фармабиотики, которые они производят, и здоровье хозяина». Труды Общества по вопросам питания . 73 (4): 477– 489. doi : 10.1017/S0029665114001426 . PMID 25196939.
- ^ «Безрецептурные средства для лечения СРК: где мы находимся?». 30 января 2024 г.
- ^ Гуандалини, Стефано; Магаццо, Джузеппе; Кьяро, Андреа; Ла Балестра, Валерия; Ди Нардо, Джованни; Гопалан, Сарат; Сибал, А; Романо, Клаудио; Канани, Роберто Берни; Лионетти, Паоло; Сетти, Мала (июль 2010 г.). «VSL № 3 улучшает симптомы у детей с синдромом раздраженного кишечника: многоцентровое рандомизированное плацебо-контролируемое двойное слепое перекрестное исследование». Журнал детской гастроэнтерологии и питания . 51 (1): 24–30 . doi :10.1097/MPG.0b013e3181ca4d95. ПМИД 20453678.
- ^ Крусилла, Сальваторе; Калдарт, Федерико; Мишелон, Марко; Мараско, Джованни; Константино, Андреа (14 августа 2024 г.). «Функциональное вздутие живота и микробиота кишечника: обновление». Микроорганизмы . 12 (8): 1669. doi : 10.3390/microorganisms12081669 . ПМЦ 11357468 . ПМИД 39203511.
- ^ Ford, Alexander C; Quigley, Eamonn MM; Lacy, Brian E; Lembo, Anthony J; Saito, Yuri A; Schiller, Lawrence R; Soffer, Edy E; Spiegel, Brennan MR; Moayyedi, Paul (2014). «Эффективность пребиотиков, пробиотиков и синбиотиков при синдроме раздраженного кишечника и хроническом идиопатическом запоре: систематический обзор и метаанализ». Американский журнал гастроэнтерологии . 109 (10): 1547– 1561, тест 1546, 1562. doi :10.1038/ajg.2014.202. PMID 25070051.
- ^ Дюпон, Эндрю; Ричардс; Джелинек, Кэтрин А.; Крилл, Джозеф; Рахими, Эрик; Гури, Йезаз (2014). «Систематический обзор рандомизированных контролируемых испытаний пробиотиков, пребиотиков и синбиотиков при воспалительных заболеваниях кишечника». Клиническая и экспериментальная гастроэнтерология . 7 : 473–487 . doi : 10.2147/CEG.S27530 . PMC 4266241. PMID 25525379 .
- ^ Ю, Чэн Гун; Хуан, Цинь (2013). «Последние достижения в изучении роли микробиоты кишечника в патогенезе воспалительных заболеваний кишечника». Журнал пищеварительных заболеваний . 14 (10): 513–517 . doi : 10.1111/1751-2980.12087 . PMID 23848393.
- ^ Левитт, Майкл Д.; Дуэйн, Уильям К. (4 мая 1972 г.). «Плавающий стул — вздутие живота против жира». New England Journal of Medicine . 286 (18): 973– 975. doi :10.1056/NEJM197205042861804. PMID 5015442.
- ^ Aalam, Syed Mohammed Musheer; Crasta, Daphne Norma; Roy, Pooja; Miller, A. Lee; Gamb, Scott I.; Johnson, Stephen; Till, Lisa M.; Chen, Jun; Kashyap, Purna; Kannan, Nagarajan (27 октября 2022 г.). «Генезис фекальной флотации причинно связан с микробной колонизацией кишечника у мышей». Scientific Reports . 12 (1): 18109. Bibcode :2022NatSR..1218109A. doi :10.1038/s41598-022-22626-x. PMC 9613883 . PMID 36302811.
- ^ Майер, Лиза; Прутяну, Михаэла; Кун, Михаэль; Целлер, Георг; Тельцеров, Аня; Андерсон, Эксен Эрин; Брочадо, Ана Рита; Фернандес, Кит Конрад; Дозе, Хитоми; Мори, Хиротада; Патил, Киран Раосахеб; Борк, Пир; Типас, Атанасиос (2018). «Обширное воздействие неантибиотических препаратов на кишечные бактерии человека». Nature . 555 (7698): 623– 628. Bibcode :2018Natur.555..623M. doi :10.1038/nature25979. PMC 6108420 . PMID 29555994.
- ^ ab Камбодж, Амрит К.; Коттер, Томас Г.; Оксентенко, Эми С. (апрель 2017 г.). «Helicobacter pylori». Труды клиники Майо . 92 (4): 599– 604. doi : 10.1016/j.mayocp.2016.11.017. PMID 28209367.
- ^ abc "Язвенная болезнь" (PDF) . Медицинская школа Университета Джонса Хопкинса. 2013 . Получено 21 октября 2020 .
- ^ Буриш, Йохан; Джесс, Тайн; Мартинато, Маттео; Лакатос, Питер Л. (2013). «Бремя воспалительных заболеваний кишечника в Европе». Журнал болезни Крона и колита . 7 ( 4): 322–337 . doi : 10.1016/j.crohns.2013.01.010 . PMID 23395397.
- ^ Бландино, Дж; Интурри, Р; Лаззара, Ф; Ди Роза, М; Малагуарнера, Л. (2016). «Влияние микробиоты кишечника на сахарный диабет». Диабет и обмен веществ . 42 (5): 303–315 . doi :10.1016/j.diabet.2016.04.004. ПМИД 27179626.
- ^ abc Буланже, Клэр Л.; Невес, Ана Луиза; Шийу, Жюльен; Николсон, Джереми К.; Дюма, Марк-Эммануэль (2016). «Влияние микробиоты кишечника на воспаление, ожирение и метаболические заболевания». Genome Medicine . 8 (1): 42. doi : 10.1186/s13073-016-0303-2 . PMC 4839080 . PMID 27098727.
- ^ abc Arrieta, Marie-Claire; Stiemsma, Leah T; Dimitriu, Pedro A; Thorson, Lisa; Russell, Shannon; Yurist-Doutsch, Sophie; Kuzeljevic, Boris; Gold, Matthew J; Britton, Heidi M; Lefebvre, Diana L; Subbarao, Padmaja; Mandhane, Piush; Becker, Allan; McNagny, Kelly M; Sears, Malcolm R; Kollmann, Tobias; Mohn, William W; Turvey, Stuart E; Brett Finlay, B (2015). "Ранние микробные и метаболические изменения в младенчестве влияют на риск детской астмы". Science Translational Medicine . 7 (307): 307ra152. doi : 10.1126/scitranslmed.aab2271 . PMID 26424567.
- ^ ab Стимсма, Лия Т; Терви, Стюарт Э. (2017). «Астма и микробиом: определение критического окна в раннем возрасте». Аллергия, астма и клиническая иммунология . 13 : 3. doi : 10.1186/s13223-016-0173-6 . PMC 5217603. PMID 28077947 .
- ^ Ipci, Kagan; Altıntoprak, Niyazi; Muluk, Nuray Bayar; Senturk, Mehmet; Cingi, Cemal (2016). «Возможные механизмы человеческого микробиома при аллергических заболеваниях». European Archives of Oto-Rhino-Laryngology . 274 (2): 617– 626. doi :10.1007/s00405-016-4058-6. PMID 27115907.
- ^ Мариньо, Элиана; Ричардс, Джеймс Л; Маклеод, Кейран Х; Стэнли, Драгана; Яп, Ю Энн; Найт, Хасинта; Маккензи, Крейг; Кранич, Ян; Оливейра, Ана Каролина; Росселло, Фернандо Дж; Кришнамурти, Баласубраманиан; Нефцгер, Кристиан М; Масия, Лоренс; Торберн, Элисон; Бакстер, Алан Г; Морахан, Грант; Вонг, Ли Х; Поло, Хосе М; Мур, Роберт Дж; Локетт, Тревор Дж; Кларк, Джули М; Топпинг, Дэвид Л; Харрисон, Леонард К; Маккей, Чарльз Р (май 2017 г.). «Микробные метаболиты кишечника ограничивают частоту аутоиммунных Т-клеток и защищают от диабета 1 типа». Nature Immunology . 18 (5): 552–562 . doi :10.1038/ni.3713. ПМИД 28346408.
- ^ Беттелли, Эстель; Кэрриер, Ицзюнь; Гао, Венда; Корн, Томас; Стром, Терри Б.; Оукка, Мохамед; Вайнер, Говард Л.; Кучру, Виджай К. (май 2006 г.). «Взаимные пути развития для генерации патогенных эффекторных TH17 и регуляторных Т-клеток». Nature . 441 (7090): 235– 238. doi :10.1038/nature04753. PMID 16648838.
- ^ аб Земанн, Маркус Д.; Бёмиг, Георг А.; Остеррайхер, Кристоф Х.; Бурчер, Гельмут; Паролини, Орнелла; Диакос, Христос; Штёкль, Йоханнес; Хёрль, Вальтер Х.; Злабингер, Герхард Дж. (декабрь 2000 г.). «Противовоспалительное действие бутирата натрия на моноциты человека: мощное ингибирование IL-12 и усиление выработки IL-10». Журнал ФАСЭБ . 14 (15): 2380–2382 . doi : 10.1096/fj.00-0359fje . ПМИД 11024006.
- ^ Гао, З.; Инь, Дж.; Чжан, Дж.; Уорд, Р. Э.; Мартин, Р. Дж.; Лефевр, М.; Чефалу, В. Т.; Йе, Дж. (2009). «Бутират улучшает чувствительность к инсулину и увеличивает расход энергии у мышей». Диабет . 58 (7): 1509– 1517. doi :10.2337/db08-1637. PMC 2699871. PMID 19366864 .
- ^ Мазиди, Мохсен; Резаи, Пейман; Кенгне, Андре Паскаль; Мобархан, Маджид Гайур; Фернс, Гордон А. (2016). «Микробиом кишечника и метаболический синдром». Диабет и метаболический синдром: клинические исследования и обзоры . 10 (2): S150–157. doi :10.1016/j.dsx.2016.01.024. PMID 26916014.
- ^ Чен, Сяо; д'Соуза, Рошан; Хонг, Сон-Цхул (2013). «Роль микробиоты кишечника в оси кишечник-мозг: текущие проблемы и перспективы». Protein & Cell . 4 (6): 403– 414. doi :10.1007/s13238-013-3017-x. PMC 4875553. PMID 23686721 .
- ^ ab Moeller, Andrew H.; Li, Yingying; Mpoudi Ngole, Eitel; Ahuka-Mundeke, Steve; Lonsdorf, Elizabeth V.; Pusey, Anne E.; Peeters, Martine; Hahn, Beatrice H.; Ochman, Howard (18 ноября 2014 г.). «Быстрые изменения в микробиоме кишечника в ходе эволюции человека». Труды Национальной академии наук . 111 (46): 16431– 16435. Bibcode : 2014PNAS..11116431M. doi : 10.1073/pnas.1419136111 . PMC 4246287. PMID 25368157 .
- ^ Brune, A. (2014). «Симбиотическое переваривание лигноцеллюлозы в кишечнике термитов». Nature Reviews Microbiology . 12 (3): 168– 180. doi :10.1038/nrmicro3182. PMID 24487819.
- ^ Розенгаус, Ребека Б.; Зехер, Кортни Н.; Шультайс, Келли Ф.; Брукер, Роберт М.; Борденштейн, Сет Р. (июль 2011 г.). «Нарушение микробиоты кишечника термитов и его долгосрочные последствия для приспособленности». Прикладная и экологическая микробиология . 77 (13): 4303– 4312. Bibcode : 2011ApEnM..77.4303R. doi : 10.1128/AEM.01886-10. PMC 3127728. PMID 21571887.
- ^ ab Ashbrook, Aaron R; Schwarz, Melbert; Schal, Coby; Mikaelyan, Aram (14 октября 2024 г.). «Смертельное нарушение бактериального сообщества кишечника у восточных подземных термитов, вызванное борной кислотой». Журнал экономической энтомологии . doi : 10.1093/jee/toae221 . PMC 11682946 . PMID 39401329.
- ^ ab Dietrich, C.; Köhler, T.; Brune, A. (2014). «Происхождение микробиоты кишечника термитов от тараканов: закономерности в структуре бактериального сообщества отражают основные эволюционные события». Applied and Environmental Microbiology . 80 (7): 2261– 2269. Bibcode :2014ApEnM..80.2261D. doi :10.1128/AEM.04206-13. PMC 3993134 . PMID 24487532.
- ^ ab Микаэлян, А.; Дитрих, К.; Кёлер, Т.; Поульсен, М.; Силлам-Дюссе, Д.; Брюн, А. (2015). «Диета является основным фактором, определяющим структуру бактериального сообщества в кишечнике высших термитов». Молекулярная экология . 24 (20): 5824–5895 . Bibcode : 2015MolEc..24.5284M. doi : 10.1111/mec.13376. PMID 26348261.
- ^ Микаэлян, А.; Томпсон, К.; Хофер, М.; Брюн, А. (2016). «Детерминированная сборка сложных бактериальных сообществ в кишечнике тараканов, свободных от микробов». Прикладная и экологическая микробиология . 82 (4): 1256– 1263. doi :10.1128/AEM.03700-15. PMC 4751828. PMID 26655763 .
Дальнейшее чтение
- Обзорные статьи
- Де Претер, Вики; Хамер, Хенрике М; Винди, Карен; Вербеке, Кристин (2011). «Влияние пре- и/или пробиотиков на метаболизм толстой кишки человека: влияет ли это на здоровье человека?». Молекулярное питание и исследования продуктов питания . 55 (1): 46– 57. doi :10.1002/mnfr.201000451. PMID 21207512.
- Марандуба, Карлос Маньо да Коста; Де Кастро, Сандра Бертелли Рибейро; Соуза, Густаво Торрес де; Россато, Криштиану; Да Гиа, Франсиско Карлос; Валенте, Мария Анете Сантана; Ретторе, Жоау Витор Паес; Марандуба, Клаудинея Перейра; Соуза, Камила Маурманн де; Карму, Антонио Марсио Ресенде; МакЭдо, Гилсон Коста; Сильва, Фернандо де Са (2015). «Кишечная микробиота как модуляторы иммунной и нейроиммунной систем: влияние на здоровье хозяина и гомеостаз». Журнал иммунологических исследований . 2015 : 931574. doi : 10.1155/2015/931574 . ПМЦ 4352473 . PMID 25759850.
- Пракаш, Сатья; Родес, Летиция; Кусса-Чарли, Майкл; Томаро-Дюшесно, Кэтрин; Томаро-Дюшесно, Кэтрин; Кусса-Чарли; Родес (2011). «Микробиота кишечника: следующий рубеж в понимании здоровья человека и разработке биотерапевтических средств». Биологические препараты: мишени и терапия . 5 : 71–86 . doi : 10.2147/BTT.S19099 . PMC 3156250. PMID 21847343 .
- Wu, GD; Chen, J.; Hoffmann, C.; Bittinger, K.; Chen, Y.-Y.; Keilbaugh, SA; Bewtra, M.; Knights, D.; Walters, WA; Knight, R.; Sinha, R.; Gilroy, E.; Gupta, K.; Baldassano, R.; Nessel, L.; Li, H.; Bushman, FD; Lewis, JD (2011). «Связь долгосрочных диетических схем с кишечными микробными энтеротипами». Science . 334 (6052): 105– 108. Bibcode :2011Sci...334..105W. doi :10.1126/science.1208344. PMC 3368382 . PMID 21885731.

