Положительный аллостерический модулятор ГАМКА-рецептора
В фармакологии положительные аллостерические модуляторы рецептора ГАМК А , также известные как ГАМКины или потенциаторы рецептора ГАМК А , [1] представляют собой молекулы положительных аллостерических модуляторов (ПАМ) , которые повышают активность белка рецептора ГАМК А в центральной нервной системе позвоночных .
ГАМК является основным тормозным нейротрансмиттером в центральной нервной системе. При связывании он запускает рецептор ГАМК А , чтобы открыть его хлоридный канал , чтобы позволить ионам хлора проникнуть в нейрон , делая клетку гиперполяризованной и менее склонной к возбуждению . ГАМК А ПАМ усиливают эффект ГАМК, делая канал открытым чаще или на более длительные периоды. Однако они не оказывают никакого эффекта, если ГАМК или другой агонист отсутствуют.
В отличие от агонистов рецептора ГАМК А , ПАМ ГАМК А не связываются с тем же активным сайтом, что и молекула нейротрансмиттера γ-аминомасляной кислоты (ГАМК) : они воздействуют на рецептор, связываясь с другим сайтом на белке. Это называется аллостерической модуляцией .
В психофармакологии ПАМ ГАМК А -рецептора, используемые в качестве лекарств, в основном оказывают седативное и анксиолитическое действие. Примерами ПАМ ГАМК А являются этанол , бензодиазепины, такие как диазепам (валиум) и алпразолам (ксанакс) , Z-препараты, такие как золпидем (амбиен), и барбитураты .
История
Рецепторы ГАМК А исторически были целью исследований в области лечения наркомании. Самые ранние соединения были ионными соединениями, такими как бромид .
Барбитураты
В 1903 году было синтезировано и выпущено на рынок первое психоактивное производное барбитуровой кислоты для лечения головных болей. В течение 30 лет было разработано множество других барбитуратов , которые нашли применение в качестве седативных средств , снотворных и общих анестетиков . Хотя барбитураты вышли из моды, они продолжают служить в качестве короткодействующих анестетиков и противоэпилептических препаратов.
Бензодиазепины
Бензодиазепины были открыты в 1955 году и в значительной степени заменили барбитураты из-за их большего терапевтического индекса . [2] Сначала бензодиазепины считались безопасными и эффективными слабыми транквилизаторами , но затем подверглись критике за их эффекты, вызывающие зависимость . Несколько эффективных бензодиазепинов предлагают выбор относительно лекарственной формы , продолжительности действия, метаболического взаимодействия и безопасности.
Бензодиазепины функционируют путем связывания с бензодиазепиновым сайтом на большинстве, но не на всех, рецепторах ГАМК А. Модуляция ГАМК А агонистами бензодиазепинового сайта является самоограничивающейся. Проводимость канала не выше в присутствии бензодиазепина и ГАМК, чем проводимость в присутствии только высоких концентраций ГАМК. Кроме того, в отсутствие ГАМК присутствие одних только бензодиазепинов не открывает хлоридный канал. [3]
Нейростероиды
Некоторые метаболиты прогестерона и дезоксикортикостерона являются мощными и селективными положительными аллостерическими модуляторами рецептора γ-аминомасляной кислоты типа А (ГАМК А ). [4] Ганс Селье продемонстрировал в 1940 году, что некоторые прегнановые стероиды могут вызывать как анестезию, так и седацию , [5] но 40 лет спустя появился молекулярный механизм, объясняющий их депрессивное действие. В препарате среза мозга крысы синтетический стероидный анестетик альфаксалон (5α-прегнан-3α-ол-11,20 дион) усиливал как вызванное стимулом торможение, так и эффекты экзогенно применяемого мусцимола , который является селективным агонистом ГАМК А . [6]
Рецептор
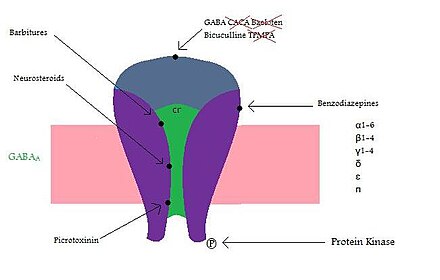
Рецепторы ГАМК А состоят из субъединиц, которые образуют рецепторный комплекс. У людей имеется 19 субъединиц рецепторов, которые классифицируются как α (1–6), β (1–3), γ (1–3), δ, ε, π, θ и ρ (1–3). Функция рецептора различается в зависимости от того, как составлен пентамерный комплекс. Наиболее распространенным комплексом, который включает около 40% рецепторов ГАМК А, является комбинация α1β2γ2. Экспрессия субъединиц может сильно различаться в зависимости от области мозга. [7] Комбинация субъединиц влияет на то, как действует рецептор. Например, если субъединицы α1 и β2 экспрессируются вместе, они имеют высокую чувствительность к ГАМК, но низкую проводимость канала . Но если γ2 экспрессируется с α1 и β2, чувствительность низкая, а проводимость канала высокая. [8] Для высокоаффинного связывания бензодиазепина должна присутствовать субъединица γ2. Мало что известно о том, где в мозге расположены различные комплексы, что затрудняет открытие лекарств. [7] Например, место связывания нейростероидов в рецепторе ГАМК А неизвестно [9] , а барбитураты связываются с бета-субъединицей, которая отличается от места связывания бензодиазепина.
Доступные агенты
- Хлоралгидрат (и родственные трихлорэтанольные пролекарства)
- Барбитураты (например, барбитал , фенобарбитал , пентобарбитал , тиопентал , фотопереключаемый DASA-барбитал [10] )
- Бензодиазепины
- Небензодиазепины (например, залеплон , золпидем , зопиклон )
- Ингаляционные анестетики (например, диэтиловый эфир , галотан , изофлуран )
- Этомидат
- Пропофол
- Нейростероиды (например, брексанолон , зуранолон , альфаксалон (ветеринарные))
- Кавалактоны
- этанол
- Абекарнил [11]
- Азокарнил [12] ( фотопереключаемый )
- Калейцин (как предполагаемый пролекарство в Calea ternifolia )
- Седативные средства хиназолинонового ряда ( метаквалон )
Приложения
Барбитураты
Точные места действия барбитуратов пока не определены. Второй и третий трансмембранные домены β-субъединицы, по-видимому, имеют решающее значение; связывание может включать карман, образованный β-субъединицей метионина 286, а также α-субъединицей метионина 236. [13]
Бессонница
Барбитураты были введены в качестве снотворных для пациентов с шизофренией . Они вызывали состояние глубокого и продолжительного сна. Но это не использовалось долго из-за неблагоприятных побочных эффектов. [2]
Противосудорожное
Фенобарбитал был первым по-настоящему эффективным препаратом против эпилепсии. Он был открыт случайно, когда его давали пациентам с эпилепсией , чтобы помочь им уснуть. Положительными побочными эффектами были противосудорожные свойства, которые снижали количество и интенсивность приступов. [2]
Седация
Пентобарбитал используется как снотворное , когда не требуется обезболивание . Он часто используется при КТ- визуализации, когда требуется седация. Он эффективен, безопасен и время восстановления короткое. [14] В 2013 году барбитураты фенобарбитал и бутабарбитал все еще использовались в качестве седативных средств в некоторых случаях, а также для противодействия эффектам таких наркотиков, как эфедрин и теофиллин . Фенобарбитал используется в случаях синдрома отмены наркотиков. Он используется в качестве обычного и неотложного лечения в некоторых случаях эпилепсии. [2]

Бензодиазепин
Синаптическое действие бензодиазепинов: рецепторы ГАМК А , расположенные в синапсах, активируются при воздействии на них высокой концентрации ГАМК. Бензодиазепины усиливают сродство рецепторов к ГАМК, увеличивая затухание спонтанных миниатюрных тормозных постсинаптических токов (mIPSC). [15] [16]
Анальгезия
Седативные действия бензодиазепинов ограничивают их полезность в качестве анальгетиков , и поэтому они, как правило, не считаются подходящими. Это ограничение можно обойти путем интратекального введения. Рецепторы ГАМК А в периакведуктальном сером веществе являются проноцицептивными в супраспинальных участках, в то время как ГАМК А , которые находятся в спинном мозге, являются антигипералгезическими. Спинальные α2 и α3, содержащие ГАМК А, отвечают за антигипералгезическое действие интратекального диазепама . Это было показано, когда антигипералгезическое действие было снижено при введении мышам α2 и α3 при воспалительной боли и при невропатической боли. Кроме того, исследования на мышах α5 показали, что спинальный α5-содержащий ГАМК А рецептор играет незначительную роль в воспалительной боли. Селективный положительный аллостерический агонист α2, α3 и/или α5, например, такой как L-838,417 , может быть полезен в качестве анальгетика против воспалительной или нейропатической боли. [3] Дальнейшие исследования на моделях нейропатической боли у животных показали, что стабилизация котранспортера хлорида калия 2 ( KCC2 ) на нейрональных мембранах может не только усилить анальгезию, вызванную L-838,417 , но и спасти его анальгетический потенциал в высоких дозах, открывая новую стратегию анальгезии при патологической боли путем комбинированного нацеливания на соответствующие подтипы рецепторов ГАМК A (т. е. α 2 , α 3 ) и восстановления гомеостаза Cl − . [17]
Шизофрения
Бензодиазепины используются в качестве поддерживающей терапии у пациентов с шизофренией . [3]
депрессия
Была предложена ГАМКергическая гипотеза депрессии, которая ставит систему ГАМК в центральную роль в патофизиологии депрессии . Клинические исследования показали, что алпразолам и адиназолам обладают антидепрессивной активностью у пациентов с большим депрессивным расстройством. К сожалению, неизвестно, какой подтип рецептора отвечает за антидепрессивную активность .
Исследования на мышах с нокаутом y2 показали, что они демонстрируют повышенную тревожность и симптомы, похожие на депрессию, в тестах на отчаяние. У мышей также была повышена концентрация кортикостерона , что является симптомом большой депрессии у людей. Субъединица y2 связана с субъединицами α1-α6, которые все являются известными субъединицами α, поэтому эти исследования не показывают, какие из субъединиц α связаны с симптомами, похожими на депрессию. Другие исследования с мышами с нокаутом α2 показали повышенную тревожность и симптомы, похожие на депрессию, в тестах на питание, основанных на конфликте. Тот факт, что тревожность и депрессия часто связаны, по-видимому, указывает на то, что субъединица α2 может быть допустимой целью для антидепрессанта ГАМК А. [3]
Гладить
Доклинические исследования показали, что бензодиазепины могут быть эффективны в снижении последствий инсультов в течение трех дней после приема препарата. [3]
Нейростероиды
Нейростероиды могут действовать как аллостерические модуляторы рецепторов нейротрансмиттеров, таких как ГАМК А , [18] [19] [20] [21] NMDA , [22] и сигма-рецепторы . [23] Нейростероид прогестерон (PROG), который активирует рецепторы прогестерона, экспрессируемые в периферических и центральных глиальных клетках. [24] [25] [26] [27] Кроме того, было высказано предположение, что прегнановые стероиды с восстановленным 3α-гидроксикольцом А аллопрегнанолон и тетрагидродезоксикортикостерон увеличивают ГАМК -опосредованные токи хлора, в то время как прегненолона сульфат и дегидроэпиандростерона (ДГЭА) сульфат, с другой стороны, проявляют антагонистические свойства в отношении рецепторов ГАМК А .
Синтез
Барбитуровая кислота
Барбитуровая кислота является исходным соединением барбитуратов, хотя сама барбитуровая кислота фармакологически не активна. Барбитураты были синтезированы в 1864 году Адольфом фон Байером путем объединения мочевины и малоновой кислоты (рисунок 5). Процесс синтеза был позже разработан и усовершенствован французским химиком Эдуардом Гримо в 1879 году, что сделало возможным последующее широкое развитие производных барбитуратов. [28] Позднее малоновая кислота была заменена диэтилмалонатом , поскольку использование эфира позволяет избежать необходимости иметь дело с кислотностью карбоновой кислоты и ее нереакционноспособного карбоксилата (см. рисунок 6). Барбитуровая кислота может образовывать большое разнообразие барбитуратов с помощью реакции конденсации Кневенагеля . [29]

Бензодиазепины
Структура, на которой основан первый бензодиазепин, была открыта Лео Х. Штернбахом . Он думал, что соединение имеет структуру гептоксдиазина (рисунок 7), но позже было установлено, что это хиназолин-3-оксид. Возможные кандидаты на лекарственные препараты затем были синтезированы из этого соединения и проверены на активность. Одно из этих соединений было активным, хлордиазепоксид . Он был выпущен на рынок в 1960 году и стал первым бензодиазепиновым препаратом. [30]
Биосинтез нейростероидов
Нейростероиды синтезируются в центральной нервной системе (ЦНС) и периферической нервной системе (ПНС) из холестерина и стероидных предшественников, которые импортируются из периферических источников. Эти источники включают производные 3β-гидрокси-Δ5, такие как прегненолон (PREG) и дегидроэпиандростерон (DHEA), их сульфаты и восстановленные метаболиты, такие как тетрагидропроизводное прогестерона 3α-гидрокси-5α-прегнан-20-он (3α,5α-THPROG). После локального синтеза или из метаболизма надпочечниковых гонадных стероидов многие нейростероиды накапливаются в мозге. [31] [32]
Связь структуры и активности
Барбитураты

Барбитураты имеют специальные применения и организованы в 4 класса: ультракороткого, короткого, среднего и длительного действия. Эмпирически SAR барбитурантов основаны на тысячах (животных) испытанных соединений. Они показали, что R и R´ могут не быть H в положении 5 (см. рисунок 8). Кроме того, положение 5 придает седативно-снотворные свойства. [14] Обычно алкильное разветвление в положении 5 означает меньшую растворимость в липидах и меньшую активность. Ненасыщенность показывает меньшую активность в положении 5, а алициклические и ароматические кольца показывают меньшую силу. Полярные заместители (-NH 2 , -OH, -COOH) уменьшат растворимость в липидах, но также устранят активность. R´´ в положении 1 обычно является H, но CH 3 в этом положении дает меньшую растворимость в липидах и продолжительность действия. Замена атома S на O в положении 2 дает тиобарбитураты, которые более растворимы в липидах, чем оксибарбитураты. В целом, чем более липидорастворим барбитурат, тем быстрее его начало, тем короче его продолжительность и тем выше степень снотворной активности. Барбитураты показали некоторые гидролитические проблемы в отношении формулирования жидких лекарственных форм. Трудность заключается в катализируемой -ОН деградации уреидных колец , но это можно исправить, если pH в формуле равен 6. S(-) форма барбитурата показала большую депрессантную активность, в то время как R(+) изомеры оказывают возбуждающее действие. [33]
Бензодиазепины

Согласно исследованию, проведенному Маддаленой и соавторами с использованием искусственных нейронных сетей , позиция 7 оказывает наибольшее влияние на сродство рецептора . Когда активная группа в позиции 7 становится более липофильной , а электронный заряд увеличивается, сродство рецептора увеличивается. В том же исследовании было обнаружено, что позиция 2´ является второй по важности в воздействии на сродство, но группа в этой позиции должна быть электрофильной , чтобы иметь эффект. Позиции 3, 6' и 8 имеют меньшее значение. [34] Изменения в 6, 8, 9 или 4´ снижают активность. Если группа в позиции 1 изменяется на N-алкил, галогеналкил, алкинил и малый цикл или аминоалкил, активность увеличивается. Гидроксилирование позиции 3 может вызвать быструю конъюгацию и уменьшить продолжительность и силу, что может быть клинически полезным. [34]

Нейростероиды
В середине 1980-х годов было показано, что нейроактивные стероиды 3α,5α-тетрагидропрогестерон или аллопрегнанолон (3α,5α-THP) и 3α,5α- тетрагидродезоксикортикостерон (3α,5α-THDOC) модулируют нейрональную возбудимость посредством взаимодействия с рецепторами ГАМК А. Стероиды 3α,5α-THP и 3α,5α-THDOC способны усиливать вызванный ГАМК ток Cl − [18] Кроме того, эти стероиды могут усиливать связывание мусцимола и бензодиазепинов с рецепторами ГАМК А. [35] Исследования структуры-активности (SAR) показали, что группа 3альфа-ОН необходима для анестезирующего действия этих стероидов, [36] они также имеют оптимально расположенную группу, принимающую водородную связь на β-грани стероида в положении C-17. Четыре стероидных кольца образуют жесткую структуру для позиционирования этих водородных групп в трехмерном пространстве. [37] Аналоги 5 и 6 (рисунок 10) являются слабыми модуляторами функции рецептора ГАМК А , поскольку гибкие боковые цепи в этих аналогах не имеют конформаций, необходимых для высокой биологической активности. [38]
Смотрите также
Ссылки
- ^ Cerne R, Lippa A, Poe MM, Smith JL, Jin X, Ping X, Golani LK, Cook JM, Witkin JM (июнь 2022 г.). «GABAkines — достижения в открытии, разработке и коммерциализации положительных аллостерических модуляторов рецепторов GABAA». Pharmacol Ther . 234 : 108035. doi : 10.1016/j.pharmthera.2021.108035. PMC 9787737. PMID 34793859 .
- ^ abcd Лопес-Муньос Ф., Уча-Удабе Р., Аламо К. (декабрь 2005 г.). «История барбитуратов столетие спустя после их клинического внедрения». Нейропсихиатрические заболевания и лечение . 1 (4): 329–43 . PMC 2424120. PMID 18568113 .
- ^ abcde Rudolph U, Knoflach F (сентябрь 2011 г.). «За пределами классических бензодиазепинов: новый терапевтический потенциал подтипов рецепторов ГАМК». Nature Reviews. Drug Discovery . 10 (9): 685–97 . doi :10.1038/nrd3502. PMC 3375401. PMID 21799515.
- ^ Ламберт Дж. Дж., Белелли Д., Педен Д. Р., Варди А. В., Петерс Дж. А. (сентябрь 2003 г.). «Нейростероидная модуляция ГАМКА-рецепторов». Прогресс нейробиологии . 71 (1): 67–80 . doi :10.1016/j.pneurobio.2003.09.001. PMID 14611869. S2CID 11878482.
- ↑ Селье Х. (1 января 1941 г.). «Анестезирующее действие стероидных гормонов». Experimental Biology and Medicine . 46 (1): 116– 121. doi :10.3181/00379727-46-11907. S2CID 87160217.
- ^ Harrison NL, Simmonds MA (декабрь 1984 г.). «Модуляция комплекса рецепторов ГАМК стероидным анестетиком». Brain Research . 323 (2): 287– 92. doi :10.1016/0006-8993(84)90299-3. PMID 6098342. S2CID 43910919.
- ^ ab Egawa K, Fukuda A (2013). "Патофизиологическая сила неправильной тонической проводимости ГАМК(А) в зрелых и незрелых моделях". Frontiers in Neural Circuits . 7 : 170. doi : 10.3389 /fncir.2013.00170 . PMC 3807051. PMID 24167475.
- ^ Günther U, Benson J, Benke D, Fritschy JM, Reyes G, Knoflach F, Crestani F, Aguzzi A, Arigoni M, Lang Y (август 1995 г.). «Мыши, нечувствительные к бензодиазепинам, полученные путем целенаправленного разрушения гена субъединицы гамма-2 рецепторов гамма-аминомасляной кислоты типа A». Труды Национальной академии наук Соединенных Штатов Америки . 92 (17): 7749– 53. Bibcode : 1995PNAS...92.7749G. doi : 10.1073 /pnas.92.17.7749 . PMC 41223. PMID 7644489.
- ^ Hosie AM, Wilkins ME, Smart TG (октябрь 2007 г.). «Сайты связывания нейростероидов на рецепторах ГАМК(А)». Фармакология и терапия . 116 (1): 7– 19. doi :10.1016/j.pharmthera.2007.03.011. PMID 17560657.
- ^ Кастанья, Росселла; Малеева, Галина; Пировано, Дебора; Матера, Карло; Горостица, Пау (2022-08-31). «Донорно-акцепторный аддукт Стенхауса, демонстрирующий обратимое фотопереключение в воде и нейронной активности». Журнал Американского химического общества . 144 (34): 15595– 15602. doi :10.1021/jacs.2c04920. hdl : 2445/188733 . ISSN 0002-7863.
- ^ Одзава, Масаки; Накада, Юкиэ; Сугимати, Кейко; Ябуучи, Фуми; Акаи, Тецуо; Мизута, Эйдзи; Куно, Садако; Ямагучи, Мотонори (1 января 1994 г.). «Фармакологическая характеристика нового анксиолитика β-карболина абекарнила у грызунов и приматов». Японский журнал фармакологии . 64 (3): 179–188 . doi : 10.1254/jjp.64.179 . ISSN 0021-5198.
- ^ Малеева, Галина; Нин-Хилл, Альба; Вирт, Ульрике; Растлер, Карин; Рануччи, Маттео; Опар, Экин; Ровира, Карме; Брегестовский, Петр; Цайльхофер, Ханс Ульрих; Кениг, Буркхард; Альфонсо-Прието, «Мерседес»; Горостиза, Пау (9 октября 2024 г.). «Светоактивируемый агонист-потенциатор рецепторов ГАМК А для обратимого нейроингибирования у мышей дикого типа». Журнал Американского химического общества . doi : 10.1021/jacs.4c08446. ISSN 0002-7863. ПМЦ 11503767 .
- ^ Löscher W, Rogawski MA (декабрь 2012 г.). «Как развивались теории относительно механизма действия барбитуратов». Эпилепсия . 53 (Suppl 8): 12–25 . doi : 10.1111/epi.12025 . PMID 23205959. S2CID 4675696.
- ^ ab Moro-Sutherland DM (сентябрь 2000 г.). «Барбитураты». Клиническая детская неотложная медицина . 1 (4): 276– 280. doi :10.1016/S1522-8401(00)90040-5.
- ^ Möhler H, Fritschy JM, Rudolph U (январь 2002 г.). «Новая фармакология бензодиазепинов». Журнал фармакологии и экспериментальной терапии . 300 (1): 2– 8. doi :10.1124/jpet.300.1.2. PMID 11752090. S2CID 24519126.
- ^ Perrais D, Ropert N (январь 1999). «Влияние золпидема на миниатюрные IPSCs и занятость постсинаптических рецепторов GABAA в центральных синапсах». Журнал нейронауки . 19 (2): 578–88 . doi :10.1523/JNEUROSCI.19-02-00578.1999. PMC 6782193. PMID 9880578 .
- ^ Лоренцо Л.Е., Годин А.Г., Феррини Ф., Бачанд К., Пласенсиа-Фернандес I, Лабрек С., Жирар А.А., Будро Д., Кианика И., Ганьон М., Дойон Н., Рибейру-да-Сильва А., Де Конинк Ю. (2020). «Усиление экструзии хлорида нейронами спасает α2/α3-ГАМК-опосредованную аналгезию при нейропатической боли». Природные коммуникации . 11 (1): 869–92 . Бибкод : 2020NatCo..11..869L. дои : 10.1038/s41467-019-14154-6 . ПМК 7018745 . ПМИД 32054836.
- ^ ab Majewska MD, Harrison NL, Schwartz RD, Barker JL, Paul SM (май 1986). «Стероидные гормональные метаболиты являются барбитурат-подобными модуляторами рецептора ГАМК». Science . 232 (4753): 1004– 7. doi :10.1126/science.2422758. PMID 2422758.
- ^ Herd MB, Belelli D, Lambert JJ (октябрь 2007 г.). «Нейростероидная модуляция синаптических и внесинаптических рецепторов ГАМК(А)». Фармакология и терапия . 116 (1): 20– 34. doi :10.1016/j.pharmthera.2007.03.007. PMID 17531325.
- ^ Hosie AM, Wilkins ME, da Silva HM, Smart TG (ноябрь 2006 г.). «Эндогенные нейростероиды регулируют рецепторы ГАМК через два дискретных трансмембранных участка». Nature . 444 (7118): 486– 9. Bibcode :2006Natur.444..486H. doi :10.1038/nature05324. PMID 17108970. S2CID 4382394.
- ^ Puia G, Santi MR, Vicini S, Pritchett DB, Purdy RH, Paul SM, Seeburg PH, Costa E (май 1990). «Нейростероиды действуют на рекомбинантные человеческие рецепторы GABAA». Neuron . 4 (5): 759– 65. doi :10.1016/0896-6273(90)90202-Q. PMID 2160838. S2CID 12626366.
- ^ Wu FS, Gibbs TT, Farb DH (сентябрь 1991 г.). «Прегненолона сульфат: положительный аллостерический модулятор рецептора N-метил-D-аспартата» (аннотация) . Молекулярная фармакология . 40 (3): 333– 6. PMID 1654510.
- ^ Морис Т, Жюньен ЖЛ, Приват А (февраль 1997). «Дегидроэпиандростерон сульфат ослабляет вызванное дизоцилпином нарушение обучения у мышей через сигма 1-рецепторы». Behavioural Brain Research . 83 ( 1– 2): 159– 64. doi : 10.1016/S0166-4328(97)86061-5. PMID 9062676. S2CID 3979800.
- ^ Baulieu EE (1997). «Нейростероиды: нервной системы, нервной системой, для нервной системы». Недавний прогресс в исследовании гормонов . 52 : 1–32 . PMID 9238846.
- ^ Rupprecht R, Reul JM, Trapp T, van Steensel B, Wetzel C, Damm K, Zieglgänsberger W, Holsboer F (сентябрь 1993 г.). «Эффекты нейроактивных стероидов, опосредованные рецепторами прогестерона». Neuron . 11 (3): 523– 30. doi :10.1016/0896-6273(93)90156-L. PMID 8398145. S2CID 11205767.
- ^ Юнг-Тестас И, До Ти А, Кёниг Х, Дезарно Ф, Шазан К, Шумахер М, Болье Э. Э. (1999). «Прогестерон как нейростероид: синтез и действие в глиальных клетках крыс». Журнал стероидной биохимии и молекулярной биологии . 69 ( 1– 6): 97– 107. doi :10.1016/S0960-0760(98)00149-6. PMID 10418983. S2CID 10662223.
- ^ Белелли Д., Ламберт Дж. Дж. (июль 2005 г.). «Нейростероиды: эндогенные регуляторы рецептора ГАМК(А)». Nature Reviews. Neuroscience . 6 (7): 565–75 . doi :10.1038/nrn1703. PMID 15959466. S2CID 12596378.
- ^ Картер, МК (1951). «История барбитуровой кислоты». J Chem Educ . 28 (10): 525– 8. Bibcode :1951JChEd..28..524C. doi :10.1021/ed028p524.
- ^ Deb ML, Bhuyan, Pulak J. (сентябрь 2005 г.). «Некатализируемая конденсация Кнёвенагеля в водной среде при комнатной температуре». Tetrahedron Letters . 46 (38): 6453– 6456. doi :10.1016/j.tetlet.2005.07.111.
- ^ Грингауз А (1997). Лекарственная химия. Как действуют лекарства и почему . Соединенные Штаты Америки: WILEY-VCH. С. 578– 579. ISBN 0-471-18545-0.
- ^ Agís-Balboa RC, Pinna G, Zhubi A, Maloku E, Veldic M, Costa E, Guidotti A (сентябрь 2006 г.). «Характеристика нейронов мозга, экспрессирующих ферменты, опосредующие биосинтез нейростероидов». Труды Национальной академии наук Соединенных Штатов Америки . 103 (39): 14602– 7. Bibcode : 2006PNAS..10314602A. doi : 10.1073/pnas.0606544103 . PMC 1600006. PMID 16984997 .
- ^ Mellon SH, Griffin LD (2002). «Нейростероиды: биохимия и клиническое значение». Тенденции в эндокринологии и метаболизме . 13 (1): 35– 43. doi :10.1016/S1043-2760(01)00503-3. PMID 11750861. S2CID 11605131.
- ^ Грингауз А (1997). Лекарственная химия. Как действуют лекарства и почему . Соединенные Штаты Америки: Wiley-VCH. С. 572– 574. ISBN 0-471-18545-0.
- ^ ab Maddalena DJ, Johnston GA (февраль 1995). «Прогнозирование свойств рецепторов и связывающей способности лигандов с рецепторами бензодиазепина/ГАМКA с использованием искусственных нейронных сетей». Журнал медицинской химии . 38 (4): 715–24 . doi :10.1021/jm00004a017. PMID 7861419.
- ^ Paul SM, Purdy RH (март 1992). «Нейроактивные стероиды». FASEB Journal . 6 (6): 2311– 22. doi : 10.1096/fasebj.6.6.1347506 . PMID 1347506. S2CID 221753076.
- ^ Covey DF, Han M, Kumar AS, de La Cruz MA, Meadows ES, Hu Y, Tonnies A, Nathan D, Coleman M, Benz A, Evers AS, Zorumski CF, Mennerick S (август 2000 г.). «Аналоги нейростероидов. 8. Исследования структуры и активности N-ацилированных 17a-aza-D-гомостероидных аналогов анестезирующих стероидов (3альфа, 5альфа)- и (3альфа,5бета)-3-гидроксипрегнан-20-она». Журнал медицинской химии . 43 (17): 3201– 4. doi :10.1021/jm0002477. PMID 10966737.
- ^ Covey DF, Evers AS, Mennerick S, Zorumski CF, Purdy RH (ноябрь 2001 г.). «Последние разработки в области взаимосвязей структуры и активности для стероидных модуляторов рецепторов ГАМК(А)». Исследования мозга. Обзоры исследований мозга . 37 ( 1–3 ): 91–7 . doi :10.1016/S0165-0173(01)00126-6. PMID 11744077. S2CID 35297361.
- ^ Кови Д.Ф., Ху Ю., Були М.Г., Холланд К.Д., Роджерс-Ним Н.Т., Изенберг К.Е., Зорумски К.Ф. (март 1993 г.). «Модуляция функции рецептора ГАМКА бенз[е]инденами и фенантренами». Журнал медицинской химии . 36 (5): 627–30 . doi : 10.1021/jm00057a012. ПМИД 8388475.
Дальнейшее чтение
- Faizi M, Dabirian S, Tajali H, Ahmadi F, Zavareh ER, Shahhosseini S, Tabatabai SA (февраль 2015 г.). «Новые агонисты бензодиазепиновых рецепторов: дизайн, синтез, анализ связывания и фармакологическая оценка производных 1,2,4-триазоло[1,5-a]пиримидинона и 3-амино-1,2,4-триазола». Bioorganic & Medicinal Chemistry . 23 (3): 480– 7. doi :10.1016/j.bmc.2014.12.016. PMID 25564376.