Флюоксиместерон
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Халотестин, Ора-Тестрил, Ультандрен и другие |
| Другие имена | Флюоксиместрон; Андрофлуорен; NSC-12165; 9α-фтор-11β-гидрокси-17α-метилтестостерон; 9α-фтор-17α-метиландрост-4-ен-11β,17β-диол-3-он |
| AHFS / Drugs.com | Монография |
| МедлайнПлюс | а682690 |
Категория беременности |
|
| Пути введения | Через рот [1] |
| Класс наркотиков | Андроген ; Анаболический стероид |
| код АТС |
|
| Правовой статус | |
| Правовой статус |
|
| Фармакокинетические данные | |
| Биодоступность | Перорально : 80% [3] |
| Метаболизм | Печень (6β- гидроксилирование , 5α- и 5β-восстановление , 3α- и 3β-кетоокисление , 11β-гидроксиокисление ) [4] |
| Метаболиты | • 5α-дигидрофлуоксиместерон [4] • 11-оксофлуоксиместерон [4] |
| Период полувыведения | 9,2 часа [5] [6] |
| Выделение | Моча (<5% без изменений) [3] [4] |
| Идентификаторы | |
| |
| Номер CAS | |
| CID PubChem |
|
| ИУФАР/БПС |
|
| DrugBank | |
| ChemSpider | |
| УНИИ |
|
| КЕГГ | |
| ЧЭБИ | |
| ChEMBL | |
| Панель инструментов CompTox ( EPA ) |
|
| Информационная карта ECHA | 100.000.875 |
| Химические и физические данные | |
| Формула | С20Н29ФО3 |
| Молярная масса | 336,447 г·моль −1 |
| 3D модель ( JSmol ) |
|
| |
| (проверять) | |
Флюоксиместерон , продаваемый под торговыми марками Халотестин и Ультандрен , среди прочих, является андрогенным и анаболическим стероидным (ААС) препаратом, который используется для лечения низкого уровня тестостерона у мужчин, задержки полового созревания у мальчиков, рака молочной железы у женщин и анемии . [1] Он принимается внутрь . [1]
Побочные эффекты флюоксиместерона включают симптомы маскулинизации , такие как акне , усиленный рост волос , изменение голоса и повышенное сексуальное желание . [1] Он также может вызывать повреждение печени и сердечно-сосудистые побочные эффекты, такие как высокое кровяное давление . [1] [7] [8] Препарат является синтетическим андрогеном и анаболическим стероидом и, следовательно, является агонистом андрогенового рецептора ( АР), биологической мишени андрогенов, таких как тестостерон и дигидротестостерон (ДГТ). [1] [9] Он обладает сильным андрогенным действием и умеренным анаболическим действием, что делает его полезным для создания маскулинизации. [1] [10]
Флюоксиместерон был впервые описан в 1956 году и был представлен для медицинского применения в 1957 году. [1] [11] Помимо медицинского применения, флюоксиместерон используется для улучшения физических данных и производительности . [1] Препарат является контролируемым веществом во многих странах, поэтому его немедицинское использование, как правило, незаконно. [1]
Медицинское применение
Флюоксиместерон используется или использовался для лечения гипогонадизма , задержки полового созревания и анемии у мужчин, а также для лечения рака молочной железы у женщин. [1] [12] Он специально одобрен в одной или нескольких странах для лечения гипогонадизма у мужчин, задержки полового созревания у мальчиков и рака молочной железы у женщин. [13] Текущие руководящие принципы назначения в Соединенных Штатах указывают только лечение дефицита андрогенов у мужчин и рака молочной железы у женщин в качестве показаний. [1]
Флюоксиместерон менее эффективен в индуцировании маскулинизации, чем тестостерон, но полезен для поддержания установленной маскулинизации у взрослых. [14]
| Маршрут | Медикамент | Основные торговые марки | Форма | Дозировка |
|---|---|---|---|---|
| Оральный | Тестостерон а | – | Планшет | 400–800 мг/день (в несколько приемов) |
| Тестостерон ундеканоат | Андриол, Джатензо | Капсула | 40–80 мг/2–4 раза в день (во время еды) | |
| Метилтестостерон б | Android, Метандрен, Тестред | Планшет | 10–50 мг/день | |
| Флюоксиместерон б | Халотестин, Ора-Тестрил, Ультандрен | Планшет | 5–20 мг/день | |
| Метандиенон б | Дианабол | Планшет | 5–15 мг/день | |
| Местеролон б | Провирон | Планшет | 25–150 мг/день | |
| Сублингвально | Тестостерон б | Тесторальный | Планшет | 5–10 мг 1–4 раза в день |
| Метилтестостерон б | Метандрен, Оретон Метил | Планшет | 10–30 мг/день | |
| Щечный | Тестостерон | Стрийант | Планшет | 30 мг 2 раза в день |
| Метилтестостерон б | Метандрен, Оретон Метил | Планшет | 5–25 мг/день | |
| Трансдермальный | Тестостерон | АндроГель, Тестим, ТестоГель | Гель | 25–125 мг/день |
| Андродерм, АндроПатч, ТестоПатч | Нескротальный пластырь | 2,5–15 мг/день | ||
| Тестодерм | Мошоночный пластырь | 4–6 мг/день | ||
| Аксирон | Раствор для подмышечной впадины | 30–120 мг/день | ||
| Андростанолон ( ДГТ ) | Андрактим | Гель | 100–250 мг/день | |
| Ректальный | Тестостерон | Ректандрона, Тестостерон б | Суппозиторий | 40 мг 2–3 раза в день |
| Инъекция ( в/м)Подсказка внутримышечная инъекцияили СКПодсказка подкожная инъекция) | Тестостерон | Андронак, Стеротоат, Виростерон | Водная суспензия | 10–50 мг 2–3 раза в неделю |
| Тестостерон пропионат б | Тестовирон | Масляный раствор | 10–50 мг 2–3 раза в неделю | |
| Тестостерон энантат | Делатестрил | Масляный раствор | 50–250 мг 1 раз/1–4 недели | |
| Xyosted | Автоинжектор | 50–100 мг 1 раз в неделю | ||
| Тестостерон ципионат | Депо-Тестостерон | Масляный раствор | 50–250 мг 1 раз/1–4 недели | |
| Тестостерон изобутират | Аговирин Депо | Водная суспензия | 50–100 мг 1 раз/1–2 недели | |
| Тестостерон фенилацетат б | Перандрен, Андроджект | Масляный раствор | 50–200 мг 1 раз в 3–5 недель | |
| Смешанные эфиры тестостерона | Сустанон 100, Сустанон 250 | Масляный раствор | 50–250 мг 1×/2–4 недели | |
| Тестостерон ундеканоат | Авид, Небидо | Масляный раствор | 750–1000 мг 1 раз/10–14 недель | |
| Тестостерон буциклат а | – | Водная суспензия | 600–1000 мг 1 раз в 12–20 недель | |
| Имплантат | Тестостерон | Тестопель | Пеллета | 150–1200 мг/3–6 месяцев |
| Примечания: Мужчины вырабатывают около 3–11 мг тестостерона в день (в среднем 7 мг/день у молодых мужчин). Сноски: a = Никогда не продавался. b = Больше не используется и/или больше не продается. Источники: см. шаблон. | ||||
| Маршрут | Медикамент | Основные торговые марки | Форма | Дозировка |
|---|---|---|---|---|
| Оральный | Тестостерон ундеканоат | Андриол, Джатензо | Капсула | 40–80 мг 1 раз/1–2 дня |
| Метилтестостерон | Метандрен, Эстратест | Планшет | 0,5–10 мг/день | |
| Флюоксиместерон | Халотестин | Планшет | 1–2,5 мг 1 раз/1–2 дня | |
| Норметандрон а | Гинекозид | Планшет | 5 мг/день | |
| Тиболон | Ливиальный | Планшет | 1,25–2,5 мг/день | |
| Прастерон ( ДГЭА ) б | – | Планшет | 10–100 мг/день | |
| Сублингвально | Метилтестостерон | Метандрен | Планшет | 0,25 мг/день |
| Трансдермальный | Тестостерон | Интринса | Пластырь | 150–300 мкг/день |
| АндроГель | Гель, крем | 1–10 мг/день | ||
| Вагинальный | Прастерон ( ДГЭА ) | Интрароза | Вставлять | 6,5 мг/день |
| Инъекция | Тестостерон пропионат а | Тестовирон | Масляный раствор | 25 мг 1 раз/1–2 недели |
| Тестостерон энантат | Делатестрил, Примодианское Депо | Масляный раствор | 25–100 мг 1 раз/4–6 недель | |
| Тестостерон ципионат | Депо-Тестостерон, Депо-Тестадиол | Масляный раствор | 25–100 мг 1 раз/4–6 недель | |
| Тестостерон изобутират а | Фемандрен М, Фоливирин | Водная суспензия | 25–50 мг 1 раз/4–6 недель | |
| Смешанные эфиры тестостерона | Климактерон а | Масляный раствор | 150 мг 1 раз/4–8 недель | |
| Омнадрен, Сустанон | Масляный раствор | 50–100 мг 1 раз/4–6 недель | ||
| Нандролон деканоат | Дека-Дураболин | Масляный раствор | 25–50 мг 1 раз/6–12 недель | |
| Прастерон энантат а | Гинодиан Депо | Масляный раствор | 200 мг 1 раз/4–6 недель | |
| Имплантат | Тестостерон | Тестопель | Пеллета | 50–100 мг 1 раз/3–6 месяцев |
| Примечания: Женщины в пременопаузе вырабатывают около 230 ± 70 мкг тестостерона в день (6,4 ± 2,0 мг тестостерона за 4 недели), с диапазоном от 130 до 330 мкг в день (3,6–9,2 мг за 4 недели). Сноски: a = В основном сняты с производства или недоступны. b = Отпускаются без рецепта . Источники: см. шаблон. | ||||
| Маршрут | Медикамент | Форма | Дозировка | |
|---|---|---|---|---|
| Оральный | Метилтестостерон | Планшет | 30–200 мг/день | |
| Флюоксиместерон | Планшет | 10–40 мг 3 раза в день | ||
| Калустерон | Планшет | 40–80 мг 4 раза в день | ||
| Норметандрон | Планшет | 40 мг/день | ||
| Щечный | Метилтестостерон | Планшет | 25–100 мг/день | |
| Инъекция ( в/м)Подсказка внутримышечная инъекцияили СКПодсказка подкожная инъекция) | Тестостерон пропионат | Масляный раствор | 50–100 мг 3 раза в неделю | |
| Тестостерон энантат | Масляный раствор | 200–400 мг 1 раз/2–4 недели | ||
| Тестостерон ципионат | Масляный раствор | 200–400 мг 1 раз/2–4 недели | ||
| Смешанные эфиры тестостерона | Масляный раствор | 250 мг 1 раз в неделю | ||
| Метандриол | Водная суспензия | 100 мг 3 раза в неделю | ||
| Андростанолон ( ДГТ ) | Водная суспензия | 300 мг 3 раза в неделю | ||
| Дростанолон пропионат | Масляный раствор | 100 мг 1–3 раза в неделю | ||
| Метенолона энантат | Масляный раствор | 400 мг 3 раза в неделю | ||
| Нандролон деканоат | Масляный раствор | 50–100 мг 1 раз/1–3 недели | ||
| Нандролон фенилпропионат | Масляный раствор | 50–100 мг/неделю | ||
| Примечание: Дозировки не обязательно эквивалентны. Источники: см. шаблон. | ||||
Доступные формы
Флюоксиместерон выпускается в форме пероральных таблеток по 2, 5 и 10 мг . [15]
Немедицинское использование
Флюоксиместерон используется для улучшения телосложения и производительности спортсменами , бодибилдерами и пауэрлифтерами . [1 ]
Побочные эффекты
Побочные эффекты , связанные с флюоксиместероном, включают акне , отек , себорею / себорейный дерматит , алопецию , гирсутизм , огрубение голоса , вирилизацию в целом, приливы , гинекомастию , боль в груди , нарушения менструального цикла , гипогонадизм , атрофию яичек , увеличение клитора , увеличение полового члена , приапизм , повышенную агрессивность , увеличение простаты , сердечно-сосудистую токсичность и гепатотоксичность и другие. [1] [16]
Фармакология
Фармакодинамика
| Медикамент | Коэффициент а |
|---|---|
| Тестостерон | ~1:1 |
| Андростанолон ( ДГТ ) | ~1:1 |
| Метилтестостерон | ~1:1 |
| Метандриол | ~1:1 |
| Флюоксиместерон | 1:1–1:15 |
| Метандиенон | 1:1–1:8 |
| Дростанолон | 1:3–1:4 |
| Метенолон | 1:2–1:30 |
| Оксиметолон | 1:2–1:9 |
| Оксандролон | 1:3–1:13 |
| Станозолол | 1:1–1:30 |
| Нандролон | 1:3–1:16 |
| Этилэстренол | 1:2–1:19 |
| Норэтандролон | 1:1–1:20 |
| Примечания: У грызунов. Сноски: a = Соотношение андрогенной и анаболической активности. Источники: См. шаблон. | |
Как ААС, флюоксиместерон является агонистом андрогенового рецептора (АР), подобно андрогенам, таким как тестостерон и ДГТ. [1] [17] Он является субстратом для 5α-редуктазы , подобно тестостерону, и поэтому потенцируется в так называемых «андрогенных» тканях, таких как кожа , волосяные фолликулы и предстательная железа , посредством превращения в 5α-дигидрофлуоксиместерон . [1] [17] [4] Таким образом, флюоксиместерон имеет относительно плохое соотношение анаболической и андрогенной активности, аналогично тестостерону и метилтестостерону . [1] [17] Однако флюоксиместерон, тем не менее, пропорционально менее андрогенен и более анаболичен, чем метилтестостерон и тестостерон. [10]
Сообщалось, что флюоксиместерон неароматизируется из -за стерических препятствий , создаваемых его гидроксильной группой C11β [18] , и, следовательно, не считается склонным к возникновению эстрогенных эффектов, таких как гинекомастия или задержка жидкости . [1] [19] Однако, как это ни парадоксально, существует сообщение о случае тяжелой гинекомастии, вызванной флюоксиместероном, и гинекомастия, связанная с флюоксиместероном, также была описана в других публикациях, хотя это может быть связано не с эстрогенной активностью. [20] Считается, что флюоксиместерон обладает незначительной или нулевой прогестагенной активностью. [1] [17]
Из-за наличия 17α-метильной группы метаболизм флюоксиместерона затруднен, в результате чего он становится активным при приеме внутрь , хотя также гепатотоксичным . [1] [17]
Ингибирование 11β-HSD
Было обнаружено, что флюоксиместерон действует как мощный ингибитор 11β-гидроксистероиддегидрогеназы типа 2 (11β-HSD2) ( IC 50Подсказка Полумаксимальная ингибирующая концентрация= 60–630 нМ), с эффективностью, сопоставимой с эффективностью ингибитора 11β-HSD2 глицирретиновой кислоты . [7] [8] Это действие флюоксиместерона является уникальным среди ААС и, вероятно, связано с его 11β-гидроксильной группой. [7] 11β-HSD2 отвечает за инактивацию глюкокортикоидов кортизола и кортикостерона (в кортизон и 11-дегидрокортикостерон соответственно). [7] [8] Ингибирование 11β-HSD2 флюоксиместероном может привести к сверхактивации минералокортикоидных рецепторов и связанным с ними побочным эффектам , таким как гипертония и задержка жидкости , и было высказано предположение, что оно участвует в сердечно-сосудистых и других неблагоприятных эффектах флюоксиместерона. [7] [8]
Глюкокортикоидная активность
В отличие от других ААС, флюоксиместерон имеет структурные особенности, общие с кортикостероидами , включая его фторогруппы C9α и гидроксильные группы C11β . [21] В связи с этим он имеет слабое ( микромолярное ), но потенциально клинически значимое сродство к глюкокортикоидному рецептору . [22]
Фармакокинетика
Флюоксиместерон имеет приблизительно 80% пероральной биодоступности , в отличие от тестостерона, так как метильная группа C17α флюоксиместерона ингибирует метаболизм первого прохождения . [3] [1] Он имеет очень низкое сродство к глобулину, связывающему половые гормоны в сыворотке человека (ГСПГ), менее 5% от такового тестостерона и менее 1% от такового ДГТ. [23] Препарат метаболизируется в печени , в основном путем 6β- гидроксилирования , 5α- и 5β-восстановления , 3α- и 3β-кетоокисления и 11β-гидроксиокисления . [4] Его известные активные метаболиты включают 5α-дигидрофлуоксиместерон и 11-оксофлуоксиместерон . [4] [7] [24] [10] Период полувыведения флюоксиместерона составляет приблизительно 9,2 часа, что больше, чем у тестостерона. [5] Он выводится с мочой , менее 5% выводится в неизмененном виде. [3] [4]
Химия
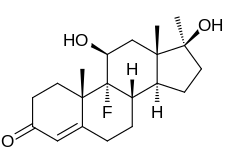
Флюоксиместерон, также известный как 9α-фтор-11β-гидрокси-17α-метилтестостерон или как 9α-фтор-17α-метиландрост-4-ен-11β,17β-диол-3-он, является синтетическим андростановым стероидом и 17α -алкилированным производным тестостерона (андрост-4-ен-17β-ол-3-он). [25] [26] Это, в частности, производное тестостерона с атомом фтора в положении C9α, гидроксильной группой в положении C11β и метильной группой в положении C17α. [25] [26]
Синтез
Шаг первый: Первым шагом в синтезе флюоксиместерона является микробиологическое окисление коммерчески доступного андростендиона ( 1.11 ) актиномицетами ; это вводит гидроксильную группу в 11 α -положение ( 1.12 ), которое затем окисляется до кетона с использованием реагента Джонса, давая 3,11,17-трикетон, адреностерон ( 1.13 ). Затем пирролидин реагирует с образованием енамина ( 1.14 ) путем реакции с 3 α -кетогруппой, защищая ее от алкилирования на последующем этапе. Региоселективность пирролидина для реакции в 3 α -положении изначально заложена в структуре адреностерона из-за положения стерически объемных метильных групп. На последующих этапах алкилирование 17-кетогруппы ( 1.14 ) с использованием реактива Гриньяра, добавление гидрида в 11-положение ( 1.15 ) и регенерация защищенной 3-кетогруппы дает исходный материал ( 1.16 ) для конечных этапов синтеза флюоксиместерона. Это включает в себя более стандартные синтетические преобразования.

Шаг второй: 11 α -гидроксил исходного материала ( 1.16 ) сульфонилируется п -толуолсульфонилхлоридом; добавление триметиламина (основание) депротонирует 11 α -углерод, что приводит к (E 2 ) элиминированию тозилата (pk a - 5) с получением олефина ( 1.17 ). Стереоспецифичность реакции между олефином и бромноватистой кислотой (HOBr) в основании, N -бромсукцинимиде (NBS), определяется образованием промежуточного соединения бромония; электрофильный катион бромония приближается к менее стерически затрудненной α -грани кольца и подвергается атаке π-электронной плотности алкена. Затем гидроксид-ион атакует сверху кольца ( β -грань) на 11-углерод, что приводит к образованию структуры ( 1.18 ) путем стереоспецифического присоединения гидроксила и брома через двойную связь. Добавление гидроксида натрия приводит к депротонированию 11 α -гидроксила, и последующая структура претерпевает внутримолекулярное образование эпоксидного кольца S N 2. Эпоксидное кольцо β -эпоксида ( 1.19 ) протонируется, давая промежуточный ион оксирония. В согласованном процессе фторид атакует α -грань кольца снизу, поскольку одна из двух связей кислород-углерод разрывается на противоположной стороне; следовательно, восстанавливая 11 α -гидроксил транс к фторидному заместителю. Полученная структура ( 1.20 ) представляет собой андрогенный стероид, флуоксиместерон.
Обнаружение в жидкостях организма
Обнаружение галотестина и других подобных нелегальных анаболических стероидов в спорте достигается путем идентификации GS-MS выделяемых с мочой анаболических стероидов и их метаболитов. В тесте на галотестин сухой остаток, полученный из образца мочи, растворяется в диметилформамиде и комплексе триоксида серы-пиридина и нагревается с 1% раствором карбоната калия. Галотестин и многие его метаболиты содержат две полярные гидроксильные группы, что приводит к образованию межмолекулярных водородных связей, что повышает их температуру кипения и снижает летучесть. Чтобы получить газообразный образец для GC-MS, продукты гидролиза извлекаются, растворяются в метаноле и дериватизируются с образованием летучих триметилсилиловых (TMS) эфиров путем добавления N -метил- N -триметилсилил-трифторацетамида (MSTFA) и триметилсилилимидазола (TMSImi). [27]
История
Флюоксиместерон был впервые описан в 1956 году и был введен в медицинское использование в Соединенных Штатах в 1957 году. [1] [11] Со временем использование флюоксиместерона становилось все более спорным и ограниченным. [1]
Общество и культура
Общие названия
Флюоксиместерон — это общее название препарата и его МНН.Подсказка Международное непатентованное название, USPПодсказка Фармакопея США, БАНПодсказка: одобренное британцами имя, DCITПодсказка: Denominazione Comune Italiana, и ЯНПодсказка Японское принятое имя, в то время как флюоксиместерон является его DCFПодсказка: Наименование: Французская коммуна. [25] [26] [28] [29]
Названия брендов
Торговые марки флюоксиместерона включают Android-F, Androxy, Halotestin, Ora-Testryl и Ultandren среди прочих. [25] [26] [28] [29]
Доступность
Соединенные Штаты
Флюоксиместерон — один из немногих ААС, который остаётся доступным для медицинского применения в Соединённых Штатах . [30] Другими (по состоянию на август 2023 года) являются тестостерон , тестостерона ципионат , тестостерона энантат , тестостерона ундеканоат , метилтестостерон и оксиметолон . [30]
Другие страны
Доступность флюоксиместерона за пределами США остается ограниченной, но он продается в некоторых других странах, таких как Мексика , Молдова и Тайвань . [1] [29]
Правовой статус
Флюоксиместерон, наряду с другими ААС, является контролируемым веществом списка III в Соединенных Штатах в соответствии с Законом о контролируемых веществах . [31]
Ссылки
- ^ abcdefghijklmnopqrstu vwx Ллевеллин В. (2011). Анаболики. Molecular Nutrition Llc. С. 500–508 . ISBN 978-0-9828280-1-4.
- ^ Анвиса (31 марта 2023 г.). «RDC № 784 - Listas de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial» [Постановление Коллегиального совета № 784 - Списки наркотических, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем] (на бразильском португальском языке). Diário Oficial da União (опубликовано 4 апреля 2023 г.). Архивировано из оригинала 3 августа 2023 г. Проверено 15 августа 2023 г.
- ^ abcd Lemke TL, Williams DA (24 января 2012 г.). Принципы медицинской химии Фоя. Lippincott Williams & Wilkins. стр. 1360–. ISBN 978-1-60913-345-0.
- ^ abcdefgh Kammerer RC, Merdink JL, Jagels M, Catlin DH, Hui KK (1990). «Тестирование флуоксиместерона (Халотестина) для человека: идентификация метаболитов в моче методом газовой хроматографии-масс-спектрометрии». J. Steroid Biochem . 36 (6): 659– 66. doi :10.1016/0022-4731(90)90185-u. PMID 2214783.
- ^ Робертс С. (2009). Анаболическая фармакология.
- ^ Лемке TL, Уильямс DA (2008). Принципы медицинской химии Фоя. Lippincott Williams & Wilkins. стр. 1279–. ISBN 978-0-7817-6879-5.
- ^ abcdef Fürstenberger C, Vuorinen A, Da Cunha T, Kratschmar DV, Saugy M, Schuster D, Odermatt A (2012). «Анаболический андрогенный стероид флюоксиместерон ингибирует 11β-гидроксистероиддегидрогеназу 2-зависимую глюкокортикоидную инактивацию». Toxicol. Sci . 126 (2): 353– 61. doi : 10.1093/toxsci/kfs022 . PMID 22273746.
- ^ abcd Joseph JF, Parr MK (2015). «Синтетические андрогены как дизайнерские добавки». Curr Neuropharmacol . 13 (1): 89– 100. doi :10.2174/1570159X13666141210224756. PMC 4462045. PMID 26074745 .
- ^ Kicman AT (2008). «Фармакология анаболических стероидов». Br. J. Pharmacol . 154 (3): 502– 21. doi :10.1038/bjp.2008.165. PMC 2439524. PMID 18500378 .
- ^ abc Kochakian CD (6 декабря 2012 г.). Анаболические-андрогенные стероиды. Springer Science & Business Media. стр. 370, 374, 401, 454, 504– 506. ISBN 978-3-642-66353-6.
- ^ ab William Andrew Publishing (22 октября 2013 г.). Энциклопедия фармацевтического производства, 3-е издание. Elsevier. стр. 1676–. ISBN 978-0-8155-1856-3.
- ^ Ford SM, Roach SS (7 октября 2013 г.). Вводная клиническая фармакология Роуча. Lippincott Williams & Wilkins. стр. 502–. ISBN 978-1-4698-3214-2.
- ^ "Флюоксиместерон - AdisInsight".
- ^ Томас JA, Кинан EJ (6 декабря 2012 г.). Принципы эндокринной фармакологии. Springer Science & Business Media. стр. 125–. ISBN 978-1-4684-5036-1.
- ^ Лоррейн Дж. (1994). Комплексное управление менопаузой. Springer Science & Business Media. С. 301–. ISBN 978-0-387-97972-4.
- ^ Litt JZ, Shear N (17 декабря 2014 г.). Руководство Литта по лекарственным сыпям и реакциям, 19-е издание. CRC Press. стр. 177–. ISBN 978-1-84214-599-9.
- ^ abcde Kicman AT (июнь 2008). «Фармакология анаболических стероидов». British Journal of Pharmacology . 154 (3): 502– 521. doi :10.1038/bjp.2008.165. PMC 2439524. PMID 18500378 .
- ^ Attardi BJ, Pham TC, Radler LC, Burgenson J, Hild SA, Reel JR (2008). «Диметандролон (7альфа,11бета-диметил-19-нортестостерон) и 11бета-метил-19-нортестостерон не преобразуются в ароматические продукты A-кольца в присутствии рекомбинантной человеческой ароматазы». J. Steroid Biochem. Mol. Biol . 110 ( 3–5 ): 214–22 . doi :10.1016/j.jsbmb.2007.11.009. PMC 2575079. PMID 18555683 .
- ^ Adler NT, Pfaff D, Goy RW (6 декабря 2012 г.). Репродукция. Springer Science & Business Media. стр. 630–. ISBN 978-1-4684-4832-0.
- ^ Lo TE, Andal ZC, Lantion-Ang FL (2015). «Гинекомастия, вызванная флюоксиместероном, у пациента с детской апластической анемией». BMJ Case Rep . 2015 : bcr2014207474. doi :10.1136/bcr-2014-207474. PMC 4434366. PMID 25948845 .
- ^ Киршбаум Дж. (27 октября 1978 г.). Профили лекарственных веществ, вспомогательных веществ и связанной с ними методологии. Academic Press. стр. 253–. ISBN 978-0-08-086102-9.
- ^ Майер М., Розен Ф. (1975). «Взаимодействие анаболических стероидов с участками рецепторов глюкокортикоидов в цитозоле мышц крыс». Am. J. Physiol . 229 (5): 1381– 6. doi : 10.1152/ajplegacy.1975.229.5.1381 . PMID 173192.
- ^ Saartok T, Dahlberg E, Gustafsson JA (1984). «Относительная связывающая способность анаболических андрогенных стероидов: сравнение связывания с рецепторами андрогенов в скелетных мышцах и простате, а также с глобулином, связывающим половые гормоны». Эндокринология . 114 (6): 2100– 6. doi :10.1210/endo-114-6-2100. PMID 6539197.
- ^ Гордан Г.С. (1976). «Рак у человека». В компакт-диске Кочакяна (ред.). Анаболически-андрогенные стероиды . Handbuch der Experimentellen Pharmakologie / Справочник по экспериментальной фармакологии. Спрингер. стр. 499–513 . doi : 10.1007/978-3-642-66353-6_16. ISBN 978-3-642-66355-0.
- ^ abcd Elks J (14 ноября 2014 г.). Словарь лекарств: химические данные: химические данные, структуры и библиографии. Springer. стр. 568–. ISBN 978-1-4757-2085-3.
- ^ abcd Index Nominum 2000: Международный справочник лекарственных средств. Taylor & Francis. Январь 2000. С. 461. ISBN 978-3-88763-075-1.
- ^ Schänzer W, Opfermann G, Donike M (ноябрь 1992 г.). "17-Эпимеризация 17 альфа-метил анаболических стероидов у людей: метаболизм и синтез 17 альфа-гидрокси-17 бета-метил стероидов". Steroids . 57 (11): 537– 550. doi :10.1016/0039-128X(92)90023-3. PMID 1448813. S2CID 54380880.
- ^ ab Morton IK, Hall JM (6 декабря 2012 г.). Краткий словарь фармакологических средств: свойства и синонимы. Springer Science & Business Media. стр. 123–. ISBN 978-94-011-4439-1.
- ^ abc "Флюоксиместерон: Показания, Побочные Эффекты, Предупреждения". Drugs.com .
- ^ ab "Drugs@FDA: FDA Approved Drug Products". Управление по контролю за продуктами и лекарствами США . Получено 17 декабря 2016 г.
- ^ Карч СБ (21 декабря 2006 г.). Справочник по злоупотреблению наркотиками, второе издание. CRC Press. стр. 30–. ISBN 978-1-4200-0346-8.
