Проточная цитометрия
 Проточный цитометр с трубкой для ввода образца. | |
| Классификация | Цитометрия |
|---|---|
| Аналиты | Клетки или частицы |
| Другие методы | |
| Связанный | Счетчик Коултера |
Проточная цитометрия ( ПЦ ) — это метод, используемый для обнаружения и измерения физических и химических характеристик популяции клеток или частиц. [1] [2] [3] [4]
В этом процессе образец, содержащий клетки или частицы, суспендируется в жидкости и вводится в проточный цитометр . Образец фокусируется для идеального потока одной клетки за раз через лазерный луч, где рассеянный свет характерен для клеток и их компонентов. Клетки часто маркируются флуоресцентными маркерами, поэтому свет поглощается, а затем испускается в диапазоне длин волн. Десятки тысяч клеток могут быть быстро исследованы, а собранные данные обрабатываются компьютером. [5]
Проточная цитометрия обычно используется в фундаментальных исследованиях, клинической практике и клинических испытаниях . Применение проточной цитометрии включает:
- Подсчет клеток
- Сортировка клеток
- Определение характеристик и функций клеток
- Обнаружение микроорганизмов
- Обнаружение биомаркеров
- Обнаружение белковой инженерии
- Диагностика заболеваний, таких как рак крови
- Измерение размера генома
Анализатор проточной цитометрии — это инструмент, который обеспечивает количественные данные из образца. Другие инструменты, использующие проточную цитометрию, включают сортировщики клеток, которые физически разделяют и тем самым очищают интересующие клетки на основе их оптических свойств.
История
Первое устройство проточной цитометрии на основе импеданса , использующее принцип Коултера , было раскрыто в патенте США 2,656,508, выданном в 1953 году Уоллесу Х. Коултеру . Мак Фулвайлер был изобретателем предшественника сегодняшних проточных цитометров, в частности, сортировщика клеток. [6] Фулвайлер разработал его в 1965 году, опубликовав свою работу в журнале Science . [7] Первое устройство проточной цитометрии на основе флуоресценции (ICP 11) было разработано в 1968 году Вольфгангом Гёде из Университета Мюнстера , подано на патент 18 декабря 1968 года [8] и впервые выпущено на рынок в 1968/69 году немецким разработчиком и производителем Partec через Phywe AG в Геттингене . В то время методы абсорбции все еще широко использовались другими учеными по сравнению с методами флуоресценции . [9] Вскоре после этого были разработаны приборы для проточной цитометрии, включая Cytofluorograph (1971) от Bio/Physics Systems Inc. (позже: Ortho Diagnostics), PAS 8000 (1973) от Partec, первый прибор FACS (сортировка клеток с активацией флуоресценции) от Becton Dickinson (1974), ICP 22 (1975) от Partec/Phywe и Epics от Coulter (1977/78). Первый высокочастотный импедансный проточный цитометр без меток , основанный на запатентованной микрофлюидной «лаборатории на чипе», Ampha Z30, был представлен Amphasys (2012). [ необходима цитата ]
Название технологии
Первоначальное название технологии проточной цитометрии на основе флуоресценции было «импульсная цитофотометрия» ( нем . Impulszytophotometrie ), основанное на первой патентной заявке на проточную цитометрию на основе флуоресценции. На 5-й конференции Американского инженерного фонда по автоматизированной цитологии в Пенсаколе (Флорида) в 1976 году — через восемь лет после появления первого проточного цитометра на основе флуоресценции (1968) — было решено использовать название «проточная цитометрия», термин, который быстро стал популярным. [10]
Проточные цитометры
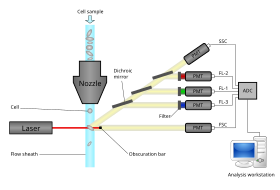
Современные проточные цитометры способны анализировать многие тысячи частиц в секунду в «реальном времени» и, если они настроены как клеточные сортировщики, могут активно разделять и изолировать частицы с заданными оптическими свойствами с аналогичной скоростью. Проточный цитометр похож на микроскоп , за исключением того, что вместо создания изображения клетки проточная цитометрия предлагает высокопроизводительную автоматизированную количественную оценку заданных оптических параметров на основе клетка за клеткой. Для анализа твердых тканей сначала необходимо приготовить суспензию из одной клетки. [ необходима цитата ]
Проточный цитометр состоит из пяти основных компонентов: проточной ячейки, измерительной системы, детектора, системы усиления и компьютера для анализа сигналов. Проточная ячейка имеет поток жидкости (оболочковая жидкость), который переносит и выравнивает клетки так, чтобы они проходили по одной через световой луч для зондирования. Измерительная система обычно использует измерение импеданса (или проводимости) и оптические системы - лампы ( ртутные , ксеноновые ); мощные лазеры с водяным охлаждением ( аргоновые , криптоновые , лазеры на красителях); маломощные лазеры с воздушным охлаждением (аргоновые (488 нм), красные-HeNe (633 нм), зеленые-HeNe, HeCd (УФ)); диодные лазеры (синие, зеленые, красные, фиолетовые), в результате чего возникают световые сигналы. Детектор и система аналого-цифрового преобразования (АЦП) преобразуют аналоговые измерения света, рассеянного вперед (FSC) и света, рассеянного сбоку (SSC), а также сигналы флуоресценции красителя в цифровые сигналы, которые могут быть обработаны компьютером. Система усиления может быть линейной или логарифмической . [ необходима цитата ]
Процесс сбора данных из образцов с использованием проточного цитометра называется «приобретением». Приобретение осуществляется компьютером, физически подключенным к проточному цитометру, и программным обеспечением, которое управляет цифровым интерфейсом с цитометром. Программное обеспечение способно регулировать параметры (например, напряжение, компенсацию) для тестируемого образца, а также помогает отображать начальную информацию об образце при получении данных образца, чтобы гарантировать, что параметры установлены правильно. Ранние проточные цитометры были, в общем, экспериментальными устройствами, но технологические достижения сделали возможными широкое применение для использования в различных клинических и исследовательских целях. Благодаря этим разработкам был разработан значительный рынок для инструментов, программного обеспечения для анализа, а также реагентов, используемых при получении, таких как флуоресцентно меченые антитела .
Современные приборы обычно имеют несколько лазеров и флуоресцентных детекторов. Текущий рекорд для коммерческого прибора составляет десять лазеров [11] и 30 флуоресцентных детекторов. [12] Увеличение числа лазеров и детекторов позволяет производить множественную маркировку антител и точнее идентифицировать целевую популяцию по их фенотипическим маркерам. Некоторые приборы могут даже делать цифровые снимки отдельных клеток, что позволяет анализировать местоположение флуоресцентного сигнала внутри или на поверхности клеток. [ необходима цитата ]
Аппаратное обеспечение
Система струйной автоматики проточного цитометра
Клетки должны равномерно проходить через центр сфокусированных лазерных лучей для точного измерения оптических свойств клеток в любом проточном цитометре. [13] [14] [15] Целью жидкостной системы является перемещение клеток по одной через лазерный луч и через весь прибор. Жидкости в проточном цитометре с возможностями сортировки клеток также используют поток для переноса отсортированных клеток в пробирки или лунки для сбора. [13]
Гидродинамическая фокусировка
Для точного позиционирования клеток в струе жидкости в большинстве цитометров используется гидродинамическая фокусировка. [13] [14] Клетки в суспензии попадают в прибор, заключенный во внешнюю оболочку жидкости. Ядро образца удерживается в центре оболочки жидкости. Скорость ввода образца или скорость прохождения клеток через лазерный зонд можно контролировать давлением оболочки жидкости на ядро образца. В оптимальных условиях центральный поток жидкости и оболочка жидкости не смешиваются. [ необходима цитата ]
Акустическая гидродинамическая фокусировка
Технология акустической фокусировки используется в некоторых проточных цитометрах для поддержки гидродинамической фокусировки. [13] [15] Акустические волны (>2 МГц) предварительно фокусируют образец перед введением в защитную жидкость. Затем предварительно сфокусированный образец вводится в гидродинамическое ядро и протекает через прибор. Это может помочь повысить точность данных при высоких скоростях ввода образцов.
Оптика и электроника
Оптические фильтры
Свет, излучаемый флуорофорами, находится в спектре длин волн, поэтому объединение нескольких флуорофоров может привести к перекрытию. Для повышения специфичности используются оптические фильтры и дихроичные зеркала для фильтрации и перемещения света к детекторам, таким как фотоумножители (ФЭУ) или лавинные фотодиоды (ЛФД). [13] Оптические фильтры проектируются как полосовые (BP), длиннопроходные (LP) или короткопроходные (SP) фильтры. Большинство проточных цитометров используют дихроичные зеркала и полосовые фильтры для выбора определенных полос оптического спектра.
Призмы, решетки и спектральная проточная цитометрия
Спектральная проточная цитометрия использует призмы или дифракционные решетки для рассеивания испускаемого маркером света по массиву детекторов. [13] [16] Это позволяет измерять полные спектры от каждой частицы. Измеренные спектры от отдельных клеток впоследствии разделяются с использованием эталонных спектров всех используемых красителей и спектра автофлуоресценции. Это может позволить более широкую конструкцию панели и применение новых биологических маркеров. [ необходима цитата ]
Визуализация проточной цитометрии
Визуализирующая проточная цитометрия (IFC) захватывает многоканальные изображения клеток. [13] [17] Детекторы, используемые в платформах визуализации, могут быть оснащены приборами с зарядовой связью (ПЗС) или комплементарными металл-оксид-полупроводниками (КМОП) для захвата изображений отдельных клеток.
Анализ данных
Компенсация
Каждый флуорохром имеет широкий спектр флуоресценции. При использовании более одного флуорохрома может возникнуть перекрытие между флуорохромами. Эта ситуация называется перекрытием спектра и должна быть исправлена. Например, спектр излучения для FITC и PE - это тот, в котором свет, испускаемый флуоресцеином, перекрывает ту же длину волны, когда он проходит через фильтр, используемый для PE. Это спектральное перекрытие корректируется путем удаления части сигнала FITC из сигналов PE или наоборот. Этот процесс называется цветовой компенсацией, которая вычисляет флуорохром в процентах для измерения самого себя. [18]
Компенсация — это математический процесс, посредством которого корректируется спектральное перекрытие многопараметрических данных проточной цитометрии. Поскольку флуорохромы могут иметь широкий спектр, они могут перекрываться, вызывая нежелательный результат путаницы во время анализа данных. Это перекрытие, известное как переполнение и количественно определяемое в коэффициенте переполнения, обычно вызывается детекторами для определенного флуорохрома, измеряющими значительный пик в длине волны от другого флуорохрома. Для выполнения этой коррекции чаще всего используется линейная алгебра. [18]
В общем, когда отображаются графики одного или нескольких параметров, это показывает, что другие параметры не вносят вклад в показанное распределение. Особенно при использовании параметров, которые больше, чем в два раза, эта проблема становится более серьезной. В настоящее время не обнаружено инструментов для эффективного отображения многомерных параметров. Компенсация очень важна для того, чтобы увидеть различие между ячейками.

Стробирование
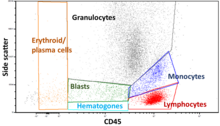
Данные, полученные с помощью проточных цитометров, можно нанести на график в одном измерении для получения гистограммы , или на двухмерных точечных диаграммах, или даже в трех измерениях. Области на этих графиках можно последовательно разделять на основе интенсивности флуоресценции , создавая ряд извлечений подмножеств, называемых «воротами». Существуют специальные протоколы гейтирования для диагностических и клинических целей, особенно в отношении гематологии . Отдельные одиночные клетки часто отличаются от клеточных дублетов или более высоких агрегатов по их «времени пролета» (также обозначаемому как «ширина импульса») через узконаправленный лазерный луч [19]
Графики часто строятся в логарифмическом масштабе. Поскольку спектры эмиссии различных флуоресцентных красителей перекрываются, [20] [21] сигналы на детекторах должны быть скомпенсированы как электронным способом, так и вычислительно. Данные, собранные с помощью проточного цитометра, можно анализировать с помощью программного обеспечения. После сбора данных нет необходимости оставаться подключенным к проточному цитометру, и анализ чаще всего выполняется на отдельном компьютере. [ необходима цитата ] Это особенно необходимо в основных учреждениях, где использование этих машин пользуется большим спросом. [ необходима цитата ]
Вычислительный анализ
Недавний прогресс в области автоматизированной идентификации популяций с использованием вычислительных методов предложил альтернативу традиционным стратегиям гейтирования. Автоматизированные системы идентификации потенциально могут помочь в обнаружении редких и скрытых популяций. Представительные автоматизированные методы включают FLOCK [22] в Immunology Database and Analysis Portal (ImmPort), [23] SamSPECTRAL [24] и flowClust [25] [26] [27] в Bioconductor и FLAME [28] в GenePattern . T-распределенное стохастическое встраивание соседей (tSNE) — это алгоритм, разработанный для выполнения снижения размерности , чтобы обеспечить визуализацию сложных многомерных данных на двумерной «карте». [29] Совместные усилия привели к открытому проекту под названием FlowCAP (Flow Cytometry: Critical Assessment of Population Identification Methods, [30] ), чтобы обеспечить объективный способ сравнения и оценки методов кластеризации данных проточной цитометрии, а также установить руководство по надлежащему использованию и применению этих методов.
FMO-контроль
Элементы управления Fluorescence minus one (FMO) важны для интерпретации данных при построении многоцветных панелей, в которых клетка окрашивается несколькими флуорохромами одновременно. Элементы управления FMO обеспечивают измерение перетока флуоресценции в заданном канале и позволяют компенсировать его. Для создания элемента управления FMO образец окрашивается всеми флуорохромами, кроме одного, который тестируется, — то есть, если вы используете 4 разных флуорохрома, ваш элемент управления FMO должен содержать только 3 из них (пример: флуорохромы — A, B, C, D; FMO — ABC_, AB_D, A_CD, _BCD). [ необходима цитата ]
Сортировка клеток методом проточной цитометрии
Сортировка клеток — это метод очистки популяций клеток на основе наличия или отсутствия определенных физических характеристик. [13] [15] [31] В проточных цитометрах с возможностью сортировки прибор обнаруживает клетки, используя такие параметры, как размер клеток, морфология и экспрессия белка, а затем технологию капель для сортировки клеток и извлечения подмножеств для использования после эксперимента. [13] [15]
Первый прототип сортировщика был построен в Лос-Аламосской национальной лаборатории (LANL) в 1965 году физиком Маком Дж. Фулвилером путем соединения датчика объема Коултера с недавно изобретенным струйным принтером. [32] Сортировщик живых клеток или сортировщик клеток с активацией флуоресценции (FACS) [a] был создан Леном Герценбергом , который впоследствии получил Киотскую премию в 2006 году за свою основополагающую работу. [34]
_B.jpg/440px-Fluorescence_Assisted_Cell_Sorting_(FACS)_B.jpg)
Сортировщики клеток проточной цитометрии имеют систему сбора, в отличие от анализаторов проточной цитометрии. Процесс сбора начинается, когда образец вводится в поток жидкости оболочки, который проходит через проточную ячейку и перехватывается лазером. [35] Затем поток переносит клетку через вибрирующую насадку, которая генерирует капли, большинство из которых содержит либо одну клетку, либо не содержит клеток. Электрическое зарядное кольцо помещается как раз в точку, где поток распадается на капли, и заряд помещается на кольцо непосредственно перед измерением интенсивности флуоресценции; противоположный заряд захватывается каплей, когда она отрывается от потока, и поэтому капли заряжаются. Затем заряженные капли падают через электростатическую отклоняющую систему, которая отводит капли в контейнеры на основе их заряда. В некоторых системах заряд прикладывается непосредственно к потоку, и отрывающаяся капля сохраняет заряд того же знака, что и поток. Затем поток возвращается в нейтральное состояние после отрыва капли. После сбора эти клетки можно далее культивировать, манипулировать ими и изучать. [ необходима цитата ]
Этикетки

Проточная цитометрия использует свойства света, рассеянного клетками или частицами, для идентификации или количественного измерения физических свойств. Метки, красители и пятна могут использоваться для многопараметрического анализа (для понимания дополнительных свойств клетки). Иммунофенотипирование — это анализ гетерогенных популяций клеток с использованием меченых антител [36] и других реагентов, содержащих флуорофор, таких как красители и пятна.
Флуоресцентные этикетки
В качестве меток в проточной цитометрии можно использовать широкий спектр флуорофоров. [20] Флуорофоры, или просто «флуорофоры», [ требуется ссылка ] обычно прикрепляются к антителу, которое распознает целевой признак на клетке или в ней; они также могут быть прикреплены к химическому веществу со сродством к клеточной мембране или другой клеточной структуре. Каждый флуорофор имеет характерную пиковую длину волны возбуждения и испускания , и спектры испускания часто перекрываются. Следовательно, комбинация меток, которые можно использовать, зависит от длины волны лампы(-ок) или лазера(-ов), используемых для возбуждения флуорохромов, и от доступных детекторов. [37] Проточная цитометрия использует флуоресценцию в качестве количественного инструмента; максимальная чувствительность проточной цитометрии не имеет себе равных среди других платформ флуоресцентного обнаружения, таких как конфокальная микроскопия . Абсолютная чувствительность флуоресценции, как правило, ниже в конфокальной микроскопии, поскольку сигналы, находящиеся вне фокуса, отклоняются конфокальной оптической системой, а изображение формируется последовательно из отдельных измерений в каждом месте клетки, что сокращает количество времени, доступного для сбора сигнала. [38]
Квантовые точки
Квантовые точки иногда используются вместо традиционных флуорофоров из-за их более узких пиков излучения. [ необходима ссылка ]
Изотопная маркировка
Массовая цитометрия преодолевает предел флуоресцентной маркировки, используя изотопы лантаноидов, прикрепленные к антителам. Этот метод теоретически может позволить использовать от 40 до 60 различимых меток и был продемонстрирован для 30 меток. [39] Массовая цитометрия принципиально отличается от проточной цитометрии: клетки вводятся в плазму , ионизируются, а связанные изотопы количественно определяются с помощью времяпролетной масс-спектрометрии . Хотя этот метод позволяет использовать большое количество меток, в настоящее время он имеет более низкую пропускную способность, чем проточная цитометрия. Он также разрушает анализируемые клетки, исключая их восстановление путем сортировки. [39]
Цитометрический массив шариков
Помимо возможности маркировать и идентифицировать отдельные клетки с помощью флуоресцентных антител, можно также измерять такие клеточные продукты, как цитокины, белки и другие факторы. Подобно сэндвич-анализам ELISA , анализы с использованием цитометрической матрицы шариков ( CBA ) используют несколько популяций шариков, обычно различающихся по размеру и разным уровням интенсивности флуоресценции, чтобы различать несколько аналитов в одном анализе. Количество захваченного аналита определяется с помощью биотинилированного антитела против вторичного эпитопа белка с последующей обработкой стрептавидином-R-фикоэритрином. Интенсивность флуоресценции R-фикоэритрина на шариках количественно определяется на проточном цитометре, оснащенном источником возбуждения 488 нм. Концентрации интересующего белка в образцах можно получить, сравнивая флуоресцентные сигналы с сигналами стандартной кривой, полученной при последовательном разведении известной концентрации аналита. Обычно также называется матрицей цитокиновых шариков (CBA).
Импедансная проточная цитометрия
Системы анализа отдельных клеток на основе импеданса обычно известны как счетчики Коултера . Они представляют собой хорошо зарекомендовавший себя метод подсчета и определения размеров практически любых клеток и частиц. Технология без меток недавно была усовершенствована с помощью подхода, основанного на « лаборатории на чипе », и путем применения высокочастотного переменного тока (AC) в диапазоне радиочастот (от 100 кГц до 30 МГц) вместо статического постоянного тока (DC) или низкочастотного переменного поля. [40] [41] Эта запатентованная технология позволяет проводить высокоточный анализ клеток и предоставляет дополнительную информацию, такую как емкость мембраны и жизнеспособность . Относительно небольшой размер и надежность позволяют использовать аккумуляторную батарею на месте в полевых условиях.
Измеряемые параметры
Измеримые факторы в клеточном анализе и проточной цитометрии включают разнообразный набор признаков и индикаторов, которые обеспечивают важные сведения о биологии и функционировании клеток. Методы проточной цитометрии могут количественно определять и оценивать эти факторы, позволяя исследователям исследовать и анализировать различные аспекты клеток. Вот некоторые важные количественные параметры, которые часто исследуются:
- Апоптоз: Апоптоз можно количественно оценить с помощью проточной цитометрии, измеряя разрушение ДНК, потенциал митохондриальной мембраны, изменения проницаемости и активность каспазы. Эти измерения раскрывают важные детали о запланированной гибели клеток.
- Клеточная адгезия: проточная цитометрия может использоваться для исследования клеточной адгезии, например, адгезии патоген-клетка-хозяин. Исследователи могут количественно оценивать и анализировать события клеточной адгезии, используя определенные маркеры или флуоресцентные метки.
- Пигменты клеток: Хлорофилл и фикоэритрин — пигменты, которые встречаются в некоторых клетках. Наличие и количество этих пигментов можно измерить с помощью проточной цитометрии, что дает информацию о клеточном метаболизме и физиологических состояниях.
- Антигены клеточной поверхности: Проточная цитометрия часто используется для идентификации и количественной оценки антигенов клеточной поверхности, также известных как маркеры кластера дифференциации (CD). Исследователи могут классифицировать популяции клеток на основе экспрессии поверхностных антигенов, маркируя клетки специфическими антителами.
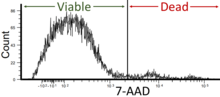
- Жизнеспособность клеток: проточная цитометрия может использоваться в качестве анализа жизнеспособности клеток с использованием флуоресцентных красителей или маркеров, которые различают живые и мертвые клетки. Этот параметр имеет решающее значение для определения здоровья клеток и реакции на экспериментальные или терапевтические условия. Жизнеспособность клеток в проточной цитометрии должна составлять около 95%, но не менее 90%. [42]
- Циркулирующие опухолевые клетки: Проточная цитометрия необходима для выделения и очистки циркулирующих опухолевых клеток (ЦОК) из образцов крови. ЦОК можно обнаружить и исследовать, нацеливаясь на определенные маркеры или характеристики, что помогает в диагностике рака, прогнозировании и мониторинге лечения.
- Характеристика множественной лекарственной устойчивости (МЛУ): проточная цитометрия может использоваться для характеристики множественной лекарственной устойчивости (МЛУ) в раковых клетках путем оценки оттока флуоресцентных красителей или определенных маркеров, связанных с механизмами лекарственной устойчивости. Эти знания помогают в понимании и борьбе с лекарственной устойчивостью при лечении рака.
- Анализ и сортировка хромосом: проточная цитометрия может помочь в анализе и сортировке хромосом, позволяя создавать библиотеки и идентифицировать определенные хромосомы или хромосомные аномалии.
- Изменение числа копий ДНК: Изменение числа копий ДНК можно измерить с помощью методов проточной цитометрии, таких как Flow-FISH или технология BACs-on-Beads. Эти технологии проливают свет на генетические изменения, связанные с такими заболеваниями, как рак.
- Экспрессия и модификации белков: Используя флуоресцентно меченые антитела или зонды, проточная цитометрия позволяет оценить уровни экспрессии белков и изменения, такие как фосфорилирование. Этот параметр способствует лучшему пониманию функции белков и сигнальных сетей.
- Текучесть мембраны: Проточная цитометрия может определять текучесть мембраны, используя флуоресцентные зонды, чувствительные к характеристикам мембраны. Этот параметр дает информацию о динамике и функции клеточных мембран.
- Общее содержание ДНК и РНК: проточная цитометрия может измерять общее содержание ДНК и РНК в клетках. Эти данные полезны для анализа клеточного цикла, исследований пролиферации и определения изменений экспрессии генов.
- Мониторинг внутриклеточных параметров: Внутриклеточные факторы можно измерить с помощью проточной цитометрии, включая pH, внутриклеточные уровни ионизированного кальция и магния, мембранный потенциал, уровни глутатиона и окислительный взрыв. Эти данные предоставляют информацию о клеточном метаболизме, сигнализации и окислительном стрессе.
- Рассеивание света: измерения прямого рассеяния (FSC) и бокового рассеяния (SSC) используются в проточной цитометрии для оценки объема клеток и морфологической сложности соответственно. Эти метрики описывают размер, гранулярность и форму клеток.
- Трансгенные продукты: Проточная цитометрия полезна для оценки трансгенных продуктов in vivo, в частности флуоресцентных белков, таких как зеленый флуоресцентный белок (GFP) или похожие вариации. Это позволяет ученым исследовать экспрессию генов, локализацию белков и клеточную динамику.
- Различные комбинации: проточная цитометрия позволяет интегрировать множество измеряемых данных, таких как ДНК/поверхностные антигены, для получения всестороннего понимания биологических особенностей и функций. [43]
Приложения
Технология имеет применение в ряде областей, включая молекулярную биологию , патологию , иммунологию , вирусологию, [44] биологию растений и морскую биологию . [45] Она широко применяется в медицине, особенно в трансплантологии, гематологии, иммунологии опухолей и химиотерапии, пренатальной диагностике, генетике и сортировке спермы для предварительного выбора пола . Проточная цитометрия широко применяется для обнаружения аномалий сперматозоидов, связанных с фрагментацией ДНК [46] в анализах мужской фертильности . [47] Кроме того, она широко используется в исследованиях для обнаружения повреждений ДНК , [48] [49] расщепления каспазы и апоптоза . [50] Фотоакустическая проточная цитометрия используется при изучении бактерий с множественной лекарственной устойчивостью (чаще всего MRSA) для обнаружения, дифференциации и количественной оценки бактерий в крови, помеченных окрашенными бактериофагами. [51] В нейробиологии также можно анализировать коэкспрессию антигенов клеточной поверхности и внутриклеточных антигенов. [52] В микробиологии его можно использовать для скрининга и сортировки библиотек мутантов транспозонов, созданных с помощью транспозона, кодирующего GFP (TnMHA), [53] или для оценки жизнеспособности. [54] В белковой инженерии проточная цитометрия используется в сочетании с дисплеем дрожжей и бактериальным дисплеем для идентификации вариантов белков, отображаемых на поверхности клеток, с желаемыми свойствами. Основными преимуществами проточной цитометрии перед гистологией и IHC являются возможность точного измерения количества антигенов и возможность окрашивания каждой клетки несколькими антителами-флуорофорами; в современных лабораториях с каждой клеткой может быть связано около 10 антител. Это намного меньше, чем масс-цитометрия, где в настоящее время можно измерить до 40, но по более высокой цене и в более медленном темпе.
Водные исследования
В водных системах проточная цитометрия используется для анализа автофлуоресцирующих клеток или клеток, которые флуоресцентно маркированы добавленными красителями. Это исследование началось в 1981 году, когда Кларис Йенч использовала проточную цитометрию для измерения флуоресценции в красном приливе, производящем динофлагеллят. [55] В следующем году исследователи опубликовали проточные цитометрические измерения нескольких видов водорослей, которые можно было различить на основе их флуоресцентных характеристик. [56] К 1983 году морские исследователи собирали свои собственные проточные цитометры [57] или использовали коммерчески доступные проточные цитометры на образцах морской воды, собранных у Бермудских островов, чтобы продемонстрировать, что клетки фитопланктона можно отличить от неживого материала и что цианобактерии можно отсортировать из смешанного сообщества и впоследствии культивировать в лаборатории. [58] Проточная цитометрия также позволила морским исследователям различать тускло флуоресцирующий Prochlorococcus и гетеротрофные микроорганизмы, различие, которое трудно провести при оценках на основе микроскопии. [59] Достижения в области технологий теперь позволяют ученым, изучающим водные ресурсы, использовать проточные цитометры непрерывно во время исследовательских круизов [60], а проточные цитометры используются для получения изображений отдельных клеток фитопланктона. [61] [62] Ученые, изучающие океан, используют сортировочную способность проточных цитометров для проведения дискретных измерений клеточной активности и разнообразия, [63] [64] для проведения исследований мутуалистических отношений между микроорганизмами, которые живут в непосредственной близости, [65] и для измерения биогеохимических скоростей множественных процессов в океане. [66]
Анализ пролиферации клеток
Пролиферация клеток является основной функцией иммунной системы. Часто требуется проанализировать пролиферативную природу клеток, чтобы сделать какие-то выводы. Одним из таких анализов для определения пролиферации клеток является отслеживающий краситель карбоксифлуоресцеин диацетат сукцинимидиловый эфир (CFSE). Он помогает контролировать пролиферативные клетки. Этот анализ дает как количественные, так и качественные данные во время экспериментов с временными рядами. [67] Этот краситель ковалентно связывается с долгоживущими молекулами, присутствующими внутри клетки. Когда клетки делятся, молекулы тоже делятся, и дочерние клетки обладают половиной красителя, чем родительская популяция. Это снижение интенсивности можно визуализировать с помощью проточной цитометрии. [68] В литературе этот мощный метод проточной цитометрии и CFSE использовался для определения эффективности Т-клеток в уничтожении целевых клеток при раке, таком как лейкемия. Для визуализации гибели целевых клеток, как быстрой, так и медленной, ученые использовали маркировку CFSE с окрашиванием антителами определенных видов клеток и флуоресцентно маркированные микрошарики. Это также дало информацию относительно пролиферации целевых клеток при обработке определенными цитокинами. [69]
Измерение размера генома
Проточная цитометрия использовалась для измерения размеров генома , или, точнее, количества ДНК в клетке или ядре . Хотя геномы можно анализировать с большей точностью с помощью геномного секвенирования , это часто бывает затруднительно из-за высокой доли микрохромосом или повторяющихся последовательностей , которые могут быть пропущены при секвенировании (или которые отфильтровываются на этапе анализа, когда их нельзя отнести к хромосомам ). Однако проточная цитометрия также не идеальна. Полученные размеры генома могут различаться в зависимости от используемого красителя. Анализ геномов рыб привел к значительно различающимся размерам генома при использовании пропидиум-йодида (PI) и DAPI соответственно. Например, было обнаружено, что геном Anguilla japonica содержит 1,09 пг ДНК с PI против 1,25 пг с DAPI. Аналогично, геном Myxocyprinus asiaticus содержал 2,75 пг ДНК (PI) против 3,08 пг (DAPI). То есть, различия были порядка 12–14%. [70]
Смотрите также
- Тканевая цитометрия — метод, который применяет концепцию проточной цитометрии к срезам тканей in situ и помогает выполнять количественную оценку маркеров, сохраняя пространственный контекст.
- Анализ аффинности аннексина А5 , тест на клетки, подвергающиеся апоптозу, часто использует проточную цитометрию.
- Анализ клеточного цикла
- Счетчик Коултера
- Цитометрия
- Диэлектрофорез
- ЕвроФлоу
- Стандарт проточной цитометрии
- Массовая цитометрия
- Микрофлуориметрия
- Анализ жизнеспособности
Примечания
- ^ Аббревиатура FACS является зарегистрированной торговой маркой и принадлежит BD Biosciences-Immunocytometry Systems, подразделению Becton-Dickinson, которое лицензировало патенты Стэнфорда. [31] [33]
Ссылки
- ^ Picot J, Guerin CL, Le Van Kim C, Boulanger CM (март 2012 г.). «Проточная цитометрия: ретроспектива, основы и современное оборудование». Cytotechnology . 64 (2): 109– 30. doi :10.1007/s10616-011-9415-0. PMC 3279584 . PMID 22271369.
- ^ "проточная цитометрия". TheFreeDictionary.com . Получено 2018-09-18 .
- ^ Шапиро ХМ (2003). Практическая проточная цитометрия (4-е изд.). Нью-Йорк: Wiley-Liss. ISBN 978-0-471-41125-3.
- ^ Givan AL (2011). "Проточная цитометрия: Введение". В Hawley T, Hawley R (ред.). Протоколы проточной цитометрии . Методы в молекулярной биологии. Т. 699. Humana Press. стр. 1– 29. doi :10.1007/978-1-61737-950-5_1. ISBN 978-1-61737-949-9. PMID 21116976.
- ^ O'Neill K, Aghaeepour N, Spidlen J, Brinkman R (декабрь 2013 г.). "Биоинформатика проточной цитометрии". PLOS Comput Biol . 9 (12): e1003365. Bibcode : 2013PLSCB...9E3365O. doi : 10.1371/journal.pcbi.1003365 . PMC 3867282. PMID 24363631 .
- ↑ US 3380584, Mack Fulwyler, «Particle Separator», выдан 1965-06-01
- ^ Fulwyler MJ (ноябрь 1965). «Электронное разделение биологических клеток по объему». Science . 150 (3698): 910– 1. Bibcode :1965Sci...150..910F. doi :10.1126/science.150.3698.910. PMID 5891056. S2CID 459342.
- ^ DE 1815352, Dittrich W, Göhde W, «Проточная камера для фотометров для измерения и подсчета частиц в дисперсионной среде», опубликовано 21 декабря 1977 г.
- ^ Osborn RA (1970). «Автоматизация цитологии». В Evans DM (ред.). Труды второго симпозиума Tenovus . 24–25 октября 1968 г. Эдинбург и Лондон: E. & S. Livingstone (опубликовано в 1971 г.). doi :10.1016/S0031-3025(16)39506-X. S2CID 58286041.
Каменцкий Л.А. (1973). «Автоматизация цитологии». Успехи биологической и медицинской физики . 14 : 93– 161. doi :10.1016/B978-0-12-005214-1.50007-8. ISBN 9780120052141. PMID 4579761. - ^ Сак У, Тарнок А, Роте Г (2006). Zelluläre Diagnostik [ Клеточная диагностика ] (на немецком языке). Издательство Каргер. ISBN 978-3-318-01217-0.
- ^ "Ресурсы и оборудование". Centenary Institute .
- ^ «BD Biosciences – Продукция по специальному заказу».
- ^ abcdefghi Cossarizza A, Chang HD, Radbruch A, Akdis M, Andrä I, Annunziato F, et al. (октябрь 2017 г.). «Руководство по использованию проточной цитометрии и сортировки клеток в иммунологических исследованиях». European Journal of Immunology . 47 (10): 1584–1797 . doi : 10.1002/eji.201646632 . PMC 9165548. PMID 29023707. S2CID 25591889 .
- ^ ab "Fluidics System - Flow Cytometry Guide". Bio-Rad . Получено 18.09.2018 .
- ^ abcd "Как работает проточный цитометр". Thermo Fisher Scientific . Получено 18.09.2018 .
- ^ Nolan JP, Condello D (январь 2013 г.). "Спектральная проточная цитометрия". Текущие протоколы в цитометрии . Глава 1 (1): 1.27.1–1.27.13. doi :10.1002/0471142956.cy0127s63. ISBN 978-0471142959. PMC 3556726 . PMID 23292705.
- ^ Han Y, Gu Y, Zhang AC, Lo YH (ноябрь 2016 г.). «Обзор: технологии визуализации для проточной цитометрии». Lab on a Chip . 16 (24): 4639– 4647. doi : 10.1039/c6lc01063f. PMC 5311077. PMID 27830849.
- ^ ab Roederer M (ноябрь 2001 г.). «Спектральная компенсация для проточной цитометрии: артефакты визуализации, ограничения и предостережения». Цитометрия . 45 (3): 194– 205. doi : 10.1002/1097-0320(20011101)45:3<194::aid-cyto1163>3.0.co;2-c . PMID 11746088.
- ^ Sharpless T, Traganos F, Darzynkiewicz Z, Melamed MR (1975). «Проточная цитофлуориметрия: различение отдельных клеток и клеточных агрегатов путем прямых измерений размера». Acta Cytologica . 19 (6): 577–81 . PMID 1108568.
- ^ ab "Таблица флуорохромов (Инструменты)". Сеть проточной цитометрии .
- ^ "Таблица флуорохромов". Архивировано из оригинала 20 октября 2014 г.
- ^ Qian Y, Wei C, Eun-Hyung Lee F, Campbell J, Halliley J, Lee JA и др. (2010). «Выявление семнадцати подмножеств В-клеток периферической крови человека и количественная оценка реакции на столбняк с использованием метода на основе плотности для автоматизированной идентификации популяций клеток в данных многомерной проточной цитометрии». Цитометрия , часть B. 78 (Приложение 1): S69-82. doi :10.1002/cyto.b.20554. PMC 3084630. PMID 20839340 .
- ^ "Immunology Database and Analysis Portal". Архивировано из оригинала 26 июля 2011 г. Получено 2009-09-03 .
- ^ Zare H, Shooshtari P, Gupta A, Brinkman RR (июль 2010 г.). «Сокращение данных для спектральной кластеризации для анализа данных высокопроизводительной проточной цитометрии». BMC Bioinformatics . 11 : 403. doi : 10.1186/1471-2105-11-403 . PMC 2923634 . PMID 20667133.
- ^ "flowClust" . Получено 2009-09-03 .
- ^ Lo K, Brinkman RR, Gottardo R (апрель 2008 г.). «Автоматизированное гейтирование данных проточной цитометрии с помощью надежной кластеризации на основе моделей». Цитометрия , часть A. 73 (4): 321–32 . doi : 10.1002/cyto.a.20531 . PMID 18307272.
- ^ Lo K, Hahne F, Brinkman RR, Gottardo R (май 2009 г.). "flowClust: пакет Bioconductor для автоматического гейтирования данных проточной цитометрии". BMC Bioinformatics . 10 : 145. doi : 10.1186/1471-2105-10-145 . PMC 2701419. PMID 19442304 .
- ^ "Анализ потока с помощью автоматизированной многомерной оценки (FLAME)". Архивировано из оригинала 21 августа 2009 г. Получено 2009-09-03 .
- ^ Wattenberg M, Viégas F, Johnson I (13 октября 2016 г.). «Как эффективно использовать t-SNE». Distill . 1 (10). doi : 10.23915/distill.00002 .
- ^ "FlowCAP – Проточная цитометрия: критическая оценка методов идентификации популяции" . Получено 2009-09-03 .
- ^ ab Perkel J (19 июля 2004 г.). «Fluorescence-Activated Cell Sorter». The Scientist . Получено 2018-09-18 .
- ^ "Record Unit 9554, The History of the Cell Sorter Interviews". Архивы Смитсоновского института . Фулвайлер, Мак Джетт. интервьюируемый, Герценберг, Леонард А. интервьюируемый, Бах, Брюс Аллен. интервьюируемый, Краснов, Марк А. интервьюируемый, Мхатре, Нагеш С. интервьюируемый. 1991. Получено 18 сентября 2018 г.
{{cite web}}: CS1 maint: другие ( ссылка ) - ^ Бушнелл Т. (2016-05-04). "12 терминов и определений проточной цитометрии, которые большинство ученых понимают неправильно". Экспертная цитометрия . Получено 18 сентября 2018 г.
- ^ Julius MH, Masuda T, Herzenberg LA (июль 1972 г.). «Демонстрация того, что антигенсвязывающие клетки являются предшественниками антителопродуцирующих клеток после очистки с помощью сортировщика клеток, активируемого флуоресценцией». Труды Национальной академии наук Соединенных Штатов Америки . 69 (7): 1934– 8. Bibcode : 1972PNAS...69.1934J. doi : 10.1073/pnas.69.7.1934 . PMC 426835. PMID 4114858 .
- ^ "Сортировка клеток – Факультет проточной цитометрии". flowcytometry.utoronto.ca . Получено 18.09.2018 .
- ^ "Конъюгация моноклональных антител". www.drmr.com . Получено 2018-09-18 .
- ^ Loken MR (1990). Методы иммунофлуоресценции в проточной цитометрии и сортировке (2-е изд.). Wiley. стр. 341–53 .
- ^ Basiji DA, Ortyn WE, Liang L, Venkatachalam V, Morrissey P (сентябрь 2007 г.). «Анализ клеточных изображений и визуализация с помощью проточной цитометрии». Clinics in Laboratory Medicine . 27 (3): 653–70 , viii. doi :10.1016/j.cll.2007.05.008. PMC 2034394. PMID 17658411.
- ^ ab Ornatsky O, Bandura D, Baranov V, Nitz M, Winnik MA, Tanner S (сентябрь 2010 г.). "Высоко многопараметрический анализ с помощью массовой цитометрии". Журнал иммунологических методов . 361 ( 1– 2): 1– 20. doi :10.1016/j.jim.2010.07.002. PMID 20655312.
- ^ Sun T, Morgan H (апрель 2010 г.). «Микрофлюидная импедансная цитометрия отдельных клеток: обзор». Microfluidics and Nanofluidics . 8 (4): 423– 443. doi :10.1007/s10404-010-0580-9. S2CID 95631023.
- ^ Cheung KC, Di Berardino M, Schade-Kampmann G, Hebeisen M, Pierzchalski A, Bocsi J, et al. (Июль 2010 г.). «Проточная цитометрия на основе микрожидкостного импеданса». Цитометрия , часть A. 77 (7): 648–66 . doi : 10.1002/cyto.a.20910 . PMID 20583276.
- ^ "Протокол окрашивания проточной цитометрии (FACS) (Окрашивание поверхности клеток)". Йельская медицинская школа – Йельская проточная цитометрия . Получено 2023-10-17 .
- ^ "Проточная цитометрия – типы, назначение, реагенты, примеры, применение". microbiologynote.com . 2022-10-18 . Получено 2023-06-27 .
- ^ Zamora JL, Aguilar HC (февраль 2018 г.). «Проточная вирометрия как инструмент для изучения вирусов». Методы . 134– 135: 87– 97. doi :10.1016/j.ymeth.2017.12.011. PMC 5815898. PMID 29258922 .
- ^ Murphy RW, Lowcock LA, Smith C, Darevsky IS, Orlov N, MacCulloch RD, Upton DE (1997). «Проточная цитометрия в исследованиях биоразнообразия: методы, полезность и ограничения». Amphibia-Reptilia . 18 : 1–13 . doi :10.1163/156853897x00260.
- ^ Gorczyca W, Traganos F, Jesionowska H, Darzynkiewicz Z (июль 1993 г.). «Наличие разрывов нитей ДНК и повышенная чувствительность ДНК in situ к денатурации в аномальных человеческих сперматозоидах: аналогия апоптозу соматических клеток». Experimental Cell Research . 207 (1): 202– 5. doi :10.1006/excr.1993.1182. PMID 8391465.
- ^ Evenson DP (сентябрь 2017 г.). «Оценка структуры хроматина сперматозоидов и разрывов нитей ДНК является важной частью клинической оценки мужской фертильности». Трансляционная андрология и урология . 6 (Приложение 4): S495 – S500 . doi : 10.21037/tau.2017.07.20 . PMC 5643675. PMID 29082168 .
- ^ Tanaka T, Halicka HD, Huang X, Traganos F, Darzynkiewicz Z (сентябрь 2006 г.). «Конститутивное фосфорилирование гистона H2AX и активация ATM, репортеры повреждения ДНК эндогенными окислителями». Cell Cycle . 5 (17): 1940– 5. doi :10.4161/cc.5.17.3191. PMC 3488278 . PMID 16940754.
- ^ MacPhail SH, Banáth JP, Yu Y, Chu E, Olive PL (июнь 2003 г.). «Зависящая от клеточного цикла экспрессия фосфорилированного гистона H2AX: сниженная экспрессия в необлученных, но не облученных рентгеновским излучением клетках фазы G1». Radiation Research . 159 (6): 759– 67. Bibcode : 2003RadR..159..759M. doi : 10.1667/rr3003. PMID 12751958. S2CID 26093456.
- ^ Darzynkiewicz Z, Juan G, Li X, Gorczyca W, Murakami T, Traganos F (январь 1997). "Цитометрия в клеточной некробиологии: анализ апоптоза и случайной гибели клеток (некроза)". Цитометрия . 27 (1): 1– 20. doi : 10.1002/(SICI)1097-0320(19970101)27:1<1::AID-CYTO2>3.0.CO;2-L . PMID 9000580.
- ^ Edgar RH, Noel C, Minard A, Fernandez R, Fitzpatrick M, Sajewski A и др. (2019-02-27). «Идентификация инфекции MRSA в крови с помощью фотоакустической проточной цитометрии». В Wang L, Oraevsky AA (ред.). Photons Plus Ultrasound: Imaging and Sensing 2019. Vol. 10878. International Society for Optics and Photonics. p. 1087860. Bibcode : 2019SPIE10878E..60E. doi : 10.1117/12.2510210. ISBN 9781510623989. S2CID 86428267.
- ^ Menon V, Thomas R, Ghale AR, Reinhard C, Pruszak J (декабрь 2014 г.). «Протоколы проточной цитометрии для анализа поверхностных и внутриклеточных антигенов нервных типов клеток». Journal of Visualized Experiments (94): e52241. doi :10.3791/52241. PMC 4396953 . PMID 25549236.
- ^ Antypas H, Veses-Garcia M, Weibull E, Andersson-Svahn H, Richter-Dahlfors A (июнь 2018 г.). «Универсальная платформа для отбора и фенотипического скрининга бактериальных мутантов с высоким разрешением с использованием слайда nanowell». Lab on a Chip . 18 (12): 1767– 1777. doi :10.1039/c8lc00190a. PMC 5996734. PMID 29781496.
- ^ Davey HM (август 2011 г.). «Жизнь, смерть и промежуточное положение: значения и методы в микробиологии». Прикладная и экологическая микробиология . 77 (16): 5571– 6. Bibcode : 2011ApEnM..77.5571D. doi : 10.1128/AEM.00744-11. PMC 3165249. PMID 21705550 .
- ^ Yentsch CM (1981). "Проточный цитометрический анализ клеточного сакситоксина в динофлагеллятах Gonyaulax tamarensis var. excavata". Toxicon . 19 (5): 611– 21. Bibcode : 1981Txcn...19..611Y. doi : 10.1016/0041-0101(81)90099-4. PMID 7197816.
- ^ Trask, BJ; Engh, GJ van den; Elgershuizen, JHBW (1982). «Анализ фитопланктона методом проточной цитометрии». Цитометрия . 2 (4): 258–264 . doi : 10.1002/cyto.990020410 . ISSN 1097-0320. PMID 6799265.
- ^ Olson, Robert J.; Frankel, Sheila L.; Chisholm, Sallie W.; Shapiro, Howard M. (1983-04-08). "Недорогой проточный цитометр для анализа сигналов флуоресценции в фитопланктоне: распределение хлорофилла и ДНК". Journal of Experimental Marine Biology and Ecology . 68 (2): 129– 144. Bibcode :1983JEMBE..68..129O. doi :10.1016/0022-0981(83)90155-7. ISSN 0022-0981.
- ^ Yentsch CM, Horan PK, Muirhead K, Dortch Q, Haugen E, Legendre L, et al. (1983). «Проточная цитометрия и сортировка клеток: метод анализа и сортировки водных частиц1». Лимнология и океанография . 28 (6): 1275–1280 . Bibcode : 1983LimOc..28.1275Y. doi : 10.4319/lo.1983.28.6.1275 . ISSN 1939-5590.
- ^ Chisholm SW, Olson RJ, Zettler ER, Goericke R, Waterbury JB, Welschmeyer NA (июль 1988 г.). «Новый свободноживущий прохлорофит, распространенный в океанической эвфотической зоне». Nature . 334 (6180): 340– 343. Bibcode :1988Natur.334..340C. doi :10.1038/334340a0. S2CID 4373102.
- ^ Swalwell JE, Ribalet F, Armbrust EV (2011). «SeaFlow: новый проточный цитометр для непрерывных наблюдений за фитопланктоном в океане». Лимнология и океанография: Методы . 9 (10): 466– 477. Bibcode : 2011LimOM...9..466S. doi : 10.4319/lom.2011.9.466 . ISSN 1541-5856.
- ^ Olson RJ, Sosik HM (2007). "Погружной прибор для визуализации в потоке для анализа нано- и микропланктона: Imaging FlowCytobot". Лимнология и океанография: Методы . 5 (6): 195–203 . Bibcode : 2007LimOM...5..195O. doi : 10.4319/lom.2007.5.195 .
- ^ Jakobsen HH, Carstensen J (2011). "FlowCAM: Определение размеров клеток и понимание влияния распределения размеров на биообъем структуры планктонного сообщества". Aquatic Microbial Ecology . 65 (1): 75–87 . doi : 10.3354/ame01539 . ISSN 0948-3055.
- ^ Longnecker K, Sherr BF, Sherr EB (декабрь 2005 г.). «Активность и филогенетическое разнообразие бактериальных клеток с высоким и низким содержанием нуклеиновой кислоты и активность системы электронного транспорта в экосистеме восходящего потока». Applied and Environmental Microbiology . 71 (12): 7737– 49. Bibcode :2005ApEnM..71.7737L. doi :10.1128/AEM.71.12.7737-7749.2005. PMC 1317353 . PMID 16332746.
- ^ Stepanauskas R, Sieracki ME (май 2007). «Соответствие филогении и метаболизма в некультивируемых морских бактериях, по одной клетке за раз». Труды Национальной академии наук Соединенных Штатов Америки . 104 (21): 9052– 7. Bibcode : 2007PNAS..104.9052S . doi : 10.1073/pnas.0700496104 . PMC 1885626. PMID 17502618.
- ^ Thompson AW, Foster RA, Krupke A, Carter BJ, Musat N, Vaulot D и др. (сентябрь 2012 г.). «Одноклеточная цианобактерия, симбиотическая с одноклеточной эукариотической водорослью». Science . 337 (6101): 1546– 50. Bibcode :2012Sci...337.1546T. doi :10.1126/science.1222700. PMID 22997339. S2CID 7071725.
- ^ Ломас, Майкл В.; Бронк, Дебора А.; ван ден Энг, Джер (15.01.2011). «Использование проточной цитометрии для измерения биогеохимических скоростей и процессов в океане». Annual Review of Marine Science . 3 (1): 537– 566. Bibcode : 2011ARMS....3..537L. doi : 10.1146/annurev-marine-120709-142834. ISSN 1941-1405. PMID 21329216.
- ^ Hawkins ED, Hommel M, Turner ML, Battye FL, Markham JF, Hodgkin PD (2007). «Измерение пролиферации, выживания и дифференциации лимфоцитов с использованием данных временных рядов CFSE». Nature Protocols . 2 (9): 2057– 67. doi :10.1038/nprot.2007.297. PMID 17853861. S2CID 13550456.
- ^ Quah BJ, Parish CR (октябрь 2010 г.). «Использование сукцинимидилового эфира диацетата карбоксифлуоресцеина (CFSE) для мониторинга пролиферации лимфоцитов». Журнал визуализированных экспериментов (44). doi :10.3791/2259. PMC 3185625. PMID 20972413 .
- ^ Jedema I, van der Werff NM, Barge RM, Willemze R, Falkenburg JH (апрель 2004 г.). «Новый анализ на основе CFSE для определения восприимчивости к лизису цитотоксическими Т-клетками лейкозных клеток-предшественников в гетерогенной популяции клеток-мишеней». Blood . 103 (7): 2677– 82. doi : 10.1182/blood-2003-06-2070 . PMID 14630824. S2CID 1984056.
- ^ Чжу, Дунмэй; Сун, Вэнь; Ян, Кунь; Цао, Сяоцзюань; Гуль, Ясмин; Ван, Вэймин (2012). «Определение размера генома восьми коммерчески важных видов рыб в Китае методом проточной цитометрии». In Vitro Cellular & Developmental Biology. Animal . 48 (8): 507– 517. doi :10.1007/s11626-012-9543-7. ISSN 1071-2690. JSTOR 23279365. PMID 22956044. S2CID 255351169.
Дальнейшее чтение
- Carey JL, McCoy Jr JP, Keren DF (2007). Проточная цитометрия в клинической диагностике (4-е изд.). Чикаго, Иллинойс: American Society for Clinical Pathology (ASCP) Press. ISBN 978-0-89189-548-0.
- Darzynkiewicz Z, Roederer M, Tanke HJ, ред. (2004). Методы в клеточной биологии, цитометрия . Т. 75 (4-е изд.). Elsevier /Academic Press. ISBN 0-12-480283-4.
- Darzynkiewicz Z, Robinson JP, Roederer M (2009). Основные методы цитометрии (1-е изд.). Амстердам: Elsevier/Academic Press. ISBN 978-0-12-375045-7.
- Darzynkiewicz Z, et al., eds. (2011). Последние достижения в цитометрии. Часть A. Методы в клеточной биологии. Том 102. Elsevier/Academic Press. ISBN 978-0-12-374912-3.
- Darzynkiewicz Z, et al., eds. (2011). Последние достижения в цитометрии. Часть B. Методы в клеточной биологии. Том 103. Elsevier/Academic Press. ISBN 978-0-12-385493-3.
- Ллойд Д. (1993). Проточная цитометрия в микробиологии . Лондон: Springer-Verlag. ISBN 978-3-540-19796-6.
- Ormerod MG (1999). Проточная цитометрия (2-е изд.). Оксфорд, Великобритания: Bios Scientific Publishers. ISBN 978-1-85996-107-0.
- Ormerod MG, ред. (2000). Проточная цитометрия: практический подход (3-е изд.). Оксфорд [Англия]: Oxford University Press. ISBN 978-0-19-963824-6.
- Ормерод М.Г. (2008). Проточная цитометрия: базовое введение. Редхилл: М.Г. Ормерод. ISBN 978-0-9559812-0-3.
- Робинсон Дж. П. и др. (1993). Справочник по методам проточной цитометрии . Нью-Йорк: Wiley-Liss. ISBN 978-0-471-59634-9.
- Шапиро ХМ (2003). Практическая проточная цитометрия (4-е изд.). Нью-Йорк: Wiley-Liss. ISBN 978-0-471-41125-3.
- Склар LA (2005). Проточная цитометрия для биотехнологии . Нью-Йорк: Oxford University Press. ISBN 978-0-19-515234-0.
Внешние ссылки
 Медиа, связанные с проточной цитометрией на Wikimedia Commons
Медиа, связанные с проточной цитометрией на Wikimedia Commons- Проточная цитометрия в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)

