Бактериальный дисплей
Бактериальный дисплей (или бактериальный дисплей или бактериальный поверхностный дисплей ) — это метод белковой инженерии, используемый для эволюции белков in vitro . Библиотеки полипептидов , отображаемых на поверхности бактерий, можно скринировать с помощью проточной цитометрии или процедур итеративного отбора (биопэннинга). Этот метод белковой инженерии позволяет нам связать функцию белка с геном, который его кодирует. Бактериальный дисплей можно использовать для поиска целевых белков с желаемыми свойствами, а также для создания аффинных лигандов , специфичных для клеток. Эту систему можно использовать во многих приложениях, включая создание новых вакцин, идентификацию субстратов ферментов и поиск сродства лиганда к его целевому белку.
Бактериальный дисплей часто сочетается с методами сортировки клеток с магнитной активацией (MACS) или сортировки клеток с флуоресценцией (FACS). Конкурирующими методами эволюции белков in vitro являются фаговый дисплей , рибосомный дисплей , дрожжевой дисплей и мРНК-дисплей . Бактериофаговый дисплей является наиболее распространенным типом используемой системы отображения [1], хотя бактериальный дисплей становится все более популярным по мере преодоления технических трудностей. Бактериальный дисплей в сочетании с FACS также имеет то преимущество, что это метод в реальном времени.
История
Системы отображения клеток были впервые использованы в 1985 году, когда пептиды были генетически слиты с белками, отображаемыми на бактериофаге M13 . Бактериофаговый дисплей является широко используемой системой отображения клеток, хотя он имеет ограничения по размеру отображаемых белков. Бактериальный дисплей был затем представлен в 1986 году, что позволило отображать на поверхности более крупные белки. Системы отображения бактерий были впервые представлены Фрейдлом и др. и Чарбитом и др. в 1986 году, когда они использовали бактериальные поверхностные белки OmpA и LamB для отображения пептидов. Фрейдл и др. слили пептиды с линкерами с геном ompA , заставив пептиды экспрессироваться в белках OmpA. Они показали, что теперь белки подвергаются расщеплению протеиназой K. Вставленные не-OmpA пептиды, таким образом, были мишенью протеиназы K. Вставка чужеродных пептидов не повлияла на рост бактериальных клеток. Чарбит и др. Сначала они определили области белка LamB, которые были «разрешены» для вставки чужеродного пептида ( т.е. не приводили к полной потере функциональности белка). Затем они исследовали универсальность разрешающих участков (ограничение размера, природа эпитопа,...), которые все были расположены в поверхностных петлях тримерного внешнего мембранного порина, с целью разработки многовалентных живых бактериальных вакцин (12-15). Это было первое доказательство использования методов бактериального поверхностного дисплея для экспрессии белков на поверхности клеток без изменения функции клетки. [2]
Принцип
Пептиды очень полезны в качестве терапевтических и диагностических веществ. Их использование становится все более популярным, и системы отображения предлагают полезный способ конструирования пептидов и оптимизации их связывающих способностей. Клетки экспрессируют поверхностные белки, которые могут быть вовлечены в целый ряд реакций, включая распознавание других клеток, взаимодействие с другими клетками и клеточную сигнализацию . Многие типы бактерий имеют клеточные поверхностные белки, такие как энтеропатогенный белок интимин E. coli , который участвует в связывании с клетками-хозяевами, или белок OmpA клеток E. coli , который важен для поддержания структуры внешней мембраны . [3] Многие поверхностные белки участвуют в прикреплении бактериальных клеток и вторжении в клетку-хозяина. Используя бактериальный дисплей, можно идентифицировать целевые белки на клетке-хозяине. Эти поверхностные белки необходимо сначала переместить через мембраны бактериальных клеток из цитоплазмы на поверхность клетки. Грамотрицательные бактерии имеют дополнительное периплазматическое пространство , которого нет у грамположительных бактерий , поэтому им сложнее перемещать белки. Для отображения гетерологичных белков на поверхности бактериальной клетки обычно требуется слияние белка с поверхностным белком, называемым каркасом.
Строительные леса
Скаффолды используются для отображения гетерологичного белка на поверхности бактериальной клетки. Существуют различные используемые скаффолды, такие как белки внешней мембраны, белки фимбрий/жгутиков и CPX (круговой пермутированный OmpX). [4] Скаффолд CPX позволяет пептидное слияние на обоих концах скаффолда.
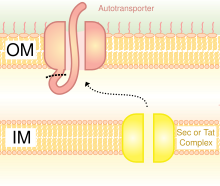
OMP являются обычными каркасами для бактериального дисплея. Белки также могут быть отображены на поверхности бактериальной клетки с помощью аутотранспортеров. Аутотранспортеры являются частью системы секреции типа V. Обычно они имеют три домена: лидерную последовательность на N-конце; центральный домен пассажира; домен аутотранспортера на C-конце. Гетерологичный белок вставляется в домен пассажира. [5] Другим методом слияния гетерологичных белков является слияние с фимбриями / жгутиками , которые представляют собой нитевидные выступы на поверхности клетки. Существует много фимбрий на в основном грамотрицательных бактериях, поэтому отображение белков на фимбриях имеет преимущество перед некоторыми другими поверхностными белками, которые менее многочисленны. Недостатком использования фимбрий является то, что существует относительно небольшой предел размера вставки в 10-30 аминокислот . [6]

После слияния гетерологичного белка с поверхностным белком бактериальной клетки он подвергается воздействию фермента , клетки (экспрессирующей целевой белок) или антитела (обычно флуоресцентно меченого ), в зависимости от применения эксперимента. Затем образец пропускается через луч света во время FACS в очень узком потоке жидкости, так что за раз может пройти только одна клетка, и обнаруживается испускаемая флуоресценция. Информацию о размере клетки можно получить путем рассеивания света, и если произошло связывание гетерологичного белка с целевым белком/клеткой, будет испускаться больше флуоресценции.
Приложения
Бактериальный поверхностный дисплей может использоваться для различных приложений. Они включают скрининг на основе аффинности, картирование эпитопов антител , идентификацию пептидных субстратов, идентификацию пептидов, связывающихся с клетками, и генерацию вакцин. [7]
Скрининг на основе аффинности
Скрининг используется для поиска очевидных сродств гетерологичных белков, отображаемых на поверхности бактериальной клетки, к целевым белкам. Этот метод обычно сочетается с FACS, и добавление нефлуоресцентного конкурента целевого белка полезно для получения более точных сродств связывания. Добавление конкурента снижает вероятность повторного связывания целевых белков, что может сделать сродство связывания менее точным.
Скрининг циклических пептидных связующих
Циклические пептиды могут быть успешно отображены на поверхности бактериальных клеток. [8] Путем рандомизации ДНК миллионы циклических пептидов, отображенных на поверхности клеток, могут быть проверены на соответствие целевому белку с использованием высокопроизводительного FACS. [9]
Картирование эпитопов антител
Картирование эпитопа антитела используется для определения специфичности антитела. Эпитоп (сайт связывания антитела с антигенами) экспрессируется на поверхности бактериальной клетки путем экспрессии области гена, кодирующего антиген. Проточная цитометрия с флуоресцентно-мечеными антителами используется для определения количества антител, связывающихся с эпитопом. [10]
Идентификация пептидных субстратов
Это можно применять для поиска лучших субстратов для протеолитических ферментов . Субстрат отображается на поверхности бактериальной клетки между аффинным лигандом и каркасом, а кинетика протеолиза субстрата измеряется с помощью FACS.
Идентификация пептидов, связывающихся с клетками
Бактериальный дисплей может использоваться для поиска пептидов, которые связываются с определенными клетками, например, клетками рака груди или стволовыми клетками . Отображаемые белки флуоресцентно помечены GFP , поэтому связывающие взаимодействия между пептидами и целевыми клетками можно увидеть с помощью проточной цитометрии. Контрольные образцы требуются для измерения уровней флуоресценции в отсутствие отображаемых пептидов. Также требуются образцы, которые не содержат отображаемых пептидов, но содержат клетки млекопитающих и бактериальные клетки (включая каркас).
Доставка вакцины
Доставка вакцины является очень распространенным применением бактериального поверхностного дисплея. Существует два типа живых бактериальных вакцин, которые можно изготовить:
- Обычно патогенные бактерии ослабевают и перестают быть патогенными.
- Комменсальные или пищевые бактерии, которые не являются патогенными.
Использование бактериального поверхностного отображения антигенов является ценной альтернативой традиционному дизайну вакцин по разным причинам, одна из которых заключается в том, что белки, экспрессируемые на поверхности бактериальных клеток, могут действовать благоприятно в качестве адъюванта . Традиционные вакцины требуют добавления адъювантов. Еще одним преимуществом создания вакцин с использованием систем бактериального отображения является то, что вся бактериальная клетка может быть включена в живую вакцину [11]. В отличие от систем бактериофагового отображения, которые обычно используются при разработке вакцин для поиска неизвестных эпитопов, системы бактериального отображения используются для экспрессии известных эпитопов, а клетки действуют как система доставки вакцины. [12]
Сравнение с фаговым дисплеем
В аналогичных условиях отбор бактериально-экспонированных пептидов для моделирования белка стрептавидина оказался хуже. [13]
Ссылки
- ^ Kenrick SA, Daugherty PS (2010). «Бактериальный дисплей обеспечивает эффективное и количественное созревание пептидного сродства». Protein Eng Des Sel . 23 (1): 9–17. doi :10.1093/protein/gzp065. PMC 2791049. PMID 19903738 .
- ^ Freudl R, MacIntyre S, Degen M, Henning U (1986). "Экспозиция внешней мембраны белка OmpA Escherichia coli K-12 на поверхности клетки". J Mol Biol . 188 (3): 491–4. doi :10.1016/0022-2836(86)90171-3. PMID 3525847.
- ^ Wang Y (2002). «Функция OmpA в Escherichia coli». Biochem Biophys Res Commun . 292 (2): 396–401. doi :10.1006/bbrc.2002.6657. PMID 11906175.
- ^ Getz JA, Schoep TD, Daugherty PS (2012). «Обнаружение пептидов с использованием бактериального дисплея и проточной цитометрии». Белковая инженерия для терапии, часть B. Методы в энзимологии. Том 503. стр. 75–97. doi :10.1016/B978-0-12-396962-0.00004-5. ISBN 9780123969620. PMID 22230566.
- ^ Wernerus H, Stahl S (2004). «Биотехнологические применения поверхностно-инженерных бактерий». Biotechnol Appl Biochem . 40 (Pt 3): 209–28. doi :10.1042/BA20040014. PMID 15035661. S2CID 9395029.
- ^ Клемм П., Шембри МА (2000). «Бактериальные адгезины: функция и структура». Int J Med Microbiol . 290 (1): 27–35. doi :10.1016/S1438-4221(00)80102-2. PMID 11043979.
- ^ Догерти PS (2007). «Белковая инженерия с бактериальным дисплеем». Curr Opin Struct Biol . 17 (4): 474–80. doi :10.1016/j.sbi.2007.07.004. PMID 17728126.
- ^ Palei, Shubhendu; Becher, Kira S.; Nienberg, Christian; Jose, Joachim; Mootz, Henning D. (2019-01-02). «Отображение полусинтетических циклических пептидов на поверхности бактериальных клеток». ChemBioChem . 20 (1): 72–77. doi : 10.1002/cbic.201800552 . ISSN 1439-4227. PMID 30216604. S2CID 52277462.
- ^ Palei, Shubhendu; Jose, Joachim; Mootz, Henning D. (2022), Coppock, Matthew B.; Winton, Alexander J. (ред.), «Подготовка полусинтетических циклических пептидов, отображаемых на поверхности бактериальных клеток», Peptide Macrocycles , Methods in Molecular Biology, т. 2371, New York, NY: Springer US, стр. 193–213, doi : 10.1007/978-1-0716-1689-5_11, ISBN 978-1-0716-1688-8, PMID 34596850, S2CID 238237296 , получено 2022-05-12
- ^ Rockberg J, Lofblom J, Hjelm B, Uhlen M, Stahl S (2008). «Картирование эпитопов антител с использованием отображения на бактериальной поверхности». Nature Methods . 5 (12): 1039–45. doi :10.1038/nmeth.1272. PMID 19029907. S2CID 12078882.
- ^ Вестерлунд-Викстром Б. (2000). «Пептидный дисплей на бактериальных жгутиках: принципы и применение». Int J Med Microbiol . 290 (3): 223–30. doi :10.1016/S1438-4221(00)80119-8. PMID 10959724.
- ^ Бенхар I (2001). «Биотехнологические применения фагового и клеточного дисплея». Biotechnology Advances . 19 (1): 1–33. doi :10.1016/S0734-9750(00)00054-9. PMID 14538090.
- ^ Lunder, et al. (2005). «Сравнение библиотек пептидов бактериального и фагового отображения в поисках мотива связывания с мишенью». Прикладная биохимия и биотехнология . 127 (2): 125–131. doi :10.1385/ABAB:127:2:125. PMID 16258189. S2CID 45243314.
12. Charbit A, Boulain JC, Ryter A, Hofnung M. Исследование топологии бактериального мембранного белка путем генетической вставки чужеродного эпитопа; экспрессия на поверхности клетки. EMBO J. 1986 ноябрь;5(11):3029-37.
13. Charbit A, Sobczak E, Michel ML, Molla A, Tiollais P, Hofnung M. Презентация двух эпитопов preS2-региона вируса гепатита B на живых рекомбинантных бактериях. J Immunol. 1 сентября 1987 г.;139(5):1658-64.
14. Charbit A, Molla A, Saurin W, Hofnung M. Универсальность вектора для экспрессии чужеродных полипептидов на поверхности грамотрицательных бактерий. Gene. 1988 15 октября;70(1):181-9.
15. Ньютон SM, Клебба PE, Мишель V, Хофнунг M, Чарбит A. Топология мембранного белка LamB с помощью эпитопной маркировки и сравнение с рентгеновской моделью. J Bacteriol. 1996 Jun;178(12):3447-56.