Этенон
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Этенон [1] | |
| Другие имена Кетен Карбометен Кето-этилен | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| 1098282 | |
| ХЭБИ | |
| ChemSpider | |
| Информационная карта ECHA | 100.006.671 |
| Номер ЕС |
|
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С2Н2О | |
| Молярная масса | 42,037 г/моль |
| Появление | Бесцветный газ. |
| Запах | проникающий |
| Плотность | 1,93 г/см 3 |
| Температура плавления | −150,5 °C (−238,9 °F; 122,6 К) |
| Точка кипения | −56,1 °C (−69,0 °F; 217,1 К) |
| разлагается | |
| Растворимость | растворим в ацетоне этаноле этиловом эфире ароматических растворителях галогенуглеродах |
| Давление пара | >1 атм (20°C) [2] |
Показатель преломления ( nD ) | 1.4355 |
| Термохимия | |
Теплоемкость ( С ) | 51,75 Дж/К моль |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | -87,24 кДж/моль |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | −107 °C (−161 °F; 166 K) |
| Пределы взрывоопасности | 5,5-18% |
| Смертельная доза или концентрация (ЛД, ЛК): | |
LD 50 ( средняя доза ) | 1300 мг/кг (перорально, крыса) |
LC 50 ( средняя концентрация ) | 17 ppm (мышь, 10 мин) [3] |
LC Lo ( самый низкий опубликованный ) | 23 ppm (мышь, 30 мин) 53 ppm (кролик, 2 ч) 53 ppm (морская свинка, 2 ч) 750 ppm (кошка, 10 мин) 200 ppm (обезьяна, 10 мин) 50 ppm (мышь, 10 мин) 1000 ppm (кролик, 10 мин) [3] |
| NIOSH (пределы воздействия на здоровье в США): | |
PEL (допустимый) | TWA 0,5 частей на миллион (0,9 мг/м 3 ) [2] |
ОТВ (рекомендуется) | TWA 0,5 ppm (0,9 мг/м 3 ) ST 1,5 ppm (3 мг/м 3 ) [2] |
IDLH (Непосредственная опасность) | 5 частей на миллион [2] |
| Паспорт безопасности (SDS) | Внешний ПБС |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Этенон — это официальное название кетена , органического соединения с формулой C2H2O или H2C =C=O . Это простейший член класса кетенов . Это важный реагент для ацетилирования . [ 4] [ 5]
Характеристики
Этенон является высокореактивным газом (при стандартных условиях ) и имеет резкий раздражающий запах. Он достаточно стабилен только при низких температурах (−80 °C). Поэтому его всегда следует готовить для каждого использования и обрабатывать немедленно, в противном случае происходит димеризация в дикетен или он реагирует с полимерами, с которыми трудно обращаться. Содержание полимера, образующегося во время приготовления, уменьшается, например, путем добавления диоксида серы к газу кетена. [6] Из-за своих кумулятивных двойных связей этенон является высокореактивным и реагирует в реакции присоединения H-кислотных соединений с соответствующими производными уксусной кислоты. Например, он реагирует с водой с образованием уксусной кислоты или с первичными или вторичными аминами с образованием соответствующих ацетамидов .
Подготовка
Этенон получают путем термической дегидратации уксусной кислоты при температуре 700–750 °C в присутствии триэтилфосфата в качестве катализатора: [7] [8]
- CH 3 CO 2 H → CH 2 =C=O + H 2 O
Его также производили в лабораторных масштабах путем термолиза ацетона при температуре 600–700 °C . [9] [10]
- СН 3 СОСН 3 →СН 2 =С=О + СН 4
Эта реакция называется синтезом кетена Шмидлина. [11]
В лабораторных условиях его можно получить путем термического разложения кислоты Мельдрума при температурах выше 200 °C. [ необходима ссылка ]
История
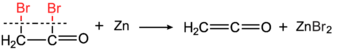
При пропускании через нагретые трубы или электрически нагретые металлические (например, медные ) провода при температуре 500-600 °C в присутствии сероуглерода ацетон разлагается на метан и этенон с выходом 95%. [12] [13] Этенон был открыт в то же время Германом Штаудингером (реакцией бромацетилбромида с металлическим цинком ) [14] [15] О дегидратации уксусной кислоты было сообщено в 1910 году. [16]
Также было описано термическое разложение уксусного ангидрида. [17]



Естественное явление
Этенон был обнаружен в космосе, в кометах или в газе как часть межзвездной среды. [18]
Использовать
Этенон используется для получения уксусного ангидрида из уксусной кислоты . Обычно он используется для ацетилирования химических соединений. [19]
Этенон реагирует с метанал в присутствии катализаторов, таких как кислоты Льюиса (AlCl 3 , ZnCl 2 или BF 3 ), давая β-пропиолактон . [20] Технически наиболее значимым применением этенона является синтез сорбиновой кислоты путем реакции с 2-бутеналем (кротоновым альдегидом) в толуоле при температуре около 50 °C в присутствии цинковых солей длинноцепочечных карбоновых кислот. Это дает полиэфир 3 -гидрокси-4-гексеновой кислоты, который термически [21] или гидролитически деполимеризуется до сорбиновой кислоты.
Этенон очень реактивен, имеет тенденцию реагировать с нуклеофилами с образованием ацетильной группы . Например, он реагирует с водой с образованием уксусной кислоты ; [22] с уксусной кислотой с образованием уксусного ангидрида ; с аммиаком и аминами с образованием этанамидов; [23] и с сухими галогенидами водорода с образованием ацетилгалогенидов. [24]
Образование уксусной кислоты, вероятно, происходит путем первоначального образования 1,1-дигидроксиэтена , который затем таутомеризуется с образованием конечного продукта. [25]
Этенон также будет реагировать сам с собой через [2 + 2] фотоциклоприсоединения с образованием циклических димеров , известных как дикетены . По этой причине его не следует хранить в течение длительного времени. [26]
Опасности
Воздействие концентрированных уровней вызывает у людей раздражение таких частей тела, как глаза , нос , горло и легкие . Расширенные испытания на токсичность на мышах, крысах, морских свинках и кроликах показали, что десятиминутное воздействие концентраций свежесгенерированного этенона всего лишь 0,2 мг/л (116 ppm ) может привести к высокому проценту смертей у мелких животных. Эти результаты показывают, что этенон токсикологически идентичен фосгену . [27] [19]
Образование кетена при пиролизе ацетата витамина Е , добавки к некоторым продуктам электронных жидкостей , является одним из возможных механизмов зарегистрированного повреждения легких [28], вызванного использованием электронных сигарет. [29] В ряде патентов описывается каталитическое образование кетена из карбоновых кислот и ацетатов с использованием различных металлов или керамики, некоторые из которых, как известно, встречаются в электронных сигаретах у пациентов с повреждением легких, связанным с использованием электронных сигарет или вейпинга (EVALI). [30] [31]
Пределы профессионального воздействия установлены на уровне 0,5 частей на миллион (0,9 мг/м 3 ) в течение восьмичасового средневзвешенного по времени периода. [32] Предел IDLH установлен на уровне 5 частей на миллион, поскольку это самая низкая концентрация, вызывающая клинически значимую физиологическую реакцию у людей. [33]
Ссылки
- ^ "Front Matter". Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. стр. 723. doi :10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ abcd Карманный справочник NIOSH по химическим опасностям. "#0367". Национальный институт охраны труда и здоровья (NIOSH).
- ^ ab "Кетене". Концентрации, представляющие немедленную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда и техники безопасности (NIOSH).
- ^ Миллер, Раймунд; Абечерли, Клаудио; Саид, Адель; Джексон, Барри (2001). «Кетенес». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a15_063. ISBN 3527306730.
- ^ Mitzel, Thomas M.; Pigza, Julie A. (2009). "Кетены". Энциклопедия реагентов для органического синтеза . doi :10.1002/047084289X.rk000.pub2. ISBN 978-0-471-93623-7.
- ^ EP 0377438, R. Bergamin et al., выдан 1990-06-11, присвоен Lonza AG
- ^ Миллер, Раймунд; Абаехерли, Клаудио; Саид, Адель; Джексон, Барри (2001). «Кетены». Энциклопедия промышленной химии Ульмана . doi :10.1002/14356007.a15_063. ISBN 978-3-527-30385-4.
- ^ Арпе, Ханс-Юрген (2007), Industrielle Organische Chemie: Bedeutende vor- und Zwischenprodukte (на немецком языке) (6-е изд.), Weinheim: Wiley-VCH , стр. 200–201, ISBN 978-3-527-31540-6[ постоянная мертвая ссылка ]
- ^ Weygand C (1972). Hilgetag G, Martini A (ред.). Weygand/Hilgetag Preparative Organic Chemistry (4-е изд.). Нью-Йорк: John Wiley & Sons, Inc. стр. 1031–1032. ISBN 978-0471937494.
- ^ Hurd CD, Kamm O (1941). "Кетены в органических синтезах". Organic Syntheses . Vol. Collective Vol. 1. p. 330.
- ^ Шмидлин Дж, Бергман М (1910). «Darstellung des Ketens aus Aceton» [Получение кетена из ацетона]. Berichte der Deutschen Chemischen Gesellschaft (на немецком языке). 43 (3): 2821–2823. дои : 10.1002/cber.19100430340.
- ^ К.-Х. Лаутеншлегер, В. Шретер, А. Ваннингер, «Taschenbuch der Chemie», 20. Aufl. 2006, ISBN 978-3-8171-1761-1 .
- ^ "Кетены". Органические синтезы . doi :10.15227/orgsyn.004.0039.
- ^ Х. Штаудингер Х. В. Клевер (1908): «Кетен. Bemerkung zur Abhandlung zur Abhandlung der HHrn. VT Wilsmore und AW Stewart». Berichte der deutschen chemischen Gesellschaft , том 41, выпуск 1, страницы 1516-1517. дои : 10.1002/cber.190804101275
- ^ Тидвелл, Т.Т. (2005), «Ein Jahrhundert Ketene (1905–2005): die Entdeckung einer vielseitigen Klasse reaktiver Intermediate». Angewandte Chemie , том 117, страницы 5926–5933. дои : 10.1002/ange.200500098
- ^ Дж. Шмидлин, М. Бергман (1910): Berichte der deutschen chemischen Gesellschaft , том 43, страницы 2821- doi : 10.1002/cber.19100430340
- ^ Норман Томас Мортимер Уилсмор (1907): "Кетен". Журнал химического общества, Труды , том 91, статья CLXXXVIII (188), страницы 1938-1941. doi :10.1039/ct9079101938
- ^ Хадсон, Реджи Л.; Леффлер, Марк Дж. (31 июля 2013 г.). «Образование кетенов в межзвездных льдах: лабораторное исследование». The Astrophysical Journal . 773 (2): 109. Bibcode :2013ApJ...773..109H. doi :10.1088/0004-637x/773/2/109. hdl : 2060/20140010162 . S2CID 37437108.
- ^ ab Entry on Diketen . at: Römpp Online . Georg Thieme Verlag, получено 16 июня 2014 г.
- ^ Ханс-Юрген Арпе, "Industrielle Organische Chemie", 6 августа, 2007 г., WILEY-VCH Verlag, Вайнхайм, ISBN 978-3-527-31540-6 .
- ^ EP 1295860, D. Decker et al., выдан 26 марта 2003 г., 26 марта 2003 г., передан Nutrinova GmbH.
- ↑ Тидвелл, стр. 11.
- ↑ Тидвелл, стр. 560.
- ^ ChemSpider http://www.chemspider.com/Chemical-Structure.9643.html
- ^ Нгуен, Минь Тхо; Распоет, Грит (1999). «Механизм гидратации кетена: 15 лет спустя». Can. J. Chem . 77 (5–6): 817–829. doi :10.1139/v99-090.
- ^ Кристоф Тэшлер: Кетены, димеры кетенов и родственные вещества, Энциклопедия химической технологии Кирка-Отмера , John Wiley & Sons, Нью-Йорк, 2010
- ^ HA Wooster; CC Lushbaugh; CE Redeman (1946). «Ингаляционная токсичность кетена и димера кетена». J. Am. Chem. Soc. 68 (12): 2743. doi :10.1021/ja01216a526.
- ^ «Вспышка заболеваний легких, связанных с вейпингом, может подойти к концу». 20 декабря 2019 г.
- ^ Ву, Дэн; О'Ши, Донал Ф. (24 марта 2020 г.). «Потенциал высвобождения легочного токсичного кетена из пиролиза ацетата витамина Е при испарении». Труды Национальной академии наук . 117 (12): 6349–6355. Bibcode : 2020PNAS..117.6349W. doi : 10.1073 /pnas.1920925117 . PMC 7104367. PMID 32156732.
- ^ Attfield, Kathleen R.; Chen, Wenhao; Cummings, Kristin J.; Jacob, Peyton; O'Shea, Donal F.; Wagner, Jeff; Wang, Ping; Fowles, Jefferson (15 октября 2020 г.). «Способность этенона (кетена) способствовать повреждению легких, связанному с использованием электронных сигарет или вейпинга». Американский журнал респираторной и интенсивной медицины . 202 (8): 1187–1189. doi : 10.1164/rccm.202003-0654LE. PMID 32551843. S2CID 219919028.
- ^ Патент США № 5475144. Катализатор и процесс синтеза кетенов из карбоновых кислот. 12 декабря 1995 г. https://patents.google.com/patent/US5475144A/en
- ^ Центры по контролю и профилактике заболеваний (4 апреля 2013 г.). «Кетене». Карманный справочник NIOSH по химическим опасностям . Получено 13 ноября 2013 г.
- ^ Центры по контролю и профилактике заболеваний (май 1994 г.). «Кетене». Документация по концентрациям, представляющим немедленную опасность для жизни или здоровья (IDLHs) . Получено 13 ноября 2013 г.
Литература
- Тидвелл, Томас Т. Кетенес , 2-е издание. John Wiley & Sons, 2006, ISBN 978-0-471-69282-9 .






