Циклобутанон
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Циклобутанон | |
| Идентификаторы | |
| |
3D модель ( JSmol ) |
|
| ChemSpider |
|
| Информационная карта ECHA | 100.013.405 |
CID PubChem |
|
| УНИИ |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С4Н6О | |
| Молярная масса | 70,091 г·моль −1 |
| Появление | Бесцветная жидкость. |
| Плотность | 0,9547 г/см 3 (0 °C) [1] |
| Температура плавления | −50,9 °C (−59,6 °F; 222,2 К) [1] |
| Точка кипения | 99,75 °C (211,55 °F; 372,90 К) [1] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Циклобутанон — органическое соединение с молекулярной формулой (CH2 ) 3CO . Это четырехчленный циклический кетон (циклоалканон). Это бесцветная летучая жидкость при комнатной температуре. Поскольку циклопропанон очень чувствителен, циклобутанон — наименьший легкообрабатываемый циклический кетон.
Подготовка

Русский химик Николай Кишнер впервые получил циклобутанон с низким выходом из циклобутанкарбоновой кислоты . [2] [3] Процесс Кишнера, включающий несколько стадий, является громоздким и неэффективным; с тех пор были разработаны более эффективные, высокопродуктивные синтезы. [4]
Одна из стратегий включает деградацию пятиуглеродных строительных блоков. Например, окислительное декарбоксилирование циклобутанкарбоновой кислоты было улучшено с помощью других реагентов и методов.
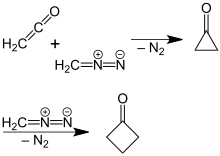
Более новый, более эффективный способ получения циклобутанона был найден П. Липпом и Р. Кёстером, в котором раствор диазометана в диэтиловом эфире реагирует с кетеном . [5] Эта реакция основана на расширении кольца первоначально образованного промежуточного циклопропанона , при котором отщепляется молекулярный азот:
Механизм реакции был подтвержден реакцией с использованием 14C -меченого диазометана. [6]
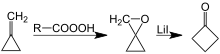
Другой синтез циклобутанона включает катализируемую иодидом лития перегруппировку оксаспиропентана, который образуется путем эпоксидирования легкодоступного метиленциклопропана : [7] [8]
Циклобутанон также можно получить в двухэтапной процедуре путем диалкилирования 1,3-дитиана с 1-бром-3-хлорпропаном с последующим снятием защиты с образованием кетона с помощью хлорида ртути (HgCl 2 ) и карбоната кадмия (CdCO 3 ). [9]
Циклобутаноны являются промежуточными продуктами гомоперегруппировки Фаворского и могут быть выделены при отсутствии нуклеофилов, как в синтезе келсоена:

Реакции
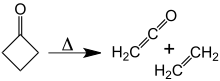
При температуре около 350 °C циклобутанон распадается на этилен и кетен . [10] Энергия активации для этого [2+2] циклоэлиминирования составляет 52 ккал/моль. Обратная реакция, [2+2] циклоприсоединение кетена и этилена, никогда не наблюдалась.
Смотрите также
Другие циклические кетоны:
Ссылки
- ^ abc CRC Handbook of Chemistry and Physics . Том 90. Бока-Ратон, Флорида: CRC Press.
- ^ Н. Кишнер (1905).«Über die Einwirkung von Brom auf die Amide α-bromsubstituierter Säuren». Journal der Russischen Physikalisch-Chemischen Gesellschaft . 37 : 103–105.
- ^ Н. Кишнер (1905). «Убер дас Циклобутанон». Journal der Russischen Physikalisch-Chemischen Gesellschaft . 37 : 106–109.
- ^ Дитер Зеебах (1971). «Изоциклическое Vierringverbindungen». В Хубене; Вейль; Мюллер (ред.). Методы органической химии . Том. IV/4. Штутгарт: Георг Тиме Верлаг.
- ^ П. Липп и Р. Кестер (1931). «Ein neuer Weg zum Cyclobutanon». Berichte der Deutschen Chemischen Gesellschaft . 64 (11): 2823–2825. дои : 10.1002/cber.19310641112.
- ^ Semenow, Dorothy A.; Cox, Eugene F.; Roberts, John D. (1956). «Соединения с малым кольцом. XIV. Радиоактивный циклобутанон из кетена и диазометана-14C1». Журнал Американского химического общества . 78 (13): 3221–3223. doi :10.1021/ja01594a069.
- ^ Салаун, Дж. Р.; Кониа, Дж. М. (1971). «Оксаспиропентан. Быстрый путь к циклобутанону». Журнал химического общества D: Chemical Communications (23): 1579b–1580. doi : 10.1039/C2971001579B.
- ^ JR Salaün, J. Champion, JM Conia (1977). "Циклобутанон из метиленциклопропана через оксаспиропентан". Organic Syntheses . 57 : 36. doi :10.15227/orgsyn.057.0036
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ); Собрание томов , т. 6, стр. 320. - ^ D. Seebach, AK Beck (1971). "Циклические кетоны из 1,3-дитиана: циклобутанон". Органические синтезы . 51 : 76. doi :10.15227/orgsyn.051.0076; Собрание томов , т. 6, стр. 316.
- ^ Das, MN; Kern, F.; Coyle, TD; Walters, WD (1954). «Термическое разложение циклобутанона1». Журнал Американского химического общества . 76 (24): 6271–6274. doi :10.1021/ja01653a013.