Лактат кальция
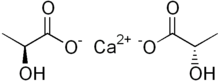 Кальций L -лактат | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Кальция бис(2-гидроксипропаноат) | |
Другие имена
| |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChEMBL | |
| ChemSpider | |
| DrugBank |
|
| Информационная карта ECHA | 100.011.278 |
| Номер ЕС |
|
| Номер E | E327 (антиоксиданты, ...) |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С6Н10СаО6 | |
| Молярная масса | 218,22 г/моль |
| Появление | белый или почти белый порошок, слегка выцветающий |
| Плотность | 1,494 г/см 3 |
| Температура плавления | 240 °C (464 °F; 513 K) (безводный) 120 °C (пентагидрат) |
| L-лактат, безводный, г/100 мл: 4,8 (10 °C), 5,8 (20 °C), 6,7 (25 °C), 8,5 (30 °C); [1] [2] 7,9 г/100 мл (30 °C) [ необходима цитата ] | |
| Растворимость | хорошо растворим в метаноле , нерастворим в этаноле |
| Кислотность ( pK a ) | 6.0-8.5 |
Показатель преломления ( nD ) | 1.470 |
| Фармакология | |
| A12AA05 ( ВОЗ ) | |
| Опасности | |
| Маркировка СГС : | |
 | |
| Предупреждение | |
| H319 | |
| П264 , П280 , П305+П351+П338 , П337+П313 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Непригодный |
| Нет данных | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Лактат кальция — белая кристаллическая соль с формулой C.
6ЧАС
10СаО
6, состоящий из двух анионов лактата H
3С (СНОН) СО−
2для каждого катиона кальция Ca 2+
. Образует несколько гидратов , наиболее распространенным из которых является пентагидрат C
6ЧАС
10СаО
6·5 ч
2О .
Лактат кальция используется в медицине, в основном для лечения дефицита кальция ; и как пищевая добавка с номером E327 . Некоторые сырные кристаллы состоят из лактата кальция. [3] [4]
Характеристики
Ион лактата является хиральным , с двумя энантиомерами , D (−, R ) и L (+, S ). Изомер L обычно синтезируется и метаболизируется живыми организмами, но некоторые бактерии могут производить форму D или преобразовывать L в D. Таким образом, лактат кальция также имеет изомеры D и L, где все анионы одного типа. [5]
Некоторые процессы синтеза дают смесь этих двух веществ в равных частях, что приводит к DL ( рацемической ) соли. Обе формы L и DL встречаются в виде кристаллов на поверхности выдержанного сыра Чеддер . [5]
Растворимость L-лактата кальция в воде значительно увеличивается в присутствии ионов d- глюконата , с 6,7 г / дл при 25 °C до 9,74 г/дл и более. [1] [2] Как это ни парадоксально, в то время как растворимость L-лактата кальция увеличивается с температурой от 10 °C (4,8 г/дл) до 30 °C (8,5 г/дл), концентрация свободного Ca2+
ионов уменьшается почти вдвое. Это объясняется тем, что ионы лактата и кальция становятся менее гидратированными и образуют комплекс C
3ЧАС
5О
3Ca+
. [2]
DL (рацемическая) форма соли гораздо менее растворима в воде, чем чистые L- или D-изомеры, поэтому раствор, содержащий всего лишь 25% D-формы, будет давать кристаллы рацемического DL-лактата вместо L-лактата. [6]
Пентагидрат теряет воду в сухой атмосфере при температуре от 35 до 135 °C, восстанавливаясь до безводной формы и теряя свой кристаллический характер. Процесс обратный при 25 °C и относительной влажности 75% . [7]
В водных растворах лактат кальция частично диссоциирует на ионы кальция (Ca 2+ ) и ионы лактата (C 3 H 5 O 3 - ). Ион лактата, являясь сопряженным основанием молочной кислоты ( слабой кислоты ), может подвергаться небольшому гидролизу, делая раствор слабощелочным. Эта реакция увеличивает концентрацию гидроксид-ионов (OH - ), в результате чего получается раствор с pH немного выше 7, то есть основным . [8] [9] [10] Вот приблизительные значения pH для растворов лактата кальция при различных концентрациях: [9]
| Концентрация лактата кальция (моль/л) | Приблизительный pH |
|---|---|
| 0.01 | 7.4 – 7.6 |
| 0,05 | 7.6 – 7.8 |
| 0.10 | 7,8 – 8,0 |
| 0.20 | 8.0 – 8.2 |
Пентагидрат лактата кальция имеет растворимость в воде 79 г/л при 25°C. Это свойство делает лактат кальция легкодоступным для усвоения при потреблении. Он более растворим, чем некоторые другие соли кальция, такие как цитрат (растворимость которого составляет 0,85 г/л при 25°C). [11] [8]
Подготовка
Лактат кальция можно получить путем реакции молочной кислоты с карбонатом кальция или гидроксидом кальция .
С 19 века соль получают промышленным способом путем ферментации углеводов в присутствии источников минералов кальция, таких как карбонат кальция или гидроксид кальция . [12] : стр. 200 [13] [14] В результате ферментации может образовываться либо D-, либо L-лактат, либо их рацемическая смесь, в зависимости от типа используемого организма. [15]
Использует
Лекарство
Лактат кальция имеет ряд применений в медицине и ветеринарии .
Лактат кальция используется в медицине как антацидное средство . [16]
Он также используется для лечения гипокальциемии (дефицита кальция). Он может усваиваться при различных значениях pH , поэтому его не нужно принимать с пищей. Однако в этом случае он оказался менее удобным, чем цитрат кальция . Лактат кальция содержит 13% элементарного кальция. [17]
В начале 20 века было обнаружено, что пероральное введение лактата кальция, растворенного в воде (но не в молоке или таблетках), эффективно для профилактики тетании у людей и собак с паратиреоидной недостаточностью или перенесших паратиреоидэктомию . [18] [19]
Это соединение также содержится в некоторых ополаскивателях для полости рта и зубной пасте в качестве средства против зубного камня. [16]
Лактат кальция (или другие соли кальция) является противоядием при отравлении растворимым фторидом [20] : p165 и плавиковой кислотой .
В то время как водные растворы лактата кальция демонстрируют слегка щелочной (выше 7) pH из-за слабого гидролиза ионов лактата, лактат кальция не используется в качестве антацида . Причины кроются в его химических свойствах и физиологическом поведении в желудочно-кишечном тракте. Лактат кальция обладает недостаточной кислотонейтрализующей способностью, вызванной его слабым образованием основания. Ион лактата (C 3 H 5 O 3 - ) является сопряженным основанием молочной кислоты , которая является слабой кислотой . Когда лактат кальция растворяется в воде, он высвобождает ионы лактата, которые могут немного повысить pH водного раствора. Степень образования гидроксид- иона (OH - ) посредством гидролиза ионов лактата минимальна, что делает раствор лишь слабощелочным. Лактат кальция более растворим в воде по сравнению с другими солями кальция, такими как цитрат или карбонат кальция, что приводит к более быстрому всасыванию в тонком кишечнике, а не к реакции в желудке. Небольшое увеличение pH от лактата кальция быстро буферизуется кислой средой желудка, поэтому он не обеспечивает быстрого сдвига pH, необходимого для облегчения симптомов повышенной кислотности. [21] [22] [23] Таким образом, роль лактата кальция заключается в поставке ионов кальция в организм — источника биодоступного кальция. Лактат кальция — это хорошо усваиваемая и в целом безопасная форма добавки кальция [24] , которая не мешает пищеварению. [17] Его свойства позволяют эффективно использовать его, не нарушая нормальную функцию желудочно-кишечного тракта, что делает его подходящим для людей, стремящихся увеличить потребление кальция, не влияя на их пищеварительные процессы. [17] Лактат кальция не взаимодействует существенно с пищеварительными ферментами или другими компонентами желудочно-кишечного тракта. Он растворяет и высвобождает ионы кальция, которые всасываются в тонком кишечнике, не влияя на переваривание белков, углеводов или жиров. [17]
Пищевая промышленность
Это соединение является пищевой добавкой, классифицированной Управлением по контролю за продуктами и лекарствами США как общепризнанная безопасная (GRAS) для использования в качестве укрепляющего агента , усилителя вкуса или ароматизатора , разрыхлителя , пищевой добавки , а также стабилизатора и загустителя . [25]
Лактат кальция также известен как лактат сыра, потому что он свертывает молоко, образуя чхену, используемую в производстве сыра панир . [16] Чхена также используется для приготовления различных сладостей и других молочных белков.
Лактат кальция является ингредиентом некоторых разрыхлителей, содержащих пирофосфат натрия . Он обеспечивает кальцием замедление заквашивания. [26] : стр. 933
Лактат кальция добавляют в продукты без сахара для предотвращения кариеса . При добавлении в жевательную резинку, содержащую ксилит , он увеличивает реминерализацию зубной эмали . [27]
Это соединение также добавляют в свежесрезанные фрукты, такие как дыни , чтобы сохранить их твердость и продлить срок годности, без горького привкуса, вызываемого хлоридом кальция , который также можно использовать для этой цели. [28]
Лактат кальция используется в молекулярной гастрономии как безвкусный жирорастворимый агент для простой и обратной сферификации . Он реагирует с альгинатом натрия, образуя оболочку вокруг пищевого продукта.
Корма для животных
Лактат кальция можно добавлять в рацион животных в качестве источника кальция. [29]
Химия
Это соединение ранее было промежуточным продуктом в приготовлении молочной кислоты для пищевых и медицинских целей. Неочищенная кислота из различных источников была преобразована в лактат кальция, очищена кристаллизацией, а затем преобразована обратно в кислоту обработкой серной кислотой , которая осаждала кальций в виде сульфата кальция . Этот метод дал более чистый продукт, чем тот, который был бы получен путем перегонки исходной кислоты. [12] : стр. 180 Недавно лактат аммония использовался в качестве альтернативы кальцию в этом процессе. [14]
Очистка воды
Лактат кальция рассматривается как коагулянт для удаления взвешенных частиц из воды, как возобновляемая, нетоксичная и биоразлагаемая альтернатива хлориду алюминия AlCl
3. [30]
Биобетон
Добавление лактата кальция существенно увеличивает прочность на сжатие и снижает водопроницаемость биобетона , позволяя таким бактериям, как Enterococcus faecalis , Bacillus cohnii , Bacillus pseudofirmus и Sporosarcina pasteurii , производить больше кальцита . [31] [32]
Смотрите также
Ссылки
- ^ ab Martina Vavrusova, Merete Bøgelund Munk и Leif H. Skibsted (2013): "Водная растворимость лактата кальция l, глюконата кальция d и лактобионата кальция d: важность комплексообразования для повышения растворимости смесями гидроксикарбоксилатов". Журнал сельского хозяйства и пищевой химии , том 61, выпуск 34, страницы 8207–8214. doi :10.1021/jf402124n
- ^ abc Martina Vavrusova, Ran Liang и Leif H. Skibsted (2014): "Термодинамика растворения гидроксикарбоксилатов кальция в воде". Журнал сельского хозяйства и пищевой химии , том 62, выпуск 24, страницы 5675–5681. doi :10.1021/jf501453c
- ^ Stephie Clark & Shantanu Agarwal (27 апреля 2007 г.). "Глава 24: Чеддер и родственные твердые сыры. 24.6: Формирование кристаллов". В YH Hui (ред.). Справочник по производству пищевых продуктов (1-е изд.). Wiley-Interscience. стр. 589. ISBN 978-0470049648.
- ^ Phadungath, Chanokphat (2011). Эффективность глюконата натрия как ингибитора кристаллов лактата кальция в сыре чеддер (диссертация). Университет Миннесоты. Архивировано из оригинала 5 мая 2021 г. Получено 12 октября 2013 г.
- ^ ab GF Tansman, PS Kindstedt, JM Hughes (2014): "Порошковая рентгеновская дифракция может различать энантиомерные варианты кристалла пентагидрата лактата кальция в сыре". Журнал Dairy Science , том 97, выпуск 12, страницы 7354–7362. doi :10.3168/jds.2014-8277
- ^ Джил Филс Тансман (2014): Исследование природы кристаллов в сыре с помощью рентгеновской дифракции. Магистерская диссертация, Университет Вермонта.
- ^ Юко Саката, Сумихиро Сираиши, Макото Оцука (2005): «Характеристика поведения дегидратации и гидратации пентагидрата лактата кальция и его ангидрата». Коллоиды и поверхности B: Биоинтерфейсы , том 46, выпуск 3, страницы 135–141. doi :10.1016/j.colsurfb.2005.10.004
- ^ ab Williams, Michael (апрель 2013 г.). Merck Index: Энциклопедия химикатов, лекарств и биологических препаратов, 15-е издание под редакцией MJO'Neil, Королевское химическое общество, Кембридж, Великобритания . Исследования в области разработки лекарств. Том 74. стр. 2708. doi :10.1002/ddr.21085. ISBN 9781849736701.
- ^ ab Шески, Пол Дж.; Хэнкок, Бруно К.; Мосс, Гэри П.; Голдфарб, Дэвид Дж. (1 октября 2020 г.). Справочник по фармацевтическим вспомогательным веществам . Pharmaceutical Press. ISBN 978-0857113757.
- ^ Remington: Наука и практика фармации . Pharmaceutical Press. 3 сентября 2012 г. стр. 3056. ISBN 978-0857110626.
- ^ Рамбл, Джон Р. (4 июня 2024 г.). CRC Handbook of Chemistry and Physics . CRC Press. ISBN 978-1032655628.
- ^ ab H. Benninga (1990): "История создания молочной кислоты: Глава в истории биотехнологии". Том 11 Chemists and Chemistry . Springer, ISBN 9780792306252
- ^ Кук Хва Чой, Ён Гын Чан и Джин-Хён Ким (2011) «Оптимизация процесса осаждения для восстановления молочной кислоты». Журнал KSBB , том 26, страницы 13–18. (Реферат заархивирован 16 апреля 2017 г. на Wayback Machine )
- ^ ab «Энергосберегающий способ получения молочной кислоты без гипса» Химическая инженерия , 1 июля 2009 г.
- ^ Рожан П. Джон, К. Мадхаван Нампутири, Ашок Пандей (2007): «Ферментативное производство молочной кислоты из биомассы: обзор развития процесса и будущих перспектив» Прикладная микробиология и биотехнология , том 74, выпуск 3, страницы 524–534 doi :10.1007/s00253-006-0779-6
- ^ abc "Использование лактата кальция". www.tripurabiotech.com . Архивировано из оригинала 2021-05-13 . Получено 2020-08-04 .
- ^ abcd Straub DA (июнь 2007 г.). «Добавки кальция в клинической практике: обзор форм, доз и показаний». Nutr Clin Pract . 22 (3): 286–96 . doi :10.1177/0115426507022003286. PMID 17507729.
- ^ Слоан Дж. Уилсон (1938): "Послеоперационная паратиреоидная недостаточность и лактат кальция". Архивы хирургии , том 37, выпуск 3, страницы 490-497. doi :10.1001/archsurg.1938.01200030139008
- ^ AB Luckhardt и B. Goldberg (1923): «Сохранение жизни полностью паратиреоидэктомированных собак с помощью перорального введения лактата кальция». Журнал Американской медицинской ассоциации , том 80, выпуск 2, страницы 79-80. doi :10.1001/jama.1923.02640290009002
- ^ Кэролин А. Тайленда (2011): «Токсикологический профиль фторидов, фтористого водорода и фтора (обновление)». DIANE Publishing. ISBN 9781437930771
- ^ Эмки, Рональд Д.; Эмки, Грегори Р. (2012). «Обмен кальция и коррекция дефицита кальция». Клиники эндокринологии и метаболизма Северной Америки . 41 (3): 527– 556. doi :10.1016/j.ecl.2012.04.019. PMID 22877428.
- ^ Брантон, Лоуренс Л.; Кноллманн, Бьорн К. (7 ноября 2022 г.). Фармакологическая основа Гудмана Гилмана T: Herapeutics 14e (Ie) . McGraw-Hill Education. стр. 1664. ISBN 978-1265016982.
- ^ "Управление пищевых добавок - Кальций". Архивировано из оригинала 2018-03-17 . Получено 2024-11-17 .
- ^ Программа, Human Foods (10 октября 2024 г.). «Список статуса пищевых добавок». FDA . Архивировано из оригинала 12 ноября 2020 г. Получено 17 ноября 2024 г.
- ^ Управление по контролю за продуктами питания и лекарственными средствами США (2016): Свод федеральных правил: Раздел 21 Том 3, раздел 21CFR184.1207 «Лактат кальция». Архивировано 15 апреля 2017 г. на Wayback Machine , пересмотрено 1 апреля 2016 г.
- ^ EJ Pyler (1988), Наука и технология выпечки, Sosland Publishing
- ^ Sudaa, R.; T. Suzukia; R. Takiguchib; K. Egawab; T. Sanob; K. Hasegawa (2006). «Влияние добавления лактата кальция в жевательную резинку с ксилитом на реминерализацию поражений эмали». Caries Research . 40 (1): 43– 46. doi :10.1159/000088905. PMID 16352880. S2CID 45316316.
- ^ Луна-Гусман, Ирен; Дайан М. Барретт (2000). «Сравнение эффективности хлорида кальция и лактата кальция в поддержании стабильности при хранении и качества свежесрезанных дынь». Postharvest Biology and Technology . 19 : 16–72 . doi :10.1016/S0925-5214(00)00079-X.
- ^ BN Paul, S. Sarkar, SS Giri, S. N Mohanty, PK Mukhopadhyay (2006): "Потребность в кальции и фосфоре в рационе мальков роху Labeo rohita ". Animal Nutrition and Feed Technology , том 6, выпуск 2, страницы 257-263
- ^ R. Devesa-Rey, G. Bustos, JM Cruz, AB Moldes (2012): «Оценка нетрадиционных коагулянтов для удаления мутности из воды». Water, Air, & Soil Pollution , том 223, выпуск 2, страницы 591–598. doi :10.1007/s11270-011-0884-8
- ^ Ирван, Дж. М.; Аннеза, Л. Х.; Отман, Норзила; Фейсал Альшалиф, А. (2016). «Прочность на сжатие и водопроницаемость бетона с Enterococcus faecalis и лактатом кальция». Ключевые инженерные материалы . 705 : 345–349 . doi :10.4028/www.scientific.net/KEM.705.345.
- ^ Монео, Шеннон (11 сентября 2015 г.). «Голландский ученый изобрел самовосстанавливающийся бетон с бактериями». Journal Of Commerce . Архивировано из оригинала 22 марта 2018 г. Получено 21 марта 2018 г.



