Домен C2
| Домен C2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
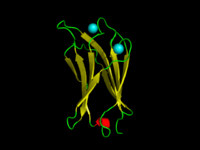 Домен C2 α-токсина C.absonum (PDB 1OLP). β-тяжи показаны желтым, α-спирали красным, петли зеленым. Координированные ионы кальция показаны голубым. | |||||||||
| Идентификаторы | |||||||||
| Символ | С2 | ||||||||
| Пфам | ПФ00168 | ||||||||
| Клан ПФАМ | CL0154 | ||||||||
| ЭКОД | 11.2.1 | ||||||||
| ИнтерПро | IPR000008 | ||||||||
| УМНЫЙ | С2 | ||||||||
| ПРОСИТ | PDOC00380 | ||||||||
| СКОП2 | 1qas / SCOPe / SUPFAM | ||||||||
| суперсемейство OPM | 45 | ||||||||
| белок ОПМ | 1угк | ||||||||
| CDD | cd00030 | ||||||||
| |||||||||
| Фосфоинозитид 3-киназа C2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Структура фосфоинозитид 3-киназы. [1] | |||||||||||
| Идентификаторы | |||||||||||
| Символ | PI3K_C2 | ||||||||||
| Пфам | ПФ00792 | ||||||||||
| Клан ПФАМ | CL0154 | ||||||||||
| ЭКОД | 11.2.1 | ||||||||||
| ИнтерПро | IPR002420 | ||||||||||
| УМНЫЙ | PI3K_C2 | ||||||||||
| ПРОСИТ | PDOC50004 | ||||||||||
| СКОП2 | 1e8x / SCOPe / SUPFAM | ||||||||||
| CDD | cd08380 | ||||||||||
| |||||||||||
Домен C2 — это структурный домен белка , участвующий в нацеливании белков на клеточные мембраны . Типичная версия (PKC-C2) имеет бета-сэндвич, состоящий из 8 β-нитей , который координирует два или три иона кальция , которые связываются в полости, образованной первой и последней петлями домена, на мембранной связывающей поверхности. Многие другие семейства доменов C2 не обладают активностью связывания кальция. [2] [3]
Связь с другими доменами
Домены C2 часто встречаются в сочетании с ферментативными доменами; например, домен C2 в PTEN приводит домен фосфатазы в контакт с плазматической мембраной, где он может дефосфорилировать свой субстрат, фосфатидилинозитол (3,4,5)-трифосфат (PIP 3 ) , не удаляя его из мембраны, что было бы энергетически очень затратно. PTEN состоит из двух доменов, домена протеинтирозинфосфатазы и домена C2. Эта пара доменов составляет супердомен, наследуемую единицу, которая встречается в различных белках грибов, растений и животных. [4] Кроме того, фосфатидилинозитол 3-киназа (PI3-киназа), фермент, фосфорилирующий фосфоинозитиды на 3- гидроксильной группе кольца инозитола , также использует домен C2 для связывания с мембраной (например, запись 1e8w PDB).
Эволюция
Домен C2 в настоящее время известен только из эукариот и прокариот Clostridium perfringens , где он является частью альфа-токсина . [5] Было идентифицировано более 17 различных клад доменов C2. [2] [3] Большинство семейств C2 можно проследить до базальных эукариотических видов, что указывает на раннюю диверсификацию до последнего общего предка эукариот (LECA). Только семейство доменов PKC-C2 содержит консервативные остатки связывания кальция, что предполагает, что типичное кальций-зависимое мембранное взаимодействие является производной особенностью, ограниченной в доменах PKC-C2. [2]
Селективность кальция и липидов
Домены C2 уникальны среди доменов мембранного нацеливания, поскольку они демонстрируют широкий диапазон липидной селективности для основных компонентов клеточных мембран, включая фосфатидилсерин и фосфатидилхолин. Этот домен C2 состоит примерно из 116 аминокислотных остатков и расположен между двумя копиями домена C1 в протеинкиназе C (связывающей форболовые эфиры и диацилглицерол) (см. PDOC00379) и каталитическим доменом протеинкиназы (см. PDOC00100). Участки со значительной гомологией [6] с доменом C2 были обнаружены во многих белках. Считается, что домен C2 участвует в кальций-зависимом связывании фосфолипидов [7] и в процессах мембранного нацеливания, таких как субклеточная локализация. Хотя большинство доменов C2 взаимодействуют с мембраной (фосфолипидами) зависимым от Ca 2+ образом, некоторые домены C2 могут взаимодействовать с мембраной без связывания с Ca 2+ . Аналогично, домены C2 эволюционировали, чтобы иметь различные специфичности для липидов. Многие домены C2, такие как синаптотагмин C2A, связываются с анионными фосфолипидами (фосфолипиды, содержащие PS или PIP2). Однако другие домены C2, такие как домен C2 cPLA2-α, связываются с цвиттер-ионными липидами (например, PC). Это разнообразие и селективность в связывании Ca 2+ и липидов предполагают, что домены C2 эволюционировали, чтобы иметь различные функции. [8]
3D структура
Домен образует восьмицепочечный бета-сэндвич, построенный вокруг консервативного 4-цепочечного мотива, обозначенного как ключ C2. [9] Кальций связывается в чашеобразном углублении, образованном N- и C-концевыми петлями мотива ключа C2. Структурный анализ нескольких доменов C2 показал, что они состоят из схожих тройных структур, в которых три петли связывания Ca 2+ расположены в конце 8-цепочечного антипараллельного бета-сэндвича.
Белки человека, содержащие домен C2
ABR; BAIAP3 ; BCR ; C2CD2; C2CD3; CADPS ; CADPS2 ; CAPN5 ; CAPN6 ; CC2D1A ; CC2D1B; CPNE1 ; CPNE2; CPNE3; CPNE4 ; CPNE5; CPNE6 ; CPNE7 ; CPNE8 ; CPNE9; DAB2IP ; DOC2A ; DOC2B ; DYSF ; ESYT1 ; ESYT3; FAM62A ; FAM62B ; FAM62C; FER1L3 ; FER1L5; HECW1 ; HECW2 ; ITCH ; ITSN1 ; ITSN2 ; MCTP1; MCTP2; MTAC2D1; NEDD4 ; NEDD4L ; NEDL1; OTOF ; PCLO ; PIK3C2A ; PIK3C2B ; PIK3C2G ; PLA2G4A ; PLA2G4B ; PLA2G4D; PLA2G4E; PLA2G4F; PLCB1 ; PLCB2 ; PLCB3 ; PLCB4 ; PLCD1 ; PLCD3 ; PLCD4 ; PLCE1 ; PLCG1 ; PLCG2 ; PLCH1 ; PLCH2 ; PLCL1 ; PLCL2 ; PLCZ1; PRF1 ; PRKCA ; PRKCB1 ; PRKCE ; PRKCG ; PRKCH ; RAB11FIP1 ; RAB11FIP2 ; RAB11FIP5 ; RASA1 ; RASA2; RASA3 ; RASA4 ; RASAL1; RASAL2 ; RGS3 ; RIMS1 ; RIMS2 ; RIMS3; RIMS4; RPGRIP1 ; RPGRIP1L ; RPH3A ; SGA72M; SMURF1 ; SMURF2 ; SYNGAP1 ; SYT1 ; SYT10; SYT11 ; SYT12; SYT13 ; SYT14 ; SYT14L; SYT15; SYT16; SYT17; SYT2 ; SYT3; SYT4 ; SYT5 ; SYT6 ; SYT7 ; SYT8; SYT9 ; SYTL1 ; SYTL2 ; SYTL3 ; SYTL4 ; SYTL5; TOLLIP ; UNC13A ; UNC13B ; UNC13C; UNC13D ; WWC2 ; WWP1 ; WWP2 ; PTEN
Ссылки
- ^ Walker EH, Pacold ME, Perisic O, Stephens L, Hawkins PT, Wymann MP, Williams RL (октябрь 2000 г.). «Структурные детерминанты ингибирования фосфоинозитид-3-киназы вортманнином, LY294002, кверцетином, мирицетином и стауроспорином». Molecular Cell . 6 (4): 909–19 . doi : 10.1016/S1097-2765(05)00089-4 . PMID 11090628.
- ^ abc Zhang D, Aravind L (декабрь 2010 г.). «Идентификация новых семейств и классификация суперсемейства домена C2 проливают свет на происхождение и эволюцию мембранной таргетной активности у эукариот». Gene . 469 ( 1– 2): 18– 30. doi :10.1016/j.gene.2010.08.006. PMC 2965036 . PMID 20713135.
- ^ ab Zhang D, Aravind L (октябрь 2012 г.). «Новая трансглутаминазоподобная пептидаза и домены C2 объясняют структуру, биогенез и эволюцию цилиарного компартмента». Cell Cycle . 11 (20): 3861– 75. doi :10.4161/cc.22068. PMC 3495828 . PMID 22983010.
- ^ Haynie DT, Xue B (май 2015). «Супердомены в иерархии структуры белка: случай PTP-C2». Protein Science . 24 (5): 874– 82. doi :10.1002/pro.2664. PMC 4420535 . PMID 25694109.
- ^ Naylor, Claire E.; Eaton, Julian T.; Howells, Angela; Justin, Neil; Moss, David S.; Titball, Richard W.; Basak, Ajit K. (август 1998 г.). «Структура ключевого токсина при газовой гангрене». Nature Structural & Molecular Biology . 5 (8): 738– 746. doi :10.1038/1447. ISSN 1545-9993. PMID 9699639. S2CID 21000585.
- ^ Brose N, Hofmann K, Hata Y, Südhof TC (октябрь 1995 г.). «Млекопитающие гомологи гена unc-13 Caenorhabditis elegans определяют новое семейство белков C2-домена». Журнал биологической химии . 270 (42): 25273– 80. doi : 10.1074/jbc.270.42.25273 . PMID 7559667.
- ^ Davletov BA, Südhof TC (декабрь 1993 г.). «Один домен C2 из синаптотагмина I достаточен для высокоаффинного связывания Ca2+/фосфолипида». Журнал биологической химии . 268 (35): 26386– 90. doi : 10.1016/S0021-9258(19)74326-9 . PMID 8253763.
- ^ Nalefski EA, Wisner MA, Chen JZ, Sprang SR, Fukuda M, Mikoshiba K, Falke JJ (март 2001 г.). «Домены C2 из разных сигнальных путей Ca2+ демонстрируют функциональное и механистическое разнообразие». Биохимия . 40 (10): 3089– 100. doi :10.1021/bi001968a. PMC 3862187. PMID 11258923 .
- ^ Sutton RB, Davletov BA, Berghuis AM, Südhof TC, Sprang SR (март 1995). "Структура первого домена C2 синаптотагмина I: новая складка, связывающая Ca2+/фосфолипид". Cell . 80 (6): 929– 38. doi : 10.1016/0092-8674(95)90296-1 . PMID 7697723. S2CID 18981505.
Внешние ссылки
- Семейство фосфоинозитид-3-киназы C2 в Pfam
- UMich Ориентация белков в мембранах семейства/суперсемейства-47 - Ориентации доменов C2 в мембранах (OPM)