(+)-Бензо(а)пирен-7,8-дигидродиол-9,10-эпоксид
![(+)-Бензо[а]пирен-7,8-дигидродиол-9,10-эпоксид](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0e/%28%2B%29-Benzo%28a%29pyrene-7%2C8-dihydrodiol-9%2C10-epoxide.png/220px-%28%2B%29-Benzo%28a%29pyrene-7%2C8-dihydrodiol-9%2C10-epoxide.png) | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК (7 R ,8 S ,8a S ,9a R )-7,8,8a,9a-Тетрагидробензо[1,12]тетрафено[10,11- b ]оксирен-7,8-диол | |
| Другие имена (+)-Бензо[ a ]пирен-7,8-дигидродиол-9,10-эпоксид (+)-7,8,9,10-Тетрагидробензо[ a ]пирен-7,8-диол-9,10-эпоксид (7 R ,8 S ,8a R ,9a S )-7,8,8a,9a-Тетрагидробензо[1,12]тетрафенo[10,11-b]оксирен-7,8-диол 7,8,8a,9a-Тетрагидро-(7 R ,8 S ,8a R ,9a S )-бензо[10,11]хризено[3,4- b ]оксирен-7,8-диол | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider |
|
CID PubChem |
|
| УНИИ | |
| |
| |
| Характеристики | |
| С20Н14О3 | |
| Молярная масса | 302,329 г·моль −1 |
| Плотность | 1,6 ± 0,1 г см −3 |
| Точка кипения | 594,2 ± 50,0 °C при 760 мм рт. ст. |
| Диметилсульфоксид , дихлорметан , метанол | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
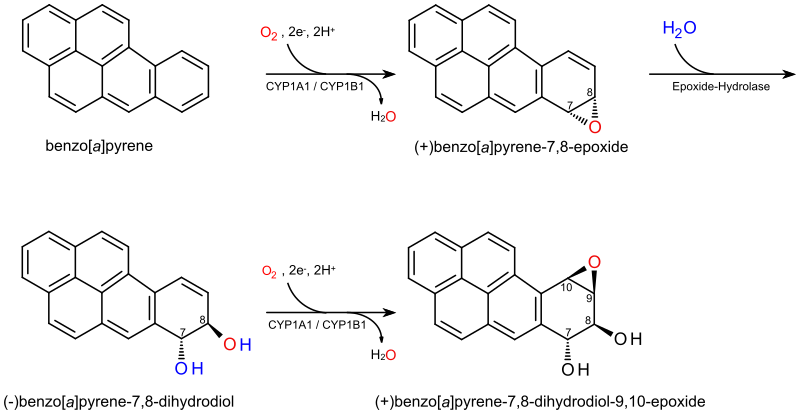
(+)-Бензо[ a ]пирен-7,8-дигидродиол-9,10-эпоксид — это органическое соединение с молекулярной формулой C20H14O3 . Это метаболит и производное бензо [ a ]пирена (обнаруженного в табачном дыме [1] ) в результате окисления с включением гидроксильных и эпоксидных функциональных групп. (+)-Бензо[ a ]пирен-7,8- дигидродиол -9,10- эпоксид связывается с атомом N2 гуанинового нуклеинового основания в ДНК , [2] [ 3] искажая структуру двойной спирали [4] путем интеркаляции пиренового фрагмента между парами оснований через π-стэкинг . [5] Канцерогенные свойства курения табака частично объясняются тем, что это соединение связывает и инактивирует способность определенных генов подавлять опухоли , что приводит к генетическим мутациям и потенциально к раку. [6]
Структура
Пирен — полициклический ароматический углеводород, состоящий из четырех бензольных колец, соединенных вместе в плоскую ароматическую структуру, которая по форме приближается к ромбу . Бензо[ a ]пирен — производное , в котором пятое бензольное кольцо соединено с пиреновой системой, и является компонентом табачного дыма , который является проканцерогеном, частично ответственным за канцерогенные и мутагенные эффекты курения. [1] Бензо[ a ]пирен-7,8-дигидродиол-9,10-эпоксид — метаболит бензо[ a ]пирена, образованный путем введения вицинальных гидроксильных и эпоксидных функциональных групп в пятое бензольное кольцо. [7] Эти окисления являются стереоселективными , производя пару энантиомеров с гидроксильными группами на противоположных сторонах плоскости пирена и с эпоксидом на той же стороне, что и его соседняя гидроксильная группа. (+)-Бензо[ a ]пирен-7,8-дигидродиол-9,10-эпоксид представляет собой стереоизомер ( 7R , 8S , 8aR , 9aS ) .
Биосинтез
Метаболизм проканцерогена табачного дыма бензо[ a ]пирена включает три отдельных этапа — введение эпоксидной группы в положение 7,8, ее гидратацию до вицинального диола и введение эпоксида в положение 9,10. [8] [9] На первом этапе катализируемое цитохромом P450 1A1 (CYP1A1) окисление производит несколько продуктов, включая (+)-бензо[ a ]пирен-7,8-эпоксид. [7] Фермент эпоксидгидролаза затем гидратирует эпоксидное кольцо , получая вицинальный диол (−)-бензо[ a ]пирен-7,8-дигидродиол, который затем окисляется цитохромом P450 оксидазой, снова образуя мутаген и канцероген (+)-бензо[ a ]пирен-7,8-дигидродиол-9,10-эпоксид. Этот диолэпоксид ковалентно связывается с ДНК путем раскрытия кольца для алкилирования нуклеиновой кислоты, образуя искаженную структуру, как показано справа, с интеркаляцией пиренового полициклического ароматического углеводородного фрагмента между парами оснований, благоприятствуя π-стэкингу; [5] эти искажения были подтверждены рентгеновскими кристаллографическими и ядерно-магнитно-резонансными структурными исследованиями. [2] Афлатоксин имеет схожий механизм действия, хотя его связывание происходит через положение N7, а не N2, [ 3] гуанина. [10] В результате этих преобразований возможны множественные стереохимические результаты. Антистереоизомер (показан здесь) и его энантиомер являются конечными канцерогенами из бензо[ a ]пирена, но также образуются син- изомеры. [11]
Биохимия

Было показано, что (+)-бензо[ a ]пирен-7,8-дигидродиол-9,10-эпоксид связывается с атомом N2 гуанинового основания в ДНК , [2] [3] искажая структуру двойной спирали [4] путем интеркаляции пиренового фрагмента между парами оснований посредством π-стэкинга . [5]
Имеются данные, что (+)-бензо[ a ]пирен-7,8-дигидродиол-9,10-эпоксид специфически воздействует на защитный ген p53 ; [12] Более 50 процентов опухолей человека содержат мутацию или делецию гена p53. [13] Этот ген является фактором транскрипции , который регулирует клеточный цикл и, следовательно, функционирует как супрессор опухолей . Анти -бензо[ a ]пирендиолэпоксиды вызывают трансверсии гуанина в тимин в связанных областях p53, тем самым инактивируя его способность подавлять опухоли в определенных клетках, что приводит к генетическим мутациям и потенциально к раку. [6]
Индукция CYP1A1 бензо[ a ]пиреном происходит посредством связывания с арильным углеводородным рецептором в цитозоле, что приводит к транслокации трансформированного рецептора в ядро, где он димеризуется с ядерным транслокатором арильного углеводородного рецептора , а затем связывает элементы ответа ксенобиотика в ДНК, расположенные выше определенных генов. Этот процесс увеличивает транскрипцию генов, включая CYP1A1, что приводит к увеличению продукции белка CYP1A1. [14] Этот процесс аналогичен индукции CYP1A1 некоторыми полихлорированными бифенилами и диоксинами . По-видимому, активность CYP1A1 в слизистой оболочке кишечника предотвращает попадание большого количества проглоченного бензо[ a ]пирена в портальную кровь и системный кровоток. [15] Кишечная, но не печеночная, экспрессия CYP1A1 зависит от TOLL-подобного рецептора 2 ( TLR2 ), [16] который является эукариотическим рецептором для бактериальных поверхностных структур, таких как липотейхоевая кислота . Более того, было обнаружено, что бензо[ a ]пирен активирует транспозон, LINE1 , у людей. [17]
Ссылки
- ^ ab Seager, SL; Slabaugh, MR (2013). «Свойства и использование ароматических соединений». Органическая и биохимия сегодня (8-е изд.). Cengage Learning . стр. 65–66 . ISBN 9781285605906.
- ^ abc Pradhan, P.; Tirumala, S.; Liu, X.; Sayer, JM; Jerina, DM; Yeh, HJC (2001). "Структура раствора транс-открытого (10 S )-dA аддукта (+)-(7 S ,8 R ,9 S ,10 R )-7,8-дигидрокси-9,10-эпокси-7,8,9,10-тетрагидробензо[ a ]пирена в полностью комплементарном ДНК-дуплексе: доказательства основной Syn -конформации". Биохимия . 40 (20): 5870– 5881. doi :10.1021/bi002896q. PMID 11352722.
- ^ abc Karle, IL; Yagi, H.; Sayer, JM; Jerina, DM (2004). «Кристаллическая и молекулярная структура аддукта N2-дезоксигуанозина и бензо[a]пирен-7,8-диол-9,10-эпоксида: абсолютная конфигурация и конформация». Труды Национальной академии наук Соединенных Штатов Америки . 101 (6): 1433– 1438. Bibcode : 2004PNAS..101.1433K . doi : 10.1073/pnas.0307305101 . PMC 341736. PMID 14757823.
- ^ аб Волк, DE; Тивиянатан, В.; Райс, Дж. С.; Люксон, Бакалавр; Шах, Дж. Х.; Яги, Х.; Сэйер, Дж. М.; Да, HJ; Джерина, DM; Горенштейн, Д.Г. (2003). «Структура раствора цис -открытого (10 R )-N 6 -дезоксиаденозинового аддукта (9 S ,10 R )-9,10-эпокси-7,8,9,10-тетрагидробензо[ a ]пирена в ДНК-дуплексе. ". Биохимия . 42 (6): 1410–1420 . doi :10.1021/bi026745u. ПМИД 12578353.
- ^ abc Hargis, JC; Schaefer, HF; Houk, KN; Wheeler, SE (2010). «Нековалентные взаимодействия эпоксида диола бензо[a]пирена с парами оснований ДНК: взгляд на образование аддуктов (+)-BaP DE-2 с ДНК». Journal of Physical Chemistry A . 114 (4): 2038– 2044. Bibcode :2010JPCA..114.2038H. doi :10.1021/jp911376p. PMC 2826197 . PMID 20063873.
- ^ ab Eisenstadt, E.; Warren, AJ; Porter, J.; Atkins, D.; Miller, JH (1982). «Канцерогенные эпоксиды бензо[a]пирена и циклопента[cd]пирена вызывают замены оснований через специфические трансверсии». Труды Национальной академии наук Соединенных Штатов Америки . 79 (6): 1945–1949 . Bibcode : 1982PNAS...79.1945E. doi : 10.1073/pnas.79.6.1945 . PMC 346098. PMID 7043469 .
- ^ ab Shou, M.; Gonzalez, FJ; Gelboin, HV (1996). "Стереоселективное эпоксидирование и гидратация в K-области полициклических ароматических углеводородов с помощью экспрессируемых в ДНК цитохромов P450 1A1, 1A2 и эпоксидгидролазы". Биохимия . 35 (49): 15807– 15813. doi :10.1021/bi962042z. PMID 8961944.
- ^ Jiang, H.; Gelhaus, SL; Mangal, D.; Harvey, RG; Blair, IA; Penning, TM (2007). «Метаболизм бензо[a]пирена в человеческих бронхоальвеолярных клетках H358 с использованием жидкостной хроматографии-масс-спектрометрии». Chemical Research in Toxicology . 20 (9): 1331– 1341. doi :10.1021/tx700107z. PMC 2423818. PMID 17702526 .
- ^ Uno, S.; Dalton, TP; Dragin, N.; Curran, CP; Derkenne, S.; Miller, ML; Shertzer, HG; Gonzalez, FJ; Nebert, DW (2006). «Пероральный бензо[ a ]пирен у мышей с нокаутом Cyp1: CYP1A1 важен для детоксикации, метаболизм CYP1B1 необходим для иммунного повреждения независимо от общей нагрузки на организм и скорости клиренса». Молекулярная фармакология . 69 (4): 1103– 1112. doi :10.1124/mol.105.021501. PMID 16377763. S2CID 10834208.
- ^ Итон, DL; Галлахер, EP (1994). «Механизмы канцерогенеза афлатоксина». Ежегодный обзор фармакологии и токсикологии . 34 : 135–172 . doi :10.1146/annurev.pa.34.040194.001031. PMID 8042848.
- ^ Kleiböhmer, W. (2001). "Полициклические ароматические углеводороды (ПАУ) Метаболиты". Анализ окружающей среды (том 3 Handbook of Analytical Separations) . Elsevier . стр. 99–122 . ISBN 9780080505763.
- ^ Пфайфер, ГП; Денисенко, МФ; Оливье, М.; Третьякова, Н.; Хехт, СС; Эно, П. (2002). «Канцерогены табачного дыма, повреждение ДНК и мутации p53 при раковых заболеваниях, связанных с курением». Онкоген . 21 (48): 7435–7451 . doi : 10.1038/sj.onc.1205803 . PMID 12379884.
- ^ Хольштейн, М.; Сидрански, Д.; Фогельштейн, Б.; Харрис, CC (1991). "Мутации p53 при раке человека". Science . 253 (5015): 49– 53. Bibcode :1991Sci...253...49H. doi :10.1126/science.1905840. PMID 1905840. S2CID 38527914.
- ^ Уитлок, Дж. П. (1999). «Индукция цитохрома P4501A1». Ежегодный обзор фармакологии и токсикологии . 39 : 103–125 . doi :10.1146/annurev.pharmtox.39.1.103. PMID 10331078.
- ^ Уно, С.; Драгин, Н.; Миллер, М.Л.; Далтон, TP; Гонсалес, Ф.Дж.; Неберт, Д.В. (2008). «Базальная и индуцибельная количественная оценка мРНК CYP1 и локализация белка в желудочно-кишечном тракте мышей». Free Radical Biology and Medicine . 44 (4): 570–583 . doi :10.1016/j.freeradbiomed.2007.10.044. PMC 2754765. PMID 17997381 .
- ^ До, КН; Финк, ЛН; Дженсен, ТЕ; Готье, Л.; Парлесак, А. (2012). «TLR2 контролирует детоксикацию кишечных канцерогенов с помощью CYP1A1». PLoS ONE . 7 (3): e32309. Bibcode : 2012PLoSO ...732309D. doi : 10.1371/journal.pone.0032309 . PMC 3307708. PMID 22442665.
- ^ Стрибинскис, В.; Рамос, К. С. (2006). «Активация ретротранспозиции длинного перемежающегося ядерного элемента 1 человека бензо[а]пиреном, вездесущим экологическим канцерогеном». Cancer Research . 66 (5): 2616– 2620. doi : 10.1158/0008-5472.can-05-3478 . PMID 16510580.