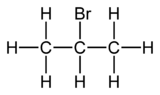
2-Бромпропан
 | |||
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК 2-Бромпропан [2] | |||
| Другие имена Изопропилбромид [1] | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| 741852 | |||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.000.778 | ||
| Номер ЕС |
| ||
| МеШ | 2-бромпропан | ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
| Номер ООН | 2344 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| Характеристики | |||
| С3Н7Бр | |||
| Молярная масса | 122,993 г·моль −1 | ||
| Появление | Бесцветная жидкость. | ||
| Плотность | 1,31 г мл −1 | ||
| Температура плавления | −89,0 °C; −128,1 °F; 184,2 К | ||
| Точка кипения | от 59 до 61 °C; от 138 до 142 °F; от 332 до 334 K | ||
| 3,2 г л −1 (при 20 °C) | |||
| лог P | 2.136 | ||
| Давление пара | 32 кПа (при 20 °C) | ||
Константа закона Генри ( k H ) | 1,0 мкмоль Па −1 моль −1 | ||
Показатель преломления ( nD ) | 1.4251 | ||
| Вязкость | 0,4894 мПа·с (при 20 °C) | ||
| Термохимия | |||
Теплоемкость ( С ) | 135,6 ДжК моль −1 | ||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −129 кДж моль −1 | ||
Стандартная энтальпия сгорания (Δ c H ⦵ 298 ) | −2,0537–−2,0501 МДж моль −1 | ||
| Опасности | |||
| Маркировка СГС : | |||
  | |||
| Опасность | |||
| Н225 , Н360 , Н373 | |||
| П210 , П308+П313 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 19 °C (66 °F; 292 К) | ||
| Родственные соединения | |||
Родственные алканы | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
2-Бромпропан , также известный как изопропилбромид и 2-пропилбромид , является галогенированным углеводородом с формулой CH3CHBrCH3 . Это бесцветная жидкость. Используется для введения изопропиловой функциональной группы в органическом синтезе . 2-Бромпропан получают нагреванием изопропанола с бромистоводородной кислотой . [ 3]
Подготовка
2-Бромпропан коммерчески доступен. Его можно приготовить обычным способом из алкилбромидов, путем реакции изопропанола с фосфором и бромом , [4] или с трибромидом фосфора . [5]
Безопасность
Короткоцепочечные алкилгалогениды часто являются канцерогенными .
Атом брома находится во вторичном положении, что позволяет молекуле легко подвергаться дегидрогалогенированию с образованием пропена , который выделяется в виде газа и может разрушить закрытые реакционные сосуды. Когда этот реагент используется в реакциях, катализируемых основаниями, вместо натрия или гидроксида калия следует использовать карбонат калия .
Дальнейшее чтение
- Макс Гергель , «Простите, сэр, не хотели бы вы купить килограмм изопропилбромида?» Pierce Chemical Co. (1979). (история о начинающей химической компании).
Ссылки
- ^ Armarego, Wilfred LF; Li Lin Chai, Christina (2013). Очистка лабораторных химикатов (7-е изд.). Butterworth-Heinemann. стр. 176. ISBN 9780123821621.
- ^ "2-бромпропан - Сводка по соединению". PubChem Compound . США: Национальный центр биотехнологической информации. 27 марта 2005 г. Идентификация . Получено 15 июня 2012 г.
- ^ "Монография 6526". Индекс химикатов и лекарств Merck.
- ^ Оливер Камм и CS Marvel (1941). "Алкил и алкиленбромиды". Органические синтезы; Собрание томов , т. 1, стр. 25.
- ^ CR Noller и R. Dinsmore (1943). "Изобутилбромид". Органические синтезы; Собрание томов , т. 2, стр. 358.





