Диоксид урана
 | |
| Имена | |
|---|---|
| Имена ИЮПАК Диоксид урана Оксид урана(IV) | |
| Другие имена Урания Оксид урана | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| Информационная карта ECHA | 100.014.273 |
| Номер ЕС |
|
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| УО 2 | |
| Молярная масса | 270,03 г/моль |
| Появление | черный порох |
| Плотность | 10,97 г/см 3 |
| Температура плавления | 2865 °C (5189 °F; 3138 K) |
| нерастворимый | |
| Структура | |
| Флюорит (кубический), cF12 | |
| Fm 3 m, № 225 | |
а = 547,1 пм [1] | |
| Тетраэдрический (O 2− ); кубический (U IV ) | |
| Термохимия | |
Стандартная молярная энтропия ( S ⦵ 298 ) | 78 Дж·моль −1 ·К −1 [2] |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −1084 кДж·моль −1 [2] |
| Опасности | |
| Маркировка СГС : | |
   | |
| Опасность | |
| Н300 , Н330 , Н373 , Н410 | |
| Р260 , Р264 , Р270 , Р271 , Р273 , Р284 , Р301+Р310 , Р304+Р340 , Р310 , Р314 , Р320 , Р321 , Р330 , Р391 , Р403+Р233 , Р405 , Р501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Н/Д |
| Паспорт безопасности (SDS) | МКХС 1251 |
| Родственные соединения | |
Другие анионы | Сульфид урана(IV) Селенид урана(IV) |
Другие катионы | Оксид протактиния(IV) Оксид нептуния(IV) |
| Оксид урана, триоксид урана | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Диоксид урана или оксид урана(IV) (UO2), также известный как уран или закись урана, является оксидом урана и представляет собой черный радиоактивный кристаллический порошок , который естественным образом встречается в минерале уранините . Он используется в ядерных топливных стержнях в ядерных реакторах . Смесь диоксидов урана и плутония используется в качестве МОКС-топлива . До 1960 года он использовался в качестве желтого и черного цвета в керамических глазурях и стекле.
Производство
Диоксид урана получают путем восстановления триоксида урана водородом .
- UO 3 + H 2 → UO 2 + H 2 O при 700 °C (973 K)
Эта реакция играет важную роль в создании ядерного топлива путем переработки ядерного топлива и обогащения урана .
Химия
Структура
Твердое тело изоструктурно (имеет ту же структуру, что и) флюорит ( фторид кальция ), где каждый U окружен восемью ближайшими соседями O в кубическом расположении. Кроме того, диоксиды церия , тория и трансурановые элементы от нептуния до калифорния имеют те же структуры. [3] Никакие другие элементарные диоксиды не имеют структуру флюорита. При плавлении измеренная средняя координация UO уменьшается с 8 в кристаллическом твердом теле (кубы UO 8 ) до 6,7 ± 0,5 (при 3270 К) в расплаве. [4] Модели, согласующиеся с этими измерениями, показывают, что расплав состоит в основном из полиэдрических единиц UO 6 и UO 7 , где примерно 2 ⁄ 3 связей между полиэдрами являются общими углами и 1 ⁄ 3 являются общими ребрами. [4]
- Диоксид урана
- Спеченная таблетка диоксида урана
Окисление
Диоксид урана окисляется при контакте с кислородом до октаоксида триурана .
- 3 UO 2 + O 2 → U 3 O 8 при 700 °C (973 К)
Электрохимия диоксида урана была подробно исследована, поскольку гальваническая коррозия диоксида урана контролирует скорость, с которой растворяется отработанное ядерное топливо. См. отработанное ядерное топливо для получения более подробной информации. Вода увеличивает скорость окисления плутония и урана. [5] [6]
Карбонизация
Диоксид урана при контакте с углеродом обугливается , образуя карбид урана и оксид углерода .
- .
Этот процесс необходимо проводить в атмосфере инертного газа , поскольку карбид урана легко окисляется обратно в оксид урана .
Использует
Ядерное топливо
UO2 используется в основном в качестве ядерного топлива , в частности в виде UO2 или в виде смеси UO2 и PuO2 ( диоксида плутония ), называемой смешанным оксидом ( МОКС-топливо ), в виде топливных стержней в ядерных реакторах .
Теплопроводность диоксида урана очень низкая по сравнению с ураном , нитридом урана , карбидом урана и циркониевым материалом оболочки. Эта низкая теплопроводность может привести к локальному перегреву в центрах топливных таблеток. На графике ниже показаны различные температурные градиенты в различных топливных соединениях. Для этих видов топлива тепловая плотность мощности одинакова, а диаметр всех таблеток одинаков. [ необходима цитата ]
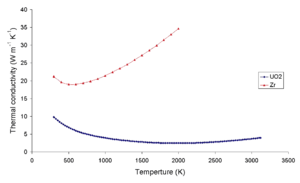
- Топливная таблетка из оксида урана
- Контейнеры для исходного материала для производства топливных таблеток из диоксида урана на заводе в России
Цвет для стеклокерамической глазури
Оксид урана (уран) использовался для окрашивания стекла и керамики до Второй мировой войны, и пока не были открыты возможности применения радиоактивности, это было его основным применением. В 1958 году военные США и Европы снова разрешили его коммерческое использование в качестве обедненного урана, и его использование снова началось в более ограниченных масштабах. Керамические глазури на основе урана имеют темно-зеленый или черный цвет при обжиге в восстановлении или при использовании UO2 ; чаще всего его используют при окислении для получения ярко-желтых, оранжевых и красных глазурей. [7] Оранжевый цвет Fiestaware является хорошо известным примером продукта с глазурью цвета урана. Урановое стекло имеет цвет от бледно-зеленого до желтого и часто обладает сильными флуоресцентными свойствами. Урана также использовали в составах эмали и фарфора . С помощью счетчика Гейгера можно определить , содержит ли глазурь или стекло, произведенные до 1958 года, уран.
Другие применения
До того, как стало известно о вреде радиации, уран включали в состав искусственных зубов и зубных протезов, поскольку его слабая флуоресценция делала зубные протезы более похожими на настоящие зубы при различных условиях освещения. [ необходима цитата ]
Обедненный UO 2 (DUO 2 ) может использоваться в качестве материала для радиационной защиты . Например, DUCRETE — это материал «тяжелого бетона », в котором гравий заменен наполнителем из диоксида урана; этот материал исследуется для использования в контейнерах для радиоактивных отходов . Контейнеры также могут быть изготовлены из DUO 2 — стальной металлокерамики , композитного материала, изготовленного из агрегата диоксида урана, служащего радиационной защитой, графита и/или карбида кремния, служащего поглотителем нейтронного излучения и замедлителем, и стали в качестве матрицы, чья высокая теплопроводность позволяет легко отводить остаточное тепло. [ необходима цитата ]
Обедненный диоксид урана может также использоваться в качестве катализатора , например, для разложения летучих органических соединений в газообразной фазе, окисления метана в метанол и удаления серы из нефти . Он обладает высокой эффективностью и долговременной стабильностью при использовании для разрушения ЛОС по сравнению с некоторыми коммерческими катализаторами , такими как драгоценные металлы , катализаторы TiO 2 и Co 3 O 4. В этой области проводится много исследований, причем DU предпочитают для уранового компонента из-за его низкой радиоактивности. [8]
Исследуется использование диоксида урана в качестве материала для перезаряжаемых батарей . Батареи могут иметь высокую плотность мощности и потенциал 4,7 В на ячейку. Другое исследуемое применение — фотоэлектрохимические ячейки для производства водорода с помощью солнечной энергии, где UO 2 используется в качестве фотоанода . Ранее диоксид урана также использовался в качестве теплопроводника для ограничения тока (URDOX-резистор), что было первым применением его полупроводниковых свойств. [ необходима цитата ]
Диоксид урана проявляет сильный пьезомагнетизм в антиферромагнитном состоянии, наблюдаемом при криогенных температурах ниже 30 кельвинов . Соответственно, линейная магнитострикция , обнаруженная в UO2 , меняет знак с приложенным магнитным полем и демонстрирует явления переключения магнитоупругой памяти при рекордно высоких полях переключения 180 000 Э. [9] Микроскопическое происхождение магнитных свойств материала кроется в симметрии гранецентрированной кубической кристаллической решетки атомов урана и ее реакции на приложенные магнитные поля. [10]
Свойства полупроводников
Ширина запрещенной зоны диоксида урана сопоставима с таковыми у кремния и арсенида галлия , близка к оптимальной для эффективности кривой зависимости ширины запрещенной зоны для поглощения солнечного излучения, что предполагает его возможное использование для очень эффективных солнечных элементов на основе структуры диода Шоттки ; он также поглощает на пяти различных длинах волн, включая инфракрасный, что еще больше повышает его эффективность. Его собственная проводимость при комнатной температуре примерно такая же, как у монокристаллического кремния. [11]
Диэлектрическая проницаемость диоксида урана составляет около 22, что почти вдвое выше, чем у кремния (11,2) и GaAs (14,1). Это преимущество перед Si и GaAs при построении интегральных схем , поскольку оно может обеспечить более высокую плотность интеграции с более высокими пробивными напряжениями и с меньшей восприимчивостью к туннельному пробою КМОП .
Коэффициент Зеебека диоксида урана при комнатной температуре составляет около 750 мкВ/К, что значительно превышает значение 270 мкВ/К для теллурида таллия и олова (Tl 2 SnTe 5 ) и теллурида таллия и германия (Tl 2 GeTe 5 ), а также для сплавов висмута с теллуром , других материалов, перспективных для применения в термоэлектрической энергетике и элементах Пельтье .
Влияние радиоактивного распада 235 U и 238 U на его полупроводниковые свойства не измерялось по состоянию на 2005 год [обновлять]. Из-за медленной скорости распада этих изотопов, это не должно существенно влиять на свойства солнечных элементов на основе диоксида урана и термоэлектрических устройств, но может стать важным фактором для чипов СБИС . По этой причине необходимо использование обедненного оксида урана. Захват альфа-частиц, испускаемых при радиоактивном распаде в виде атомов гелия в кристаллической решетке, также может вызывать постепенные долгосрочные изменения его свойств. [ необходима цитата ]
Стехиометрия материала существенно влияет на его электрические свойства. Например, электропроводность UO 1,994 на порядки ниже при более высоких температурах, чем проводимость UO 2,001 [ требуется цитата ] .
Диоксид урана, как и U3O8 , представляет собой керамический материал, способный выдерживать высокие температуры (около 2300 °C, по сравнению с максимум 200 ° C для кремния или GaAs), что делает его пригодным для высокотемпературных применений, таких как термофотоэлектрические устройства.
Диоксид урана также устойчив к радиационному воздействию, что делает его пригодным для создания радиационно-стойких устройств специального военного и аэрокосмического назначения.
Диод Шоттки из U3O8 и pnp - транзистор из UO2 были успешно изготовлены в лабораторных условиях. [ 12]
Токсичность
Известно, что диоксид урана поглощается путем фагоцитоза в легких. [13]
Смотрите также
Ссылки
- ^ Leinders, Gregory; Cardinaels, Thomas; Binnemans, Koen; Verwerft, Marc (2015). «Точные измерения параметров решетки стехиометрического диоксида урана». Journal of Nuclear Materials . 459 : 135–42. Bibcode : 2015JNuM..459..135L. doi : 10.1016/j.jnucmat.2015.01.029. S2CID 97183844.
- ^ ab Zumdahl, Steven S. (2009). Химические принципы 6-е изд . Houghton Mifflin Company. стр. A23. ISBN 978-0-618-94690-7.
- ^ Petit, L.; Svane, A.; Szotek, Z.; Temmerman, WM; Stocks, GM (2010-01-07). "Электронная структура и ионность оксидов актинидов из первых принципов". Physical Review B. 81 ( 4): 045108. arXiv : 0908.1806 . Bibcode : 2010PhRvB..81d5108P. doi : 10.1103/PhysRevB.81.045108. S2CID 118365366.
- ^ ab Skinner, LB; Benmore, CJ; Weber, JKR; Williamson, MA; Tamalonis, A.; Hebden, A.; Wiencek, T.; Alderman, OLG; Guthrie, M.; Leibowitz, L.; Parise, JB (2014). «Структура и динамика расплавленного диоксида урана». Science . 346 (6212): 984–7. Bibcode :2014Sci...346..984S. doi :10.1126/science.1259709. OSTI 1174101. PMID 25414311. S2CID 206561628.
- ^ Хашке, Джон М.; Аллен, Томас Х.; Моралес, Луис А. (1999). «Реакции диоксида плутония с водой и смесями кислорода и водорода: механизмы коррозии урана и плутония» (PDF) . doi :10.2172/756904 . Получено 06.06.2009 .
{{cite journal}}: Цитировать журнал требует|journal=( помощь ) - ^ Хашке, Джон М.; Аллен, Томас Х.; Моралес, Луис А. (2001). «Реакции диоксида плутония с водой и смесями водорода и кислорода: механизмы коррозии урана и плутония». Журнал сплавов и соединений . 314 (1–2): 78–91. doi :10.1016/S0925-8388(00)01222-6.
- ^ Ортель, Стефан. Уран в Керамике. Geschichte - Technik - Hersteller.
- ^ Хатчингс, Грэм Дж.; Хенеган, Кэтрин С.; Хадсон, Ян Д.; Тейлор, Стюарт Х. (1996). «Катализаторы на основе оксида урана для разрушения летучих хлорорганических соединений». Nature . 384 (6607): 341–3. Bibcode :1996Natur.384..341H. doi :10.1038/384341a0. S2CID 4299921.
- ^ Jaime, Marcelo; Saul, Andres; Salamon, Myron B.; Zapf, Vivien; Harrison, Neil; Durakiewicz, Tomasz; Lashley, Jason C.; Andersson, David A.; Stanek, Christopher R.; Smith, James L.; Gofryk, Krysztof (2017). "Пьезомагнетизм и магнитоупругая память в диоксиде урана". Nature Communications . 8 (1): 99. Bibcode :2017NatCo...8...99J. doi :10.1038/s41467-017-00096-4. PMC 5524652 . PMID 28740123.
- ^ Антонио, Дэниел Дж.; Вайс, Джоэл Т.; Шанкс, Кэтрин С.; Рафф, Джейкоб П. К.; Хайме, Марсело; Саул, Андрес; Суинберн, Томас; Саламон, Майрон Б.; Лавина, Барбара; Коури, Дэниел; Грюнер, Сол М.; Андерссон, Дэвид А.; Станек, Кристофер Р.; Дуракевич, Томаш; Смит, Джеймс Л.; Ислам, Захир; Гофрик, Кристоф (2021). "Пьезомагнитное переключение и сложные фазовые равновесия в диоксиде урана". Материалы по коммуникациям . 2 (1): 17. arXiv : 2104.06340 . Bibcode :2021CoMat...2...17A. doi :10.1038/s43246-021-00121-6. S2CID 231812027.
- ^ An, Yong Q.; Taylor, Antoinette J .; Conradson, Steven D.; Trugman, Stuart A.; Durakiewicz, Tomasz; Rodriguez, George (2011). "Сверхбыстрая динамика прыжков 5 f -электронов в изоляторе Мотта UO 2 , изученная с помощью фемтосекундной спектроскопии зондирования с накачкой". Physical Review Letters . 106 (20): 207402. Bibcode : 2011PhRvL.106t7402A. doi : 10.1103/PhysRevLett.106.207402. PMID 21668262.
- ^ Meek, Thomas T.; von Roedern, B. (2008). «Полупроводниковые приборы, изготовленные из оксидов актинидов». Vacuum . 83 (1): 226–8. Bibcode :2008Vacuu..83..226M. doi :10.1016/j.vacuum.2008.04.005.
- ^ Принципы биохимической токсикологии. Тимбрелл, Джон. PA 2008 ISBN 0-8493-7302-6 [ нужна страница ]
Дальнейшее чтение
- Barrett, SA; Jacobson, AJ; Tofield, BC; Fender, BEF (1982). "Получение и структура оксида бария-урана BaUO3+x". Acta Crystallographica Section B. 38 ( 11): 2775. Bibcode : 1982AcCrB..38.2775B. doi : 10.1107/S0567740882009935.
Внешние ссылки
- Полупроводниковые свойства оксидов урана Архивировано 2012-09-01 на Wayback Machine
- Бесплатный список словарей для диоксида урана
- Диоксид урана. Архивировано 16 сентября 2013 г. в Wayback Machine International Bio-Analytical Industries, Inc.








