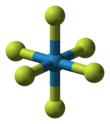
Гексафторид вольфрама
 Твердый WF 6 плавится в жидкий WF 6 | |||
| |||
| Имена | |||
|---|---|---|---|
| Имена ИЮПАК Гексафторид вольфрама Фторид вольфрама(VI) | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| Информационная карта ECHA | 100.029.117 | ||
| Номер ЕС |
| ||
CID PubChem |
| ||
| УНИИ | |||
| Номер ООН | 2196 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| ВФ 6 | |||
| Молярная масса | 297,830 г/моль | ||
| Появление | Бесцветный газ. | ||
| Плотность | 12,4 г/л (газ) 4,56 г/см 3 (−9 °C, твердое вещество) | ||
| Температура плавления | 2,3 °C (36,1 °F; 275,4 К) | ||
| Точка кипения | 17,1 °C (62,8 °F; 290,2 К) | ||
| Гидролизуется | |||
| −40,0·10 −6 см 3 /моль | |||
| Структура | |||
| Октаэдрический | |||
| ноль | |||
| Опасности | |||
| Охрана труда и техника безопасности (OHS/OSH): | |||
Основные опасности | Токсичный, едкий; при контакте с водой выделяет HF | ||
| Маркировка СГС : [1] | |||
  | |||
| Опасность | |||
| Н301+Н311 , Н314 , Н330 | |||
| Р260 , Р264 , Р264+Р265 , Р270 , Р271 , Р280 , Р284 , Р301+Р316 , Р301+Р330+Р331 , Р302+Р352 , Р302+Р361+Р354 , Р304+Р340 , Р305+Р354+Р338 , Р316 , Р317 , Р320 , Р321 , Р330 , Р361+Р364 , Р363 , Р403+Р233 , Р405 , Р410+Р403 , Р501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Негорючий | ||
| Паспорт безопасности (SDS) | Химсоветник | ||
| Родственные соединения | |||
Другие анионы | Гексахлорид вольфрама Гексабромид вольфрама | ||
Другие катионы | Фторид хрома(VI) Фторид молибдена(VI) | ||
Родственные соединения | Фторид вольфрама(IV) Фторид вольфрама(V) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Фторид вольфрама(VI) , также известный как гексафторид вольфрама , представляет собой неорганическое соединение с формулой WF6 . Это токсичный, едкий, бесцветный газ с плотностью около 13 кг/м3 ( 22 фунта/куб. ярд) (примерно в 11 раз тяжелее воздуха). [2] [3] Это единственное известное газообразное соединение переходного металла (или d-блока) и самый плотный известный газ при стандартной температуре и давлении окружающей среды (298 К, 1 атм). [4] WF6 обычно используется в полупроводниковой промышленности для формирования вольфрамовых пленок с помощью процесса химического осаждения из паровой фазы . Этот слой используется в металлических « межсоединениях » с низким удельным сопротивлением . [5] Это один из семнадцати известных бинарных гексафторидов .
Характеристики
Молекула WF 6 является октаэдрической с точечной группой симметрии O h . Расстояния связей W–F равны183,2 вечера . [6] Между2,3 и 17 °C гексафторид вольфрама конденсируется в бесцветную жидкость плотностью3,44 г/см 3 при15 °C . [7] При2,3 °C замерзает, образуя белое твердое вещество с кубической кристаллической структурой, постоянной решетки 628 пм и расчетной плотностью3,99 г/см 3 . При−9 °C эта структура трансформируется в орторомбическое твердое тело с постоянными решетки a = 960,3 пм, b = 871,3 пм и c = 504,4 пм, а плотность4,56 г/см 3 . В этой фазе расстояние W–F составляет 181 пм, а средние ближайшие молекулярные контакты составляют312 пм . В то время как газ WF 6 является одним из самых плотных газов, с плотностью, превышающей плотность самого тяжелого элементарного газа радона (9,73 г/л), плотность WF 6 в жидком и твердом состоянии довольно умеренная. [8] Давление паров WF 6 между−70 и 17 °C можно описать уравнением
- логарифм 10 P = 4,55569 − 1021.208/ Т + 208.45 ,
где P = давление пара ( бар ), T = температура (°C). [9] [10]
История и синтез
Гексафторид вольфрама был впервые получен путем конверсии гексахлорида вольфрама с фтористым водородом Отто Руффом и Фрицем Эйснером в 1905 году. [11] [12]
- WCl6 + 6HF → WF6 + 6HCl
В настоящее время это соединение обычно получают путем экзотермической реакции газообразного фтора с порошком вольфрама при температуре от350 и 400 °C : [7]
- В + 3 Ф 2 → ВФ 6
Газообразный продукт отделяется от WOF 4 , распространенной примеси, путем перегонки. В варианте прямого фторирования металл помещается в нагретый реактор, слегка нагнетаемый до 1,2–2,0 фунтов на квадратный дюйм (8,3–13,8 кПа), с постоянным потоком WF 6 , в который добавлено небольшое количество фтористого газа. [13]
Фтористый газ в вышеприведенном методе может быть заменен на ClF , ClF 3 или BrF 3 . Альтернативная процедура получения фторида вольфрама заключается в обработке триоксида вольфрама ( WO 3 ) с помощью HF , BrF 3 или SF 4 . И помимо HF, другие фторирующие агенты также могут быть использованы для преобразования гексахлорида вольфрама способом, аналогичным оригинальному методу Раффа и Эйснера: [4]
- WCl 6 + 2 AsF 3 → WF 6 + 2 AsCl 3 или
- WCl 6 + 3 SbF 5 → WF 6 + 3 SbF 3 Cl 2
Реакции
При контакте с водой гексафторид вольфрама дает фтористый водород (HF) и оксифториды вольфрама, в конечном итоге образуя триоксид вольфрама : [4]
- WF6 + 3H2O → WO3 + 6HF
В отличие от некоторых других фторидов металлов, WF 6 не является полезным фторирующим агентом и не является сильным окислителем. Его можно восстановить до желтого WF 4 . [14]
WF 6 образует множество аддуктов 1:1 и 1:2 с основаниями Льюиса , примерами которых являются WF 6 ( S(CH 3 ) 2 ), WF 6 (S(CH 3 ) 2 ) 2 , WF 6 ( P(CH 3 ) 3 ) и WF 6 ( py ) 2 . [15]
Применение в полупроводниковой промышленности
Основное применение фторида вольфрама — полупроводниковая промышленность, где он широко используется для осаждения металлического вольфрама в процессе химического осаждения из паровой фазы (CVD). Расширение промышленности в 1980-х и 1990-х годах привело к увеличению потребления WF 6 , которое по-прежнему составляет около 200 тонн в год во всем мире. Металлический вольфрам привлекателен своей относительно высокой термической и химической стабильностью, а также низким удельным сопротивлением (5,6 мкОм·см) и очень низкой электромиграцией . WF 6 предпочтительнее родственных соединений, таких как WCl 6 или WBr 6 , из-за более высокого давления паров, что приводит к более высоким скоростям осаждения. С 1967 года были разработаны и использованы два способа осаждения WF 6 : термическое разложение и восстановление водородом. [16] Требуемая чистота газа WF 6 довольно высока и варьируется от 99,98% до 99,9995% в зависимости от применения. [4]
Молекулы WF 6 должны быть разделены в процессе CVD. Разложение обычно облегчается путем смешивания WF 6 с водородом, силаном , германом , дибораном , фосфином и соответствующими водородсодержащими газами.
Кремний
WF 6 реагирует при контакте с кремниевой подложкой. [4] Разложение WF 6 на кремнии зависит от температуры:
- 2 WF 6 + 3 Si → 2 W + 3 SiF 4 ниже 400 °C и
- WF 6 + 3 Si → W + 3 SiF 2 выше 400 °C.
Эта зависимость имеет решающее значение, так как при более высоких температурах потребляется в два раза больше кремния. Осаждение происходит селективно только на чистом кремнии, но не на оксиде кремния или нитриде кремния, поэтому реакция очень чувствительна к загрязнению или предварительной обработке подложки. Реакция разложения быстрая, но насыщается, когда толщина слоя вольфрама достигает 10–15 микрометров . Насыщение происходит потому, что слой вольфрама останавливает диффузию молекул WF 6 к подложке Si, которая является единственным катализатором молекулярного разложения в этом процессе. [4]
Если осаждение происходит не в инертной, а в кислородсодержащей атмосфере (воздухе), то вместо вольфрама образуется слой оксида вольфрама. [17]
Водород
Процесс осаждения происходит при температурах от 300 до 800 °C и приводит к образованию паров фтористого водорода :
- ВФ 6 + 3 Ч 2 → В + 6 ВЧ
Кристалличность полученных слоев вольфрама можно контролировать, изменяя соотношение WF 6 / H 2 и температуру подложки: низкие соотношения и температуры приводят к кристаллитам вольфрама с ориентацией (100) , тогда как более высокие значения благоприятствуют ориентации (111). Образование HF является недостатком, поскольку пары HF очень агрессивны и вытравливают большинство материалов. Кроме того, осажденный вольфрам показывает плохую адгезию к диоксиду кремния, который является основным пассивирующим материалом в полупроводниковой электронике. Поэтому SiO 2 должен быть покрыт дополнительным буферным слоем перед осаждением вольфрама. С другой стороны, травление HF может быть полезным для удаления нежелательных примесных слоев. [4]
Силан и герман
Характерными особенностями осаждения вольфрама из WF 6 / SiH 4 являются высокая скорость, хорошая адгезия и гладкость слоя. Недостатками являются взрывоопасность и высокая чувствительность скорости осаждения и морфологии к параметрам процесса, таким как соотношение смешивания, температура подложки и т. д. Поэтому для создания тонкого слоя зародышеобразования вольфрама обычно используют силан. Затем его переключают на водород, который замедляет осаждение и очищает слой. [4]
Осаждение из смеси WF 6 / GeH 4 аналогично осаждению из смеси WF 6 / SiH 4 , но вольфрамовый слой загрязняется относительно (по сравнению с Si) тяжелым германием до концентраций 10–15%. Это увеличивает сопротивление вольфрама примерно с 5 до 200 мкОм·см. [4]
Другие приложения
WF 6 может использоваться для производства карбида вольфрама .
Как тяжелый газ, WF 6 может использоваться в качестве буфера для управления газовыми реакциями. Например, он замедляет химию пламени Ar/ O 2 / H 2 и снижает температуру пламени. [18]
Безопасность
Гексафторид вольфрама является чрезвычайно едким соединением, которое воздействует на любую ткань. Из-за образования плавиковой кислоты при реакции WF 6 с влажностью, емкости для хранения WF 6 имеют тефлоновые прокладки. [19]
Ссылки
- ^ "Гексафторид вольфрама". pubchem.ncbi.nlm.nih.gov .
- ^ Рукан, Ж.-П.; Ноэль-Дютрио, М.-К. Proprietes Physiques des Composes Mineraux. Эд. Инженер-техник. п. 138.
- ^ Газовая диаграмма (архив Wayback Machine 7 сентября 2022 г.)
- ^ abcdefghi Ласснер, Э.; Шуберт, В.-Д. (1999). Вольфрам - свойства, химия, технология элемента, сплавов и химических соединений. Springer. стр. 111, 168. ISBN 0-306-45053-4.
- ^ "Химическое осаждение из паровой фазы вольфрама и силицида вольфрама". Основы химического осаждения из паровой фазы . TimeDomain CVD.
- ^ Lide, DR, ред. (2005). CRC Handbook of Chemistry and Physics (86-е изд.). Бока-Ратон, Флорида: CRC Press. ISBN 0-8493-0486-5.стр. 4-93.
- ^ ab Priest, HF; Swinehert, CF (1950). "Безводные фториды металлов". В Audrieth, LF (ред.). Неорганические синтезы . Том 3. Wiley-Interscience. стр. 171– 183. doi :10.1002/9780470132340.ch47. ISBN 978-0-470-13162-6.
- ^ Леви, Дж. (1975). «Структуры фторидов XIII: орторомбическая форма гексафторида вольфрама при 193 К по данным нейтронной дифракции». Журнал химии твердого тела . 15 (4): 360–365 . Bibcode : 1975JSSCh..15..360L. doi : 10.1016/0022-4596(75)90292-3.
- ^ Кэди, GH; Харгривз, GB, «Давление паров некоторых фторидов и оксифторидов молибдена, вольфрама, рения и осмия», Журнал химического общества, апрель 1961 г., стр. 1568-& DOI: 10.1039/jr9610001568
- ^ Stull, Daniel R. (1947). «Давление паров чистых веществ. Органические и неорганические соединения». Industrial & Engineering Chemistry . 39 (4): 517– 540. doi :10.1021/ie50448a022.
- ^ Отто Рафф ; Фриц Эйснер (январь 1905 г.). «Ueber das Вольфрам-гексафторид» (PDF) . Berichte der Deutschen Chemischen Gesellschaft (на немецком языке). 38 (1): 742–747 . doi : 10.1002/CBER.190503801120. ISSN 0365-9496. Викиданные Q56639371.
- ^ Ерш, Отто ; Эйснер, Фриц; Хеллер, Вильгельм (1907). «Über die Darstellung und Eigenschaften von Fluoriden des sechswertigen Wolframs». Zeitschrift für anorganische Chemie (на немецком языке). 52 (1): 256–269 . doi :10.1002/zaac.19070520122. ISSN 1521-3749.
- ^ Патент США 6544889, «Способ химического осаждения вольфрама из паровой фазы на полупроводниковую подложку», выдан 2003-04-08
- ^ Гринвуд, NN; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ Бенджамин, Софи Л.; Левасон, Уильям; Рид, Джиллиан (2013). «Комплексы металлов/неметаллов со средней и высокой степенью окисления и оксидно-фторидные комплексы с нейтральными донорными лигандами». Chem. Soc. Rev. 42 ( 4): 1460– 1499. doi :10.1039/C2CS35263J. PMID 23014811.
- ^ Aigueperse, J.; Mollard, P.; Devilliers, D.; Chemla, M.; Faron, R.; Romano, R.; Cuer, J.-P. (2005). "Соединения фтора, неорганические". В Ullmann (ред.). Энциклопедия промышленной химии . Weinheim: Wiley-VCH.
- ^ Кирсс, РУ; Меда, Л. (1998). "Химическое осаждение из паровой фазы оксида вольфрама" (PDF) . Прикладная металлоорганическая химия . 12 (3): 155– 160. doi :10.1002/(SICI)1099-0739(199803)12:3<155::AID-AOC688>3.0.CO;2-Z. hdl : 2027.42/38321 .
- ^ Ifeacho, P. (2008). Полупроводниковые наночастицы оксида металла из предварительно смешанного пламени низкого давления H2/O2/Ar: синтез и характеристика. Геттинген: Cuvillier Verlag. стр. 64. ISBN 978-3-86727-816-4.
- ^ "Гексафторид вольфрама MSDS" (PDF) . Linde Gas. Архивировано из оригинала (PDF) 2010-02-12.