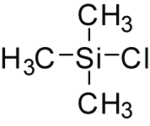
Триметилсилилхлорид
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Хлортри(метил)силан | |||
| Другие имена Триметилсилилхлорид Хлортриметилсилан TMSCl Триметилхлорсилан TMCS | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ChemSpider | |||
| Информационная карта ECHA | 100.000.819 | ||
| Номер ЕС |
| ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
| Номер ООН | 1298 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| Характеристики | |||
| C3H9SiCl | |||
| Молярная масса | 108,64 г/моль | ||
| Появление | Бесцветная жидкость, дымит во влажном воздухе. | ||
| Плотность | 0,856 г/см 3 , жидкость | ||
| Температура плавления | −40 °C (−40 °F; 233 К) | ||
| Точка кипения | 57 °C (135 °F; 330 К) | ||
| Реагирует | |||
| −77,36·10 −6 см 3 /моль | |||
| Структура | |||
| Тетраэдрический в Si | |||
| Опасности | |||
| Маркировка СГС : | |||
     | |||
| Опасность | |||
| Н225 , Н301 , Н312 , Н314 , Н331 , Н351 | |||
| Р201 , Р202 , Р210 , Р233 , Р240 , Р241 , Р242 , Р243 , Р260 , Р261 , Р264 , Р270 , Р271 , Р280 , Р281 , Р301+Р310 , Р301+Р330+Р331 , Р302+Р352 , Р303+Р361+Р353 , Р304+Р340 , Р305+Р351+Р338 , Р308+Р313 , Р310 , Р311 , Р312 , Р321 , Р322 , Р330 , Р363 , Р370+Р378 , П403+П233 , П403+П235 , П405 , П501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | −28 °C (−18 °F; 245 K) | ||
| 400 °C (752 °F; 673 К) | |||
| Родственные соединения | |||
Родственные галогенсиланы | Триметилсилилфторид Триметилсилилбромид Триметилсилилйодид | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Триметилсилилхлорид , также известный как хлортриметилсилан , является кремнийорганическим соединением ( галогенид силила ) с формулой (CH3 ) 3SiCl , часто сокращенно Me3SiCl или TMSCl . Это бесцветная летучая жидкость, стабильная в отсутствие воды. Широко используется в органической химии .
Подготовка
TMSCl получают в больших масштабах прямым способом , реакцией метилхлорида с кремний-медным сплавом. Основной целью этого процесса является диметилдихлорсилан , но также получаются значительные количества триметильных и монометильных продуктов. [1] Соответствующие реакции следующие (Me = метил , CH 3 ):
Обычно около 2–4% потока продукта составляет монохлорид, который образует азеотроп с MeSiCl3 .
Реакции и использование
TMSCl реагирует с нуклеофилами, что приводит к замене хлорида. В характерной реакции TMSCl нуклеофилом является вода, что приводит к гидролизу с образованием гексаметилдисилоксана : Связанная реакция триметилсилилхлорида со спиртами может быть использована для получения безводных растворов соляной кислоты в спиртах, которые находят применение в мягком синтезе сложных эфиров из карбоновых кислот и нитрилов , а также ацеталей из кетонов . Аналогично, триметилсилилхлорид также используется для силанизации лабораторной стеклянной посуды , делая поверхности более липофильными . [2]
Силилирование в органическом синтезе
В процессе силилирования полярные функциональные группы, такие как спирты и амины, легко вступают в реакцию с триметилсилилхлоридом, давая триметилсилиловые эфиры и триметилсилиламины . Эти новые группы «защищают» исходную функциональную группу, удаляя лабильные протоны и уменьшая основность гетероатома. Лабильность групп Me 3 Si − O и Me 3 Si−N позволяет легко удалить их впоследствии («снять защиту»). Триметилсилилирование также можно использовать для повышения летучести соединения, что позволяет проводить газовую хроматографию обычно нелетучих веществ, таких как глюкоза .
Триметилсилилхлорид также реагирует с карбанионами, давая триметилсилильные производные. [3] Ацетилениды лития реагируют, давая триметилсилильные алкины, такие как бис(триметилсилил)ацетилен . Такие производные являются полезными защищенными формами алкинов.
В присутствии триэтиламина и диизопропиламида лития енолизируемые альдегиды , кетоны и сложные эфиры преобразуются в триметилсилиловые енольные эфиры . [4] Несмотря на свою гидролитическую нестабильность, эти соединения нашли широкое применение в органической химии; окисление двойной связи эпоксидированием или дигидроксилированием может быть использовано для возврата исходной карбонильной группы со спиртовой группой у альфа-углерода. Триметилсилиловые енольные эфиры также могут быть использованы в качестве замаскированных енолятных эквивалентов в альдольной реакции Мукаямы .
Обезвоживание
Дегидратация хлоридов металлов с триметилсилилхлоридом в ТГФ дает сольват, как показано на примере трихлорида хрома : [5]
Другие реакции
Триметилсилилхлорид используется для получения других триметилсилилгалогенидов и псевдогалогенидов , включая триметилсилилфторид, триметилсилилбромид, триметилсилилйодид , триметилсилилцианид , триметилсилилазид , [6] и триметилсилилтрифторметансульфонат (TMSOTf). Эти соединения получаются реакцией солевого метатезиса между триметилсилилхлоридом и солью (псевдо)галогенида (MX): TMSCl, литий и молекула азота реагируют, образуя трис(триметилсилил)амин , при катализе нихромовой проволокой или трихлоридом хрома : Используя этот подход, атмосферный азот может быть введен в органический субстрат. Например, трис(триметилсилил)амин реагирует с α,δ,ω-трикетонами, образуя трициклические пирролы . [7]
Восстановление триметилсилилхлорида дает гексаметилдисилан :
Ссылки
- ^ Рёше, Л.; Джон, П.; Рейтмайер, Р. «Органические кремниевые соединения». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. doi :10.1002/14356007.a24_021. ISBN 978-3-527-30673-2.
{{cite encyclopedia}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Например, в работе Норберта Зандера и Рональда Франка (2005). «Использование полистирилсульфонилхлоридной смолы в качестве твердого конденсационного реагента для образования сложных эфиров: синтез N-[(9-флуоренилметокси)карбонил]-L-аспарагиновой кислоты; α-трет-бутилового эфира, β-(2-этил[(1E)-(4-нитрофенил)азо]фенил]амино]этилового эфира». Органические синтезы . 81 : 235.
- ^ Стефани Ганс; Джулия Педронль; Александр Лумброзо; Гюнтер Леонхардт-Люттербек; Антье Мейсснер; Сипинг Вэй; Ханс-Йоахим Дрекслер; Детлеф Хеллер; Бернхард Брайт (2016). «Катализируемое родием присоединение карбоксильных кислот к терминальным алкинам в направлении Z-енольных эфиров». Org. Synth . 93 : 367–384 . doi : 10.15227/orgsyn.093.0367 .
- ^ Ёсихико Ито, Шотаро Фудзии, Масаши Накатуска, Фумио Кавамото и Такео Саегуса (1979). «Расширение одноуглеродного кольца циклоалканонов до сопряженного циклоалкенона: 2-циклогептен-1-он». Органические синтезы . 59 : 113
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ); Собрание томов , т. 1, стр. 327. - ^ Филип Буджук; Чжон-Хо Со (1992). «Сольватированные и несольватированные безводные хлориды металлов из гидратов хлоридов металлов». Неорганические синтезы . Т. 29. С. 108–111. doi : 10.1002 /9780470132609.ch26. ISBN 978-0-470-13260-9.
{{cite book}}:|journal=проигнорировано ( помощь ) - ^ Л. Биркофер и П. Вегнер (1970). "Триметилсилил азид". Органические синтезы . 50 : 107; Собрание томов , т. 6, стр. 1030.
- ^ Брук, Майкл А. (2000). Кремний в органической, металлоорганической и полимерной химии . Нью-Йорк: John Wiley & Sons. С. 193–194 .






![{\displaystyle x\ {\ce {MeCl + Si}}\longrightarrow {\begin{cases}{\ce {Me3SiCl}},\\[2pt]{\ce {Me2SiCl2}},\\[2pt]{\ce {MeSiCl3}},\\[2pt]{\text{и т. д.}}\end{cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1690fa91cc5b4389913c67077f81c5b4428e56cb)




