Парентеральное питание
| Парентеральное питание | |
|---|---|
 Домашняя формула TPN |
Парентеральное питание ( ПП ), или внутривенное питание , представляет собой введение человеку питательных продуктов внутривенно , [1] минуя обычный процесс приема пищи и пищеварения. Продукты производятся фармацевтическими предприятиями или стандартными фармацевтическими компаниями. [2] [3] Человек получает питательную смесь в соответствии с формулой, включающей глюкозу , соли , аминокислоты , липиды , витамины и диетические минералы . [4] Это называется полным парентеральным питанием ( ППП ) или полной питательной смесью ( ОПП ), когда существенное питание не получается другими путями, и частичным парентеральным питанием ( ППП ), когда питание также частично энтеральное . Это называется периферическим парентеральным питанием ( ППП ), когда вводится через венозный доступ в конечности, а не через центральную вену , как при центральном венозном питании ( ЦВП ). [5]
Медицинское применение
Полное парентеральное питание (ППП) предоставляется, когда желудочно-кишечный тракт не функционирует из-за нарушения его непрерывности (он заблокирован или имеет утечку - свищ ) или из-за нарушения его всасывающей способности. [6] Его использовали для пациентов в коме , хотя энтеральное питание обычно предпочтительнее и менее подвержено осложнениям. Парентеральное питание используется для предотвращения недоедания у пациентов, которые не могут получить достаточное количество питательных веществ пероральным или энтеральным путем. [7] Общество интенсивной терапии (SCCM) и Американское общество парентерального и энтерального питания рекомендуют подождать до седьмого дня лечения в больнице. [8]
Абсолютные показания к ППП
Заболевания, требующие использования ППП, включают: [8]
- Синдром короткой кишки
- Непроходимость тонкого кишечника
- Активное желудочно-кишечное кровотечение
- Псевдообструкция с полной непереносимостью пищи
- Кишечно-кожные свищи с высоким объемом жидкости (определяется как > 500 мл/день) (если только зонд для кормления не может быть проведен дистальнее свища)
Желудочно-кишечные расстройства
ППП может быть единственным возможным вариантом обеспечения питанием пациентов, у которых не функционирует желудочно-кишечный тракт или у которых есть расстройства, требующие полного покоя кишечника, включая непроходимость кишечника , [9] синдром короткой кишки , [9] гастрошизис , [9] длительную диарею независимо от ее причины, [9] очень тяжелую болезнь Крона [9] или язвенный колит , [9] и некоторые детские расстройства желудочно-кишечного тракта, включая врожденные аномалии желудочно-кишечного тракта и некротизирующий энтероколит . [10]
В гериатрической популяции
Существуют физические, физиологические или психические различия в гериатрической популяции, которые потенциально могут привести к недостаточному потреблению питательных веществ, что потребует от них проведения нутрициологической терапии. [11] Гериатрические пациенты более склонны к замедленному восстановлению мышц по сравнению с более молодой популяцией. Кроме того, у пожилых пациентов наблюдается более выраженная сердечная и почечная недостаточность, резистентность к инсулину и дефицит витаминов и важнейших элементов. Пациенты, которым требуется нутрициологическая терапия, но которые имеют противопоказания или не могут переносить энтеральное питание, являются подходящими кандидатами на парентеральное питание. В гериатрической популяции оно показано, если пероральное или энтеральное питание невозможно в течение 3 дней или когда пероральное или энтеральное питание, вероятно, недостаточно в течение более 7-10 дней. Хотя нет никаких осложнений парентерального питания, характерных для гериатрической популяции, осложнения более распространены в этой популяции из-за увеличения сопутствующих заболеваний . [12]
При раке
Пациенты, у которых диагностирован рак, будь то амбулаторные пациенты, проходящие лечение или госпитализированные, подвержены большему риску недоедания и кахексии . Недоедание, связанное с раком, может быть связано с уменьшением потребления пищи, увеличением потребности в энергии и изменением метаболизма. [13] Пациенты должны быть оценены на ранней стадии лечения рака на предмет любого риска, связанного с питанием, например, путем регулярного измерения веса и ИМТ. Парентеральное питание показано онкологическим больным, когда невозможно получить доступ к пищеварительному тракту или если тракт неэффективен. У пациентов с запущенным раком использование ПП следует обсуждать в контексте рисков и преимуществ, например, если приблизительный показатель выживаемости превышает 3 месяца и можно ли ожидать, что ПП значительно улучшит качество жизни пациентов. [13]
Неясно, улучшает ли домашнее парентеральное питание выживаемость или качество жизни людей со злокачественной кишечной непроходимостью . [14]
Продолжительность
Краткосрочное ПП может использоваться, если пищеварительная система человека отказала (например, из-за перитонита ), и у него достаточно низкий вес, чтобы вызывать опасения по поводу питания во время длительного пребывания в больнице. Долгосрочное ПП иногда используется для лечения людей, страдающих от длительных последствий несчастного случая, операции или расстройства пищеварения. ПП продлило жизнь детей, рожденных с несуществующими или сильно деформированными органами.
Жизнь с ТПС
Около 40 000 человек используют ППП дома в Соединенных Штатах, и поскольку для введения ППП требуется 10–16 часов, это может повлиять на повседневную жизнь. [15] Хотя повседневный образ жизни можно изменить, большинство пациентов соглашаются, что эти изменения лучше, чем пребывание в больнице. [16] Существует множество различных типов насосов, позволяющих ограничить время, в течение которого пациент «подключен». Обычно используется ранцевый насос, обеспечивающий мобильность. Время, необходимое для подключения к капельнице, зависит от ситуации каждого пациента; некоторым требуется один раз в день или пять дней в неделю. [15]
Пациентам важно избегать как можно большего количества изменений, связанных с ПНП, в своем образе жизни. Это позволяет достичь наилучшего возможного состояния психического здоровья; постоянное угнетение может привести к обиде и депрессии . Физическая активность также настоятельно рекомендуется, но пациентам следует избегать контактных видов спорта (повреждение оборудования) и плавания (инфекция). Многим подросткам трудно жить с ПНП из-за проблем, связанных с образом тела , и невозможности участвовать в мероприятиях и событиях. [15]
Осложнения
TPN полностью обходит желудочно-кишечный тракт и обычные методы всасывания питательных веществ. Возможные осложнения, которые могут быть значительными, перечислены ниже. Помимо перечисленных ниже, распространенные осложнения TPN включают гипофосфатемию, гипокалиемию, гипергликемию, гиперкапнию, снижение уровня меди и цинка, повышенное протромбиновое время (если связано с повреждением печени), гиперхлоремический метаболический ацидоз и снижение моторики желудочно-кишечного тракта. [8]
Инфекция
TPN требует хронического внутривенного доступа для прохождения раствора, и наиболее распространенным осложнением является инфицирование этого катетера. Инфекция является частой причиной смерти у этих пациентов, с уровнем смертности приблизительно 15% на инфекцию, и смерть обычно наступает в результате септического шока . [17] При использовании центрального венозного доступа подключичная (или подмышечная) вена является предпочтительной из-за простоты доступа и наименьших инфекционных осложнений по сравнению с введением в яремную и бедренную вену. [6]
Осложнения катетера включают пневмоторакс , случайную артериальную пункцию и сепсис, связанный с катетером. Частота осложнений во время введения должна быть менее 5%. Инфекции, связанные с катетером, можно свести к минимуму путем правильного выбора катетера и техники введения. [18]
Сгустки крови
Хронический внутривенный доступ оставляет инородное тело в сосудистой системе, и тромбы в этой линии внутривенного вливания являются обычным явлением. [19] Смерть может наступить в результате тромбоэмболии легочной артерии , когда тромб, который начинается в линии внутривенного вливания, отрывается и перемещается в легкие, блокируя кровоток. [20]
Пациентам, находящимся на ППП и имеющим такие тромбы, закупоривающие катетер, может быть проведена тромболитическая промывка для растворения тромбов и предотвращения дальнейших осложнений.
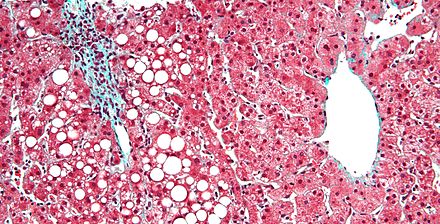
Жировая дистрофия печени и печеночная недостаточность
Жировая дистрофия печени обычно является более долгосрочным осложнением TPN, хотя при достаточно длительном течении она встречается довольно часто. Патогенез обусловлен использованием линолевой кислоты ( компонент жирной кислоты омега-6 соевого масла) в качестве основного источника калорий. [21] [22] Заболевание печени, связанное с TPN, поражает до 50% пациентов в течение 5–7 лет, что коррелирует с уровнем смертности 2–50%. Начало этого заболевания печени является основным осложнением, которое приводит к тому, что пациентам TPN требуется трансплантация кишечника . [23]
Intralipid ( Fresenius-Kabi ), стандартная липидная эмульсия США для питания TPN, содержит соотношение полиненасыщенных жирных кислот (ПНЖК) n-6/n-3 в соотношении 7:1. Напротив, Omegaven имеет соотношение 1:8 и показал многообещающие результаты в многочисленных клинических исследованиях. Таким образом, жир, богатый n-3, может изменить течение заболевания печени, связанного с парентеральным питанием (PNALD). [24]
Голод
Поскольку пациенты питаются внутривенно, субъект физически не ест, что приводит к сильным мукам голода (болям). Мозг использует сигналы изо рта ( вкус и запах ), желудка и желудочно-кишечного тракта (наполнение) и крови ( уровень питательных веществ ), чтобы определить осознанное чувство голода . [25] В случаях ППП требования вкуса, запаха и физической сытости не выполняются, и поэтому пациент испытывает голод, хотя тело полностью питается.
Пациенты, которые едят пищу, несмотря на невозможность ее приема, могут испытывать широкий спектр осложнений, таких как синдром повторного кормления . [26]
Холецистит
Полное парентеральное питание увеличивает риск острого холецистита [27] из-за полного неиспользования желудочно-кишечного тракта, что может привести к застою желчи в желчном пузыре . Другие потенциальные гепатобилиарные дисфункции включают стеатоз , [28] стеатогепатит , холестаз и желчнокаменную болезнь . [29] У шести процентов пациентов, находящихся на ППП более трех недель, и у 100% пациентов, находящихся на ППП более 13 недель, развивается желчный сладж . Образование сладжа является результатом стаза из-за отсутствия энтеральной стимуляции и не связано с изменениями в составе желчи. Сладж в желчном пузыре исчезает через четыре недели нормальной пероральной диеты. Было показано, что введение экзогенного холецистокинина (ХЦК) или стимуляция эндогенного ХЦК периодическим импульсом большого количества аминокислот помогает предотвратить образование сладжа. Эти методы лечения обычно не рекомендуются. [30] Предполагается, что такие осложнения являются основной причиной смертности у людей, которым требуется длительное полное парентеральное питание, например, при синдроме короткой кишки . [31] У новорожденных с синдромом короткой кишки, имеющих менее 10% от ожидаемой длины кишечника, которые, таким образом, зависят от полного парентерального питания, пятилетняя выживаемость составляет приблизительно 20%. [32]
Атрофия кишечника
Младенцы, находящиеся на постоянном питании без приема пищи через рот в течение длительного времени, подвержены риску развития атрофии кишечника. [33]
Гиперчувствительность
Гиперчувствительность — это редко описываемое, но значимое осложнение парентеральной нутритивной терапии. Впервые описанное в 1965 году, [34] предполагается, что частота этих реакций составляет около одного на 1,5 миллиона пациентов, которым предоставляется парентеральное питание. [35] Существует широкий диапазон того, как и когда проявляются эти реакции. Кожные проявления являются наиболее распространенным проявлением. Считается, что гиперчувствительность возникает к отдельным компонентам ППП, причем внутривенная липидная эмульсия является наиболее часто вовлеченным компонентом, за которым следуют поливитаминный раствор и раствор аминокислот . [35]
Лекарства
Пациентам, получающим внутривенное парентеральное питание, может также потребоваться внутривенное введение лекарств с использованием того же Y-сайта . Важно оценить совместимость лекарств с компонентами питания. Несовместимость может быть обнаружена физически через изменение цвета, разделение фаз или осаждение. [36]
Метаболические осложнения
Метаболические осложнения включают синдром повторного кормления, характеризующийся гипокалиемией , гипофосфатемией и гипомагниемией . Гипергликемия является распространенным явлением в начале терапии, но ее можно лечить путем добавления инсулина в раствор ППП. Гипогликемия, вероятно, возникнет при резком прекращении ППП. Дисфункция печени может быть ограничена обратимой холестатической желтухой и жировой инфильтрацией (демонстрируемой повышенными трансаминазами). Тяжелая печеночная дисфункция является редким осложнением. [37] В целом, у пациентов, получающих ППП, наблюдается более высокий уровень инфекционных осложнений. Это может быть связано с гипергликемией. [38]
Беременность
Беременность может вызвать серьезные осложнения при попытке правильной дозировки питательной смеси. Поскольку все питание плода поступает из кровотока матери, врач должен правильно рассчитать дозировку питательных веществ, чтобы удовлетворить потребности обоих реципиентов и иметь их в пригодной для использования форме. Неправильная дозировка может привести ко многим неблагоприятным, труднопредсказуемым эффектам, таким как смерть и различные степени деформации или другие проблемы развития . [39]
Рекомендуется начинать парентеральное питание после периода естественного питания, чтобы врачи могли правильно рассчитать потребности плода в питании . В противном случае его должна вводить только группа высококвалифицированных врачей, которые могут точно оценить потребности плода. [39]
Полное парентеральное питание

Растворы для полного парентерального питания могут быть адаптированы к индивидуальным потребностям пациента, или могут использоваться стандартизированные растворы. Использование стандартизированных растворов для парентерального питания является экономически эффективным и может обеспечить лучший контроль электролитов сыворотки. [40] В идеале каждый пациент оценивается индивидуально перед началом парентерального питания, и команда, состоящая из врачей-специалистов, медсестер, клинических фармацевтов и дипломированных диетологов , оценивает индивидуальные данные пациента и решает, какую формулу парентерального питания использовать и с какой скоростью инфузии.
Для получения энергии обычно используют внутривенные растворы сахара с декстрозой или глюкозой . Это не считается парентеральным питанием, поскольку не предотвращает недоедание при использовании само по себе. Стандартизированные растворы также могут различаться у разных разработчиков. Ниже приведены некоторые примеры их состава. Раствор для здоровых пациентов может вводиться как центрально, так и периферически.
| Вещество | Нормальный пациент | Высокий уровень стресса | Ограничение жидкости |
|---|---|---|---|
| Аминокислоты | 85 г | 128 г | 75 г |
| Декстроза | 250 г | 350 г | 250 г |
| Липиды | 100 г | 100 г | 50 г |
| На + | 150 мЭкв | 155 мг-экв | 80 мЭкв |
| К + | 80 мЭкв | 80 мЭкв | 40 мЭкв |
| Са 2+ | 360 мг | 360 мг | 180 мг |
| Мг2 + | 240 мг | 240 мг | 120 мг |
| Ацетат | 72 мг-экв | 226 мЭкв | 134 мг-экв |
| Кл − | 143 мг-экв | 145 мЭкв | 70 мЭкв |
| П | 310 мг | 465 мг | 233 мг |
| МВИ-12 | 10 мл | 10 мл | 10 мл |
| Микроэлементы | 5 мл | 5 мл | 5 мл |
Компоненты
Готовые решения
Приготовленные растворы обычно состоят из воды и электролитов; глюкоза , аминокислоты и липиды; основные витамины , минералы и микроэлементы добавляются или даются отдельно. Ранее липидные эмульсии давали отдельно, но все чаще вводят раствор «три в одном» из глюкозы, белков и липидов. [41] [42]
Добавлены компоненты
Отдельные питательные компоненты могут быть добавлены для более точной корректировки содержания в организме. Это индивидуальное питательное вещество может, если возможно, вводиться индивидуально или может быть введено в мешок с питательным раствором или внутривенными жидкостями ( раствор для увеличения объема ), который вводится пациенту.
Введение отдельных компонентов может быть более опасным, чем введение предварительно смешанных растворов, таких как те, которые используются при общем парентеральном питании, поскольку последние, как правило, уже сбалансированы в отношении, например, осмолярности и способности к периферической инфузии. Неправильное внутривенное введение концентрированного калия может быть смертельным, но это не представляет опасности, если калий смешан с раствором ППП и разбавлен. [43]
Витамины можно добавлять в предварительно смешанный питательный продукт непосредственно перед введением, поскольку дополнительные витамины могут способствовать порче хранящегося продукта. [ необходима цитата ] Витамины можно добавлять в двух дозах: одну жирорастворимую, другую водорастворимую.Существуют также препараты для однократного приема, содержащие как жиро-, так и водорастворимые витамины, такие как Церневит . [44] [45]
Минералы и микроэлементы для парентерального питания доступны в готовых смесях, таких как Аддавен . [46]
Однако эти дополнительные компоненты в парентеральном питании подвергались проверкам стабильности, поскольку они существенно влияют на стабильность липидных эмульсий, которые служат основой для этих формул. Исследования показали различия в физической и химической стабильности этих полных растворов парентерального питания, [47] [48] [49], что существенно влияет на фармацевтическое производство этих смесей.
Эмульгатор
Только ограниченное количество эмульгаторов обычно считается безопасным для использования при парентеральном введении, из которых наиболее важным является лецитин . [ медицинская цитата необходима ] Лецитин может быть биодеградирован и метаболизирован, поскольку он является неотъемлемой частью биологических мембран, что делает его практически нетоксичным. Другие эмульгаторы могут выводиться только через почки, [ необходима цитата ] создавая токсическую нагрузку. Эмульгатором выбора для большинства жировых эмульсий, используемых для парентерального питания, является высокоочищенный яичный лецитин [50] из-за его низкой токсичности и полной интеграции с клеточными мембранами.
Использование эмульгаторов, полученных из яиц, не рекомендуется для людей с аллергией на яйца из-за риска реакции. В ситуациях, когда нет подходящего эмульгирующего агента для человека с риском развития дефицита незаменимых жирных кислот, кулинарные масла могут быть нанесены на большие участки доступной кожи для дополнения путем трансдермальной абсорбции. [51]
Другой тип жировой эмульсии Omegaven экспериментально используется в США, в первую очередь в педиатрии. Он изготовлен из рыбьего жира вместо более широко используемых формул на основе соевого масла. Исследования показали, что использование Omegaven может обратить вспять и предотвратить заболевание печени и холестаз. [52]
История
Разработано в 1960-х годах доктором Стэнли Дадриком , который, будучи хирургом-ординатором в Университете Пенсильвании, работая в фундаментальной научной лаборатории доктора Джонатана Роадса, был первым, кто успешно кормил щенков бигля, а затем и новорожденных младенцев с катастрофическими злокачественными новообразованиями желудочно-кишечного тракта. [53] Дадрик сотрудничал с доктором Уиллмором и доктором Варсом, чтобы завершить работу, необходимую для того, чтобы сделать эту методику питания безопасной и успешной. [54]
В 2019 году в Великобритании возникла острая нехватка пакетов TPN из-за ограничений безопасности на единственной производственной площадке, которой управляет Calea. Национальная служба здравоохранения охарактеризовала ситуацию как чрезвычайную. [55]
Смотрите также
- Трубка для кормления
- линия Хикмана
- Интрадиализное парентеральное питание
- Внутривенная терапия
- Ничего через рот
- Интралипид
Ссылки
- ^ "BNFc доступен только в Великобритании". NICE . Архивировано из оригинала 2021-02-16 . Получено 2021-02-19 .
- ^ "Parenteral Manufacturing & Filling". Архивировано из оригинала 28 ноября 2023 г. Получено 11 февраля 2024 г.
- ^ "Коммерческие компаундеры". BSNA . Архивировано из оригинала 2021-03-03 . Получено 2021-02-19 .
- ^ "Парентеральное питание: что это такое, применение и типы". Клиника Кливленда . Архивировано из оригинала 2023-10-26 . Получено 2023-10-26 .
- ^ Payne-James, J. Jason; Khawaja, Hamid T. (сентябрь 1993 г.). «Обзор: Первый выбор для полного парентерального питания: периферический путь». Журнал парентерального и энтерального питания . 17 (5): 468– 478. doi :10.1177/0148607193017005468. PMID 8289417.
- ^ ab Kozier, B., & Erb, G., & Berman, AJ, & Burke, K., & Bouchal, SR, & Hirst, SP. (2004). Основы сестринского дела: Характер сестринской практики в Канаде. Канадское издание. Prentice Hall Health: Торонто.
- ^ "Заявление о медицинской позиции Американской гастроэнтерологической ассоциации: парентеральное питание". Архивировано из оригинала 2007-07-30 . Получено 2008-01-05 .
- ^ abc Van Gossum A, Cabre E, Hebuterne X, Jeppesen P, Krznaric Z, Messing B, Powell-Tuck J, Staun M, Nightingale J. Рекомендации ESPEN по парентеральному питанию: Гастроэнтерология. Клиническое питание. 2009; (28):415–427.
- ^ abcdef Руководство Merck, 2008
- ^ Heird WC, Gomez MR (июнь 1994). «Полное парентеральное питание при некротическом энтероколите». Clinics in Perinatology . 21 (2): 389– 409. doi :10.1016/S0095-5108(18)30352-X. PMID 8070233.
- ^ Sobotka L, Schneider SM, Berner YN, Cederholm T, Krznaric Z, Shenkin A, et al. (Август 2009). «Руководство ESPEN по парентеральному питанию: гериатрия». Clinical Nutrition . 28 (4): 461– 6. doi : 10.1016/j.clnu.2009.04.004 . PMID 19464772.
- ^ Sobotka L, Schneider SM, Berner YN, Cederholm T, Krznaric Z, Shenkin A, et al. (Август 2009). «Руководство ESPEN по парентеральному питанию: гериатрия». Clinical Nutrition . 28 (4): 461– 6. doi : 10.1016/j.clnu.2009.04.004 . PMID 19464772.
- ^ ab Arends J, Baracos V, Bertz H, Bozzetti F, Calder PC, Deutz NE и др. (октябрь 2017 г.). «Рекомендации группы экспертов ESPEN по борьбе с недоеданием, связанным с раком». Clinical Nutrition . 36 (5): 1187– 1196. doi : 10.1016/j.clnu.2017.06.017 . PMID 28689670. Архивировано из оригинала 2021-10-17 . Получено 2019-08-01 .
- ^ Sowerbutts AM, Lal S, Sremanakova J, Clamp A, Todd C, Jayson GC и др. (август 2018 г.). «Домашнее парентеральное питание для людей с неоперабельной злокачественной кишечной непроходимостью». База данных систематических обзоров Cochrane . 8 (8): CD012812. doi :10.1002/14651858.cd012812.pub2. PMC 6513201. PMID 30095168.
- ^ abc Yaworski JA. «Полное парентеральное питание (ППП) — часто задаваемые вопросы». Детская больница Питтсбурга. Архивировано из оригинала 20 ноября 2015 г. Получено 30 марта 2014 г.
- ^ "Жизнь с полным парентеральным питанием (ППП) дома". Больница Грейт-Ормонд-стрит . Архивировано из оригинала 7 апреля 2014 года . Получено 30 марта 2014 года .
- ^ Deshpande KS (июль 2003 г.). «Полное парентеральное питание и инфекции, связанные с использованием центральных венозных катетеров». American Journal of Critical Care . 12 (4): 326–7 , 380. doi : 10.4037/ajcc2003.12.4.326 . PMID 12882062.
- ^ Райан JA, Абель RM, Эбботт WM, Хопкинс CC, Чесни TM, Колли R, и др. (апрель 1974 г.). «Осложнения катетера при полном парентеральном питании. Проспективное исследование 200 последовательных пациентов». The New England Journal of Medicine . 290 (14): 757– 61. doi :10.1056/NEJM197404042901401. PMID 4205578.
- ^ Mollitt DL, Golladay ES (август 1983 г.). «Осложнения тромбоза нижней полой вены, вызванного катетером TPN, у детей младше одного года». Журнал детской хирургии . 18 (4): 462–7 . doi :10.1016/S0022-3468(83)80201-2. PMID 6413671.
- ^ Mailloux RJ, DeLegge MH, Kirby DF (ноябрь–декабрь 1993 г.). «Тромбоэмболия легочной артерии как осложнение длительного полного парентерального питания». Журнал парентерального и энтерального питания . 17 (6): 578–82 . doi :10.1177/0148607193017006578. PMID 8301814.
- ^ "Оценка OMEGAVEN 10%® (n-3 EFA Lipid Emulsion) при болезнях печени, связанных с домашним парентеральным питанием (MEGANORM)". ClinicalTrials.gov . Национальная медицинская библиотека США. 30 марта 2016 г. Архивировано из оригинала 27 мая 2013 г. Получено 15 марта 2023 г.
- ^ Piper SN, Schade I, Beschmann RB, Maleck WH, Boldt J, Röhm KD (декабрь 2009 г.). «Целостность гепатоцеллюлярной ткани после парентерального питания: сравнение липидной эмульсии, содержащей рыбий жир, с липидной эмульсией на основе оливкового и соевого масла». European Journal of Anaesthesiology . 26 (12): 1076– 82. doi : 10.1097/EJA.0b013e32832e08e0 . PMID 19916246. S2CID 22406883.
- ^ Garg, M. Jones, RM, Vaughan, RB, Testro, AG (2011). Трансплантация кишечника: Текущее состояние и будущие направления. Журнал гастроэнтерологии и гепатологии , 26, 1221–1228
- ^ Кумар Джейн А., Текман Дж. Х. (2014). «Недавно выявленные механизмы тотального парентерального питания, связанного с повреждением печени». Достижения в гепатологии . 2014 : 1–7 . doi : 10.1155/2014/621380 . ISSN 2356-6744.
- ^ Голод (мотивационное состояние)
- ^ "Непроходимость кишечника". Здоровье женщин. 9 мая 2013 г. Архивировано из оригинала 9 августа 2015 г. Получено 30 марта 2014 г.
- ^ Tucker RA, Jenkins HL (ноябрь 1984 г.). «Бессосудистый холецистит и лихорадка, связанные с полным парентеральным питанием». Drug Intelligence & Clinical Pharmacy . 18 (11): 897– 9. doi :10.1177/106002808401801110. PMID 6437783. S2CID 25507035.
- ^ Wang H, Khaoustov VI, Krishnan B, Cai W, Stoll B, Burrin DG, Yoffe B (октябрь 2006 г.). «Полное парентеральное питание вызывает стеатоз печени и апоптоз у новорожденных поросят». The Journal of Nutrition . 136 (10): 2547– 52. doi : 10.1093/jn/136.10.2547 . PMID 16988124. Архивировано из оригинала 27.01.2012 . Получено 25.03.2011 .
- ^ Quigley EM, Marsh MN, Shaffer JL, Markin RS (январь 1993). «Гепатобилиарные осложнения полного парентерального питания». Гастроэнтерология . 104 (1): 286–301 . doi : 10.1016/0016-5085(93)90864-9 . PMID 8419252.
- ^ "Gastroenterology Grand Rounds". Архивировано из оригинала 2006-09-10 . Получено 2011-12-18 .
- ^ Vanderhoof JA, Langnas AN (ноябрь 1997 г.). «Синдром короткой кишки у детей и взрослых». Гастроэнтерология . 113 (5): 1767–78 . doi : 10.1053/gast.1997.v113.pm9352883 . PMID 9352883.
- ^ Spencer AU, Neaga A, West B, Safran J, Brown P, Btaiche I и др. (сентябрь 2005 г.). «Синдром короткой кишки у детей: переосмысление предикторов успеха». Annals of Surgery . 242 (3): 403–9 , обсуждение 409–12. doi :10.1097/01.sla.0000179647.24046.03. PMC 1357748. PMID 16135926 . (среднее время наблюдения составило 5,1 года)
- ^ Стродтбек Ф. (июнь 2003 г.). «Патофизиология длительных периодов отсутствия энтерального питания или отсутствия питания через рот». Newborn & Infant Nursing Reviews . 3 (2): 47– 54. doi :10.1016/S1527-3369(03)00005-9. Архивировано из оригинала 18 марта 2014 г. Получено 4 января 2016 г.
- ^ Guimbretiere J, Nicolas F, Nicolas G, Guimbretiere L (апрель 1965 г.). «4 случая непереносимости липидных перфузий, наблюдавшихся с эмульсией хлопкового масла в присутствии соевого лецитина и Dl-альфа-токоферола». Cahiers d'Anesthésiologie . 13 : 355–70 . PMID 14343541.
- ^ ab Christian VJ, Tallar M, Walia CL, Sieracki R, Goday PS (ноябрь 2018 г.). «Систематический обзор гиперчувствительности к парентеральному питанию». Журнал парентерального и энтерального питания . 42 (8): 1222– 1229. doi :10.1002/jpen.1169. PMID 29761928. S2CID 46888724.
- ^ Bouchoud L, Fonzo-Christe C, Klingmüller M, Bonnabry P (2013). «Совместимость внутривенных лекарств с парентеральным питанием: оценка in vitro». Журнал парентерального и энтерального питания . 37 (3): 416–24 . doi :10.1177/0148607112464239. PMID 23112277. S2CID 25676758.
- ^ Г. Эдвард Морган-младший, Магед С. Михаил, Майкл Дж. МюррейКлиническая анестезиология, 4-е издание
- ^ McCowen KC, Friel C, Sternberg J, Chan S, Forse RA, Burke PA, Bistrian BR (ноябрь 2000 г.). «Гипокалориозное полное парентеральное питание: эффективность в профилактике гипергликемии и инфекционных осложнений — рандомизированное клиническое исследование». Critical Care Medicine . 28 (11): 3606– 11. doi :10.1097/00003246-200011000-00007. PMID 11098961. S2CID 1644195.
- ^ ab Landon MB, Gabbe SG, Mullen JL (март 1986). «Полное парентеральное питание во время беременности». Clinics in Perinatology . 13 (1): 57– 72. doi :10.1016/S0095-5108(18)30838-8. PMID 3082563.
- ^ ab Hayes EM, Cohen KR, Pinard BE, Lauletta J, Ruggiero R (2000). «Стандартизированные и индивидуально настроенные растворы для парентерального питания: сравнение значений электролитов в сыворотке» (PDF) . P&T . 25 (2): 78– 80, 83, 87. Архивировано из оригинала (PDF) 2011-07-15 . Получено 2010-09-17 .
- ^ Didier ME, Fischer S, Maki DG (1998). «Полные смеси питательных веществ кажутся более безопасными, чем липидная эмульсия в чистом виде в отношении микробного загрязнения: свойства роста микробных патогенов при комнатной температуре». Журнал парентерального и энтерального питания . 22 (5): 291– 6. doi :10.1177/0148607198022005291. PMID 9739032.
- ^ Роллинз CJ, Элсберри VA, Поллак KA, Поллак PF, Юдалл JN (1990). «Парентеральное питание три в одном: безопасный и экономичный метод нутритивной поддержки для младенцев». Журнал парентерального и энтерального питания . 14 (3): 290– 4. doi :10.1177/0148607190014003290. PMID 2112645.
- ^ Руководство по внутривенному введению калия (ВЗРОСЛЫМ). Архивировано 24.02.2011 на Wayback Machine из фармацевтического отдела RNSH. Авторизовано: Маргарет Дюгид. Последнее изменение: июнь 2006 г.
- ^ "Cernevit™-12 (поливитамины для инфузий)" (PDF) . Управление по контролю за продуктами и лекарствами . 1999. Архивировано (PDF) из оригинала 2017-02-25 . Получено 2015-10-19 .
- ^ "Cernevit" (PDF) . NPS MedicineWise . Октябрь 2014 г. Архивировано (PDF) из оригинала 2016-03-04 . Получено 2015-10-19 .
- ^ "Addaven Konzentrat zur Herstellung einer Infusionslösung" . Wissenschaftliche Verlagsgesellschaft Штутгарт. 26 октября 2015 г. Архивировано из оригинала 17 ноября 2015 г. Проверено 16 ноября 2015 г.
- ^ Staven, Vigdis; Wang, Siri; Grønlie, Ingrid; Tho, Ingunn (2020-01-01). «Физическая стабильность универсальной парентеральной питательной смеси для недоношенных детей при смешивании с микронутриентами и лекарствами». European Journal of Hospital Pharmacy . 27 (1): 36–42 . doi :10.1136/ejhpharm-2018-001562. ISSN 2047-9956. PMC 6992975. PMID 32064087 .
- ^ Перткевич, Марек; Косслетт, Аллан; Мюлебах, Стефан; Дудрик, Стэнли Дж. (2009-06-01). «Основы клинического питания: стабильность смесей для парентерального питания». e-SPEN, Европейский электронный журнал клинического питания и метаболизма . 4 (3): e117 – e119 . doi :10.1016/j.eclnm.2009.01.010. ISSN 1751-4991.
- ^ Стауни, М.; Олиярчик Р.; Ярошкевич, Э.; Елинска, А. (2013). «Фармацевтический взгляд на парентеральное питание». Научный мировой журнал . 2013 : 415310. doi : 10.1155/2013/415310 . ISSN 1537-744X. ПМЦ 3885274 . ПМИД 24453847.
- ^ "Лецитин – эмульгатор для парентерального применения: исследовательская группа TORVS". Архивировано из оригинала 2020-11-27 . Получено 2012-11-20 .
- ^ Skolnik, P.; Eaglstein, WH; Ziboh, VA (июль 1977 г.). «Дефицит незаменимых жирных кислот у человека: лечение местным применением линолевой кислоты». Архивы дерматологии . 113 (7): 939– 941. doi :10.1001/archderm.1977.01640070073010. ISSN 0003-987X. PMID 406855. Архивировано из оригинала 01.01.2021 . Получено 15.02.2021 .
- ^ Park KT, Nespor C, Kerner J (апрель 2011 г.). «Использование Омегавена при лечении заболеваний печени, связанных с парентеральным питанием». Журнал перинатологии . 31 (Приложение 1): S57-60. doi : 10.1038/jp.2010.182 . PMID 21448206.
- ^ Wilmore DW, Groff DB, Bishop HC, Dudrick SJ (апрель 1969). «Полное парентеральное питание у младенцев с катастрофическими желудочно-кишечными аномалиями». Журнал детской хирургии . 4 (2): 181– 9. doi :10.1016/0022-3468(69)90389-3. PMID 4976039.
- ^ Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE (июль 1968). «Длительное полное парентеральное питание с ростом, развитием и положительным азотистым балансом». Хирургия . 64 (1): 134–42 . PMID 4968812.
- ^ «Пациенты, которые не могут есть, «опасаются за жизнь». BBC News . 15 августа 2019 г. Архивировано из оригинала 16 августа 2019 г. Получено 16 августа 2019 г.
