Микобактерии
| Микобактерии | |
|---|---|
 | |
| Микрофотография M. tuberculosis, полученная с помощью просвечивающего электронного микроскопа | |
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Актиномицеты |
| Сорт: | Актиномицеты |
| Заказ: | Микобактерии |
| Семья: | Микобактерии |
| Род: | Микобактерия Леманна и Нойманна 1896 [1] |
| Разновидность | |
Более 190 видов, см. LPSN | |
| Синонимы [2] | |
| |
Mycobacterium — род , насчитывающий более 190 видов в типе Actinomycetota , выделенный в отдельное семейство Mycobacteriaceae . Этот род включает патогены, известные тем, что вызывают серьезные заболевания у млекопитающих, включая туберкулез ( M. tuberculosis ) и проказу ( M. leprae ) у людей. Греческий префикс myco- означает «грибок», намекая на плесневидные поверхности колоний этого рода. [3] Поскольку этот род имеет клеточные стенки с восковидным, богатым липидами внешним слоем, который содержит высокие концентрации миколовой кислоты, [4] кислотоустойчивое окрашивание используется для подчеркивания их устойчивости к кислотам по сравнению с другими типами клеток. [5]
Виды микобактерий, как правило, аэробны, неподвижны и способны расти при минимальном количестве питательных веществ. Род подразделяется на основе производства пигмента и скорости роста каждого вида. [6] Хотя большинство видов микобактерий непатогенны, характерная для рода сложная клеточная стенка способствует уклонению от защиты хозяина. [7]
Микробиология
Морфология

Микобактерии являются аэробными с 0,2-0,6 мкм шириной и 1,0-10 мкм длиной палочковидными формами . Они, как правило, неподвижны , за исключением вида Mycobacterium marinum , который, как было показано, подвижен внутри макрофагов . [8] Микобактерии обладают капсулами и большинство из них не образуют эндоспор . Было показано, что M. marinum и, возможно, M. bovis спорулируют ; [9] однако это было оспорено дальнейшими исследованиями. [10] Отличительной чертой всех видов Mycobacterium является толстая, гидрофобная и богатая миколовой кислотой клеточная стенка, состоящая из пептидогликана и арабиногалактана , причем эти уникальные компоненты предлагают мишени для новых противотуберкулезных препаратов. [11]
Физиология
Многие виды Mycobacterium легко растут с минимальным количеством питательных веществ, используя аммиак и/или аминокислоты в качестве источников азота и глицерин в качестве источника углерода в присутствии минеральных солей. Температуры для оптимального роста варьируются в зависимости от вида и условий среды, в пределах от 25 до 45 °C. [6]
Большинство видов Mycobacterium , включая большинство клинически значимых видов, можно культивировать на кровяном агаре . [12] Однако некоторые виды растут очень медленно из-за чрезвычайно длительных репродуктивных циклов, например, M. leprae, требующей 12 дней на цикл деления по сравнению с 20 минутами для некоторых штаммов E. coli . [13]
Экология
В то время как Mycobacterium tuberculosis и M. leprae являются патогенными, большинство микобактерий не вызывают заболевания, если только они не проникают в кожные поражения людей с легочной и/или иммунной дисфункцией, несмотря на то, что они широко распространены в водной и наземной среде. Благодаря образованию биопленки , устойчивости клеточной стенки к хлору и ассоциации с амебами микобактерии могут выживать в различных экологических стрессорах. Агаровая среда, используемая для большинства испытаний воды , не поддерживает рост микобактерий, что позволяет им оставаться незамеченными в муниципальных и больничных системах. [14]
Геномика
Сотни геномов микобактерий были полностью секвенированы. [15]
Размеры генома микобактерий варьируются от относительно небольших (например, у M. leprae ) до довольно крупных, таких как M. vulneris, кодирующих 6653 белка, что больше, чем ~6000 белков эукариотических дрожжей . [16]
| Организм | Количество генов, кодирующих белки |
|---|---|
| М. интрацеллюлярная | 5,289 [17] |
| М. колумбийский | 5,084 [18] |
| М. лепра | 1,603 [19] |
| М. туберкулез | 3,995 [19] |
| М. смегматис | 6,602 [20] |
| М. chelonae | 4,948 [21] |
Патогенность
Микобактерии туберкулезасложный
Mycobacterium tuberculosis может оставаться латентной в организме человека в течение десятилетий после первичного инфицирования, что позволяет ей продолжать заражать других. Было подсчитано, что треть населения мира имеет латентный туберкулез (ТБ). [22] M. tuberculosis имеет много факторов вирулентности , которые можно разделить на метаболизм липидов и жирных кислот, белки клеточной оболочки, ингибиторы макрофагов ,белки киназы , протеазы , белки-переносчики металлов и регуляторы экспрессии генов. [23] Несколько линий, таких как M. t. var. bovis (бычий туберкулез), считались отдельными видами в комплексе M. tuberculosis , пока они не были окончательно объединены в основной вид в 2018 году. [24]
Проказа
Развитие проказы вызвано заражением Mycobacterium leprae или Mycobacterium lepromatosis , двумя близкородственными бактериями. Ежегодно регистрируется около 200 000 новых случаев заражения, и 80% новых случаев регистрируются в Бразилии, Индии и Индонезии. [25] Инфекция M. leprae локализуется в макрофагах кожи и шванновских клетках, обнаруженных в периферической нервной ткани.
НетуберкулезныйМикобактерии
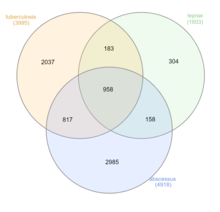
Нетуберкулезные микобактерии (НТМ), которые исключают M. tuberculosis , M. leprae и M. lepromatosis, могут инфицировать млекопитающих. Эти бактерии называются «атипичными микобактериями». Хотя передача от человека к человеку встречается редко, передача M. abscessus наблюдалась между пациентами с муковисцидозом . [26] Четыре основных заболевания, наблюдаемых у людей, — это хроническое заболевание легких, диссеминированное заболевание у пациентов с ослабленным иммунитетом, инфекции кожи и мягких тканей и поверхностный лимфаденит. 80–90% зарегистрированных инфекций НТМ проявляются как заболевания легких. [27]
M. abscessus является наиболее вирулентной быстрорастущей микобактерией (RGM), а также основной причиной легочных инфекций, вызванных RGM. Хотя традиционно ее рассматривали как условно-патогенный микроорганизм, как и другие НТМ, анализ различных факторов вирулентности (VF) изменил эту точку зрения на точку зрения как на истинного патогена. Это связано с наличием известных микобактериальных VF и других немикобактериальных VF, обнаруженных у других прокариотических патогенов. [27]
Факторы вирулентности
Микобактерии имеют клеточные стенки с пептидогликаном , арабиногалактаном и миколовой кислотой ; восковую внешнюю микомембрану из миколовой кислоты; и внешнюю капсулу из глюканов и секретируемых белков для вирулентности. Они постоянно ремоделируют эти слои, чтобы выживать в стрессовых условиях и избегать иммунной защиты хозяина. Эта структура клеточной стенки приводит к тому, что поверхности колоний напоминают грибы, что приводит к использованию в названии рода греческого префикса мико- . [28] Эта уникальная структура делает пенициллины неэффективными, вместо этого требуя лечения несколькими антибиотиками изониазидом для ингибирования синтеза миколовой кислоты, рифампицином для вмешательства в транскрипцию, этамбутолом для препятствования синтезу арабиногалактана и пиразинамидом для препятствования синтезу кофермента А. [7]
| Организм | Распространенные симптомы инфекции | Известные методы лечения | Зарегистрированные случаи (регион, год) |
|---|---|---|---|
| М. туберкулез | Усталость, потеря веса, лихорадка, кровохарканье, боль в груди. [29] | изониазид INH, рифампицин, пиразинамид, этамбутол. [30] | 1,6 миллиона (в мире, 2021 г.) [31] |
| М. лепра М. лепроматоз | Изменение цвета кожи, образование узелков, сухость кожи, выпадение бровей и/или ресниц, онемение, носовые кровотечения, паралич, слепота, невралгия. [32] | дапсон, рифампицин, клофазимин. [32] | 133 802 (В мире, 2021) [33] |
| M. avium комплекс | Нежная кожа, образование фурункулов или гнойных пузырьков, лихорадка, озноб, мышечные боли. [34] | кларитромицин, азитромицин, амикацин, цефокситин, имипенем. [35] | 3000 (США, ежегодная оценка ) [36] |
| М. абсцессный комплекс | Кашель, кровохарканье, лихорадка, полостные поражения. [37] | кларитромицин, амикацин, цефокситин, имипенем. [37] | Неизвестный |
История
| Кладограмма ключевых видов |
Микобактерии исторически классифицировались с помощью фенотипического тестирования , например, классификации Раньона по анализу скорости роста и продукции желтых/оранжевых каротиноидных пигментов. Группа I содержит фотохромогены (выработка пигмента, вызванная светом), группа II включает скотохромогены (конститутивная выработка пигмента), а нехромогены групп III и IV имеют бледно-желтый/коричневый пигмент, независимо от воздействия света. Виды группы IV являются «быстрорастущими» микобактериями по сравнению с «медленнорастущими» видами группы III, поскольку образцы вырастают в видимые колонии менее чем за семь дней. [6]
Поскольку Международный кодекс номенклатуры прокариот (ICNP) в настоящее время признает 195 видов Mycobacterium , системы классификации и идентификации теперь полагаются на секвенирование ДНК и вычислительную филогенетику . Основными болезнетворными группами являются комплекс M. tuberculosis ( туберкулез ), комплекс M. avium ( инфекция mycobacterium avium-intracellulare ), M. leprae и M. lepromatosis ( проказа ), а также M. abscessus ( хроническая легочная инфекция ). [3]
Микробиолог Энрико Тортоли построил филогенетическое дерево ключевых видов рода на основе более раннего генетического секвенирования Рогалла и др. (1990), а также новые филогенетические деревья, основанные на секвенировании Тортоли 148 видов Mycobacterium в 2017 году : [38]
- Филогенетическое древо медленнорастущих представителей рода Mycobacterium
- Филогенетическое дерево быстрорастущих представителей рода Mycobacterium , наряду с комплексом M. terrae. [39]
Предлагаемое разделение рода
Гупта и др. предложили разделить Mycobacterium на пять родов, основываясь на анализе 150 видов этого рода. Из-за разногласий по поводу усложнения клинической диагностики и лечения все переименованные виды сохранили свою первоначальную идентичность в роде Mycobacterium как действительный таксономический синоним: [40] [41]
- Микобактерии на основе медленно растущей клады Tuberculosis-Simiae
- Mycobacteroides на основе быстрорастущей клады Abscessus-Chelonae
- Mycolicibacillus на основе медленно растущей клады Triviale
- Mycolicibacter на основе клады медленно растущих Terrae
- Миколицибактерии на основе быстрорастущей клады Fortuitum-Vaccae.
Диагноз
Два наиболее распространенных метода визуализации этих кислотоустойчивых бацилл в ярко-красном цвете на синем фоне — это окраска по Цилю-Нильсену и модифицированная окраска по Киньюну . Окраска по Файту используется для окрашивания клеток M. leprae в розовый цвет на синем фоне. Быстрое модифицированное флуоресцентное окрашивание аурамином O имеет специфическое связывание с медленно растущими микобактериями для желтого окрашивания на темном фоне. Более новые методы включают окрашивание Гомори-метенаминовым серебром и окрашивание пероидовой кислотой Шиффа для окрашивания клеток комплекса Mycobacterium avium (MAC) в черный и розовый цвет соответственно. [5]
В то время как некоторым микобактериям может потребоваться до восьми недель, чтобы вырастить видимые колонии из культивируемого образца, большинство клинически значимых видов вырастут в течение первых четырех недель, что позволяет врачам рассматривать альтернативные причины, если отрицательные показания сохраняются после первого месяца. [42] Питательные среды включают среду Левенштейна–Йенсена и пробирку-индикатор роста микобактерий (MGIT).
- Микобактерии туберкулеза при окраске по Цилю-Нильсену
- Наклонные трубки со средой Левенштейна-Йенсена. [примечание 1]
- Образцы MGIT, излучающие флуоресценцию в ультрафиолетовом свете
Микобактериофаги
Микобактерии могут быть инфицированы микобактериофагами , классом вирусов с высокой специфичностью к своим целям. Захватывая клеточный аппарат микобактерий для производства дополнительных фагов, такие вирусы могут использоваться в фаговой терапии для эукариотических хозяев, поскольку они умрут вместе с микобактериями. Поскольку только некоторые микобактериофаги способны проникать через мембрану M. tuberculosis , вирусная ДНК может быть доставлена через искусственные липосомы , поскольку бактерии поглощают, транскрибируют и транслируют чужеродную ДНК в белки. [43]
Микозиды
Микозиды — это гликолипиды, выделенные из видов Mycobacterium , при этом микозид А обнаружен в фотохромогенных штаммах, микозид В — в бычьих штаммах, а микозид С — в птичьих штаммах. [44] Различные формы микозида С с разной степенью успешности используются в качестве рецептора для инактивации микобактериофагов . [45] Замена гена, кодирующего синтазу микоцерозовой кислоты в M. bovis, предотвращает образование микозидов. [46]
Примечания
- ^ Слева направо на изображении скошенных пробирок со средой Левенштейна-Йенсена:
- Отрицательный контроль
- M. tuberculosis : сухие на вид колонии
- Mycobacterium avium complex : влажные на вид колонии
- M. gordonae : желтоватые колонии
Ссылки
- ^ Леманн КБ, Нейман Р (1896). Atlas und Grundriss der Bakteriologie und Lehrbuch der speziellen bakteriologischen Diagnostik [ Атлас и очерк бактериологии и учебник специальной бактериологической диагностики ] (1-е изд.). Мюнхен: Дж. Ф. Леманн.
- ^ Euzéby JP, Parte AC. "Mycobacterium". Список названий прокариот, имеющих место в номенклатуре (LPSN) . Получено 16 июня 2021 г.[ постоянная мертвая ссылка ]
- ^ ab Mycobacteria: Health Advisory (PDF) . Агентство по охране окружающей среды (отчет). Август 1999 г.
- ^ Batt SM, Minnikin DE, Besra GS (май 2020 г.). «Толстая восковая оболочка микобактерий, защитный слой от антибиотиков и иммунной системы хозяина». The Biochemical Journal . 477 (10): 1983–2006. doi :10.1042/BCJ20200194. PMC 7261415. PMID 32470138 .
- ^ ab Pennington KM, Vu A, Challener D, Rivera CG, Shweta FN, Zeuli JD, Temesgen Z (август 2021 г.). «Подход к диагностике и лечению нетуберкулезных микобактериальных заболеваний». Журнал клинического туберкулеза и других микобактериальных заболеваний . 24 : 100244. doi : 10.1016/j.jctube.2021.100244. PMC 8135042. PMID 34036184 .
- ^ abc Forbes BA, Hall GS, Miller MB, Novak SM, Rowlinson MC, Salfinger M и др. (апрель 2018 г.). «Практическое руководство для лабораторий клинической микробиологии: микобактерии». Clinical Microbiology Reviews . 31 (2): e00038–17. doi :10.1128/CMR.00038-17. PMC 5967691 . PMID 29386234.
- ^ ab Dulberger CL, Rubin EJ, Boutte CC (январь 2020 г.). «Оболочка микобактериальной клетки — движущаяся цель». Nature Reviews. Microbiology . 18 (1): 47–59. doi :10.1038/s41579-019-0273-7. PMID 31728063. S2CID 208020338.
- ^ Stamm LM, Morisaki JH, Gao LY, Jeng RL, McDonald KL, Roth R и др. (ноябрь 2003 г.). «Mycobacterium marinum покидает фагосомы и двигается с помощью актин-ориентированной подвижности». Журнал экспериментальной медицины . 198 (9): 1361–1368. doi :10.1084/jem.20031072. PMC 2194249. PMID 14597736 .
- ^ Ghosh J, Larsson P, Singh B, Pettersson BM, Islam NM, Sarkar SN и др. (июнь 2009 г.). «Споруляция у микобактерий». Труды Национальной академии наук Соединенных Штатов Америки . 106 (26): 10781–10786. Bibcode : 2009PNAS..10610781G. doi : 10.1073/pnas.0904104106 . PMC 2705590. PMID 19541637 .
- ^ Traag BA, Driks A, Stragier P, Bitter W, Broussard G, Hatfull G и др. (январь 2010 г.). «Продуцируют ли микобактерии эндоспоры?». Труды Национальной академии наук Соединенных Штатов Америки . 107 (2): 878–881. Bibcode : 2010PNAS..107..878T. doi : 10.1073/pnas.0911299107 . PMC 2818926. PMID 20080769 .
- ^ Bhamidi S (2009). "Mycobacterial Cell Wall Arabinogalactan". Бактериальные полисахариды: современные инновации и будущие тенденции . Caister Academic Press. ISBN 978-1-904455-45-5.
- ^ Lagier JC, Edouard S, Pagnier I, Mediannikov O, Drancourt M, Raoult D (январь 2015 г.). «Текущие и прошлые стратегии бактериального культивирования в клинической микробиологии». Clinical Microbiology Reviews . 28 (1): 208–236. doi :10.1128/CMR.00110-14. PMC 4284306. PMID 25567228 .
- ^ Shepard CC, Mcrae DH (февраль 1965). «Mycobacterium leprae у мышей: минимальная инфекционная доза, связь между качеством окрашивания и инфекционностью и эффектом кортизона». Journal of Bacteriology . 89 (2): 365–372. doi :10.1128/jb.89.2.365-372.1965. PMC 305516 . PMID 14255702.
- ^ Vaerewijck MJ, Huys G, Palomino JC, Swings J, Portaels F (ноябрь 2005 г.). «Микобактерии в системах распределения питьевой воды: экология и значение для здоровья человека». FEMS Microbiology Reviews . 29 (5): 911–934. doi : 10.1016/j.femsre.2005.02.001 . PMID 16219512.
- ^ "JGI GOLD | Проекты". gold.jgi.doe.gov . Получено 2023-05-13 .
- ^ Croce O, Robert C, Raoult D, Drancourt M (май 2014 г.). "Проект последовательности генома Mycobacterium vulneris DSM 45247T". Genome Announcements . 2 (3). doi :10.1128/genomeA.00370-14. PMC 4014686. PMID 24812218 .
- ^ "UniProt". www.uniprot.org . Получено 2023-05-07 .
- ^ "UniProt". www.uniprot.org . Получено 2023-05-07 .
- ^ ab "UniProt". www.uniprot.org . Получено 2023-05-07 .
- ^ "UniProt". www.uniprot.org . Получено 2023-05-07 .
- ^ "UniProt". www.uniprot.org . Получено 2023-05-07 .
- ^ Гетахун Х, Маттеелли А, Чессон Р.Э., Равильоне М (май 2015 г.). «Латентная микобактериальная инфекция туберкулеза». Медицинский журнал Новой Англии . 372 (22): 2127–2135. дои : 10.1056/NEJMra1405427. ПМИД 26017823.
- ^ Форреллад М.А., Клепп Л.И., Джоффре А., Сабио и Гарсия Дж., Морбидони Х.Р., де ла Пас Сантанджело М. и др. (январь 2013 г.). «Факторы вирулентности комплекса микобактерий туберкулеза». Вирулентность . 4 (1): 3–66. дои : 10.4161/viru.22329. ПМЦ 3544749 . ПМИД 23076359.
- ^ Риохас, Марко А.; Макгоф, Катя Дж.; Райдер-Риохас, Кристин Дж.; Растоги, Налин; Хасбон, Манзур Эрнандо (1 января 2018 г.). «Филогеномный анализ видов комплекса Mycobacterium tuberculosis показывает, что Mycobacterium africanum, Mycobacterium bovis, Mycobacterium caprae, Mycobacterium microti и Mycobacterium pinnipedii являются более поздними гетеротипическими синонимами Mycobacterium tuberculosis». Международный журнал систематической и эволюционной микробиологии . 68 (1): 324–332. doi : 10.1099/ijsem.0.002507 . PMID 29205127.
- ^ Сугавара-Миками М, Танигава К, Кавасима А, Кирия М, Накамура Ю, Фудзивара Ю, Сузуки К (декабрь 2022 г.). «Патогенность и вирулентность Mycobacterium leprae». Вирулентность . 13 (1): 1985–2011. дои : 10.1080/21505594.2022.2141987. ПМЦ 9635560 . ПМИД 36326715.
- ^ "Инфекции, вызванные нетуберкулезными микобактериями (НТМ) | HAI | CDC". www.cdc.gov . 2019-08-12 . Получено 2023-04-28 .
- ^ ab To K, Cao R, Yegiazaryan A, Owens J, Venketaraman V (август 2020 г.). «Общий обзор условно-патогенных нетуберкулезных микобактерий: Mycobacterium avium и Mycobacterium abscessus». Журнал клинической медицины . 9 (8): 2541. doi : 10.3390/jcm9082541 . PMC 7463534. PMID 32781595 .
- ^ "Mycobacteria: Health Advisory EPA-822-B-01-007" (PDF) . epa.gov . Агентство по охране окружающей среды США (EPA). Август 1999 г. стр. 2 . Получено 10 марта 2023 г. .
- ^ "Информационные бюллетени | Общие сведения | Туберкулез: Общая информация | ТБ | CDC". www.cdc.gov . 2022-08-17 . Получено 2023-04-25 .
- ^ "Диагностика и лечение туберкулеза". Американская ассоциация легких . Получено 25.04.2023 .
- ^ "Глобальный отчет о туберкулезе 2022". www.who.int . Получено 2023-05-07 .
- ^ ab "Признаки и симптомы | Болезнь Хансена (проказа) | CDC". www.cdc.gov . 2018-10-22 . Получено 2023-04-25 .
- ^ "Глобальное обновление проказы (болезнь Хансена), 2021: движение к прерыванию передачи". www.who.int . Получено 2023-05-07 .
- ^ "Mycobacterium abscessus в медицинских учреждениях | HAI | CDC". www.cdc.gov . 2021-11-15 . Получено 2023-04-27 .
- ^ Weng YW, Huang CK, Sy CL, Wu KS, Tsai HC, Lee SS (июнь 2020 г.). «Лечение комплексного заболевания легких, вызванного Mycobacterium abscessus». Журнал Медицинской ассоциации Формозы = Taiwan Yi Zhi . Консенсусное заявление о нетуберкулезном микобактериальном заболевании легких на Тайване. 119 (Suppl 1): S58–S66. doi : 10.1016/j.jfma.2020.05.028 . PMID 32527504. S2CID 219604813.
- ^ Scholar E (2007-01-01), Enna SJ, Bylund DB (ред.), «Инфекции Mycobacterium Avium-Intracellulare», xPharm: The Comprehensive Pharmacology Reference , Нью-Йорк: Elsevier, стр. 1–5, doi : 10.1016/b978-008055232-3.60891-8, ISBN 978-0-08-055232-3, получено 2023-05-07
- ^ ab Huang YC, Liu MF, Shen GH, Lin CF, Kao CC, Liu PY, Shi ZY (октябрь 2010 г.). «Клинический исход инфекции Mycobacterium abscessus и тестирование чувствительности к антимикробным препаратам». Журнал микробиологии, иммунологии и инфекций = Wei Mian Yu Gan Ran Za Zhi . 43 (5): 401–406. doi :10.1016/S1684-1182(10)60063-1. PMID 21075707.
- ^ Tortoli E (2019-01-10). "Глава 1 - Таксономия рода Mycobacterium". В Velayati AA, Farnia P (ред.). Нетуберкулезные микобактерии (НТМ) . Academic Press. стр. 1–10. doi :10.1016/B978-0-12-814692-7.00001-2. ISBN 978-0-12-814692-7. S2CID 92810288.
- ^ Tortoli E, Fedrizzi T, Meehan CJ, Trovato A, Grottola A, Giacobazzi E и др. (декабрь 2017 г.). «Новая филогения рода Mycobacterium: старое и новое». Инфекция, генетика и эволюция . 56 : 19–25. Bibcode : 2017InfGE..56...19T. doi : 10.1016/j.meegid.2017.10.013. PMID 29030295.
- ^ Gupta RS, Lo B, Son J (2018). «Филогеномика и сравнительные геномные исследования убедительно поддерживают разделение рода Mycobacterium на исправленный род Mycobacterium и четыре новых рода». Frontiers in Microbiology . 9 : 67. doi : 10.3389/fmicb.2018.00067 . PMC 5819568. PMID 29497402 .
- ^ Tortoli E, Brown-Elliott BA, Chalmers JD, Cirillo DM, Daley CL, Emler S, et al. (Июль 2019). «То же мясо, другая подливка: игнорируйте новые названия микобактерий». The European Respiratory Journal . 54 (1): 1900795. doi : 10.1183/13993003.00795-2019 . PMID 31296783.
- ^ Ogwang S, Mubiri P, Bark CM, Joloba ML, Boom WH, Johnson JL (октябрь 2015 г.). «Время инкубации культур мокроты Mycobacterium tuberculosis complex в BACTEC MGIT 960: 4 недели отрицательной культуры достаточно для врачей, чтобы рассмотреть альтернативные диагнозы». Диагностическая микробиология и инфекционные заболевания . 83 (2): 162–164. doi :10.1016/j.diagmicrobio.2015.07.002. PMC 4573350. PMID 26239846 .
- ^ Azimi T, Mosadegh M, Nasiri MJ, Sabour S, Karimaei S, Nasser A (17.09.2019). «Фаговая терапия как обновленный терапевтический подход к микобактериальным инфекциям: всесторонний обзор». Infection and Drug Resistance . 12 : 2943–2959. doi : 10.2147/IDR.S218638 . PMC 6756577. PMID 31571947 .
- ^ Смит Д. В., Рэндалл Х. М., Макленнан А. П., Ледерер Э. (июнь 1960 г.). «Микозиды: новый класс типоспецифических гликолипидов микобактерий». Nature . 186 (4728): 887–888. Bibcode :1960Natur.186..887S. doi :10.1038/186887a0. PMID 13831939. S2CID 4149360.
- ^ Goren MB, McClatchy JK, Martens B, Brokl O (июнь 1972 г.). «Микозиды C: поведение как вещество рецепторного участка для микобактериофага D4». Журнал вирусологии . 9 (6): 999–1003. doi :10.1128/jvi.9.6.999-1003.1972. PMC 356406. PMID 4113889 .
- ^ Azad AK, Sirakova TD, Rogers LM, Kolattukudy PE (май 1996). «Целевая замена гена синтазы микоцерозовой кислоты в Mycobacterium bovis BCG приводит к появлению мутанта, в котором отсутствуют микозиды». Труды Национальной академии наук Соединенных Штатов Америки . 93 (10): 4787–4792. Bibcode : 1996PNAS...93.4787A. doi : 10.1073/pnas.93.10.4787 . PMC 39357. PMID 8643481 .
Внешние ссылки
- Центр ресурсов по бактериальной и вирусной биоинформатике: геномы, белки, эпитопы и пути микобактерий
- Справочник Merck - Микобактерии
- Mycobrowser: Геномная и протеомная база данных патогенных микобактерий
- CDC - Инфекции, вызванные нетуберкулезными микобактериями (НТМ)
- ПРАЗИТ: Идентификация микобактерий
- Консорциум структурной геномики туберкулеза

![Филогенетическое дерево быстрорастущих представителей рода Mycobacterium, наряду с комплексом M. terrae.[39]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b5/Phylogentic_Tree_of_Rapidly-Growing_Mycobacterium_Tortoli_2017.png/291px-Phylogentic_Tree_of_Rapidly-Growing_Mycobacterium_Tortoli_2017.png)

![Наклонные трубки среды Левенштейна-Йенсена. [примечание 1]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4a/Slant_tubes_of_Löwenstein-Jensen_medium_with_control,_M_tuberculosis,_M_avium_and_M_gordonae.jpg/440px-Slant_tubes_of_Löwenstein-Jensen_medium_with_control,_M_tuberculosis,_M_avium_and_M_gordonae.jpg)
_samples_in_ultraviolet_light.jpg/440px-Mycobacteria_Growth_Indicator_Tube_(MGIT)_samples_in_ultraviolet_light.jpg)