Гексафторид серы
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Гексафторид серы | |||
| Систематическое название ИЮПАК Гексафтор-λ 6 -сульфан [1] | |||
| Другие имена Элагас Эсафлон | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ЧЭБИ | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.018.050 | ||
| Номер ЕС |
| ||
| 2752 | |||
| КЕГГ | |||
| МеШ | Сера+гексафторид | ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
| Номер ООН | 1080 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| Характеристики | |||
| СФ 6 | |||
| Молярная масса | 146,05 г·моль −1 | ||
| Появление | Бесцветный газ. | ||
| Запах | без запаха [2] | ||
| Плотность | 6,17 г/л | ||
| Температура плавления | −64 °C; −83 °F; 209 К | ||
| Точка кипения | −50,8 °C (−59,4 °F; 222,3 К) | ||
| Критическая точка ( Т , Р ) | 45,51 ± 0,1 °С ,3,749 ± 0,01 МПа [3] | ||
| 0,003% (25 °С) [2] | |||
| Растворимость | слабо растворим в воде, хорошо растворим в этаноле, гексане, бензоле | ||
| Давление пара | 2,9 МПа (при 21,1 °С) | ||
| −44,0 × 10 −6 см 3 /моль | |||
| Теплопроводность |
| ||
| Вязкость | 15,23 мкПа·с [5] | ||
| Структура | |||
| Орторомбическая , oP28 | |||
| Ой | |||
| Ортогональный шестиугольный | |||
| Октаэдрический | |||
| 0 Д | |||
| Термохимия | |||
Теплоемкость ( С ) | 0,097 кДж/(моль·К) (постоянное давление) | ||
Стандартная молярная энтропия ( S ⦵ 298 ) | 292 Дж·моль −1 ·К −1 [6] | ||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −1209 кДж·моль −1 [6] | ||
| Фармакология | |||
| V08DA05 ( ВОЗ ) | |||
| Данные лицензии |
| ||
| Опасности | |||
| Маркировка СГС : [7] | |||
 | |||
| Предупреждение | |||
| H280 | |||
| П403 | |||
| NFPA 704 (огненный алмаз) | |||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (допустимый) | TWA 1000 частей на миллион (6000 мг/м 3 ) [2] | ||
РЕЛ (рекомендуется) | TWA 1000 частей на миллион (6000 мг/м 3 ) [2] | ||
IDLH (Непосредственная опасность) | НД [2] | ||
| Паспорт безопасности (SDS) | Внешний ПБС | ||
| Родственные соединения | |||
Сопутствующие фториды серы | Дисульфур декафторид | ||
Родственные соединения | Гексафторид селена | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Гексафторид серы или гексафторид серы ( британское написание ) — неорганическое соединение с формулой SF6 . Это бесцветный, не имеющий запаха, негорючий и нетоксичный газ. SF
6имеет октаэдрическую геометрию , состоящую из шести атомов фтора , присоединенных к центральному атому серы . Это гипервалентная молекула . [ необходима цитата ]
Типично для неполярного газа SF
6плохо растворяется в воде, но хорошо растворяется в неполярных органических растворителях. Плотность составляет 6,12 г/л на уровне моря, что значительно выше плотности воздуха (1,225 г/л). Обычно хранится и транспортируется в виде сжиженного сжатого газа . [8]
СФ
6имеет потенциал глобального потепления (ПГП) в 23 500 раз больше, чем CO 2 как парниковый газ (за 100-летний период), но существует в относительно небольших концентрациях в атмосфере. Его концентрация в тропосфере Земли достигла 11,50 частей на триллион (ppt) в октябре 2023 года, увеличившись на 0,37 ppt/год. [9] Рост с 1980 года в значительной степени обусловлен расширением электроэнергетического сектора, включая неконтролируемые выбросы из банков SF
6газ, содержащийся в его средне- и высоковольтных распределительных устройствах . Использование в производстве магния, алюминия и электроники также ускорило рост атмосферы. [10] Киотский протокол 1997 года , вступивший в силу в 2005 году, должен ограничить выбросы этого газа. Несколько туманным образом он был включен в схему торговли выбросами углерода . В некоторых странах это привело к выходу из строя целых отраслей промышленности. [11]
Синтез и реакции
Гексафторид серы на Земле существует в основном как синтетический промышленный газ, но также было обнаружено, что он встречается в природе. [12]
СФ
6может быть получен из элементов путем воздействия S
8к Ф
2. Этот метод использовали первооткрыватели Анри Муассан и Поль Лебо в 1901 году. Некоторые другие фториды серы также образуются, но их удаляют путем нагревания смеси для диспропорционирования любой S
2Ф
10(который очень токсичен), а затем очищают продукт с помощью NaOH , чтобы уничтожить оставшийся SF
4. [ требуется разъяснение ]
В качестве альтернативы, используя бром , гексафторид серы можно синтезировать из SF4 и CoF3 при более низких температурах (например, 100 °C), следующим образом: [13]
Для SF практически не существует химии реакции
6. Основной вклад в инертность SF 6 вносит стерическое препятствие атома серы, тогда как его более тяжелые аналоги группы 16, такие как SeF 6 , более реакционноспособны, чем SF 6 , из-за меньшего стерического препятствия. [14] Он не реагирует с расплавленным натрием ниже его точки кипения, [15] но реагирует экзотермически с литием . В результате своей инертности SF
6имеет продолжительность жизни в атмосфере около 3200 лет и не имеет значительных экологических стоков, кроме океана. [16]
Приложения
По оценкам , к 2000 году электроэнергетическая промышленность использовала около 80% производимого гексафторида серы, в основном в качестве газообразной диэлектрической среды . [17] Другие основные применения по состоянию на 2015 год включали травление кремния для производства полупроводников и инертный газ для литья магния . [18]
Диэлектрическая среда
СФ
6используется в электротехнической промышленности в качестве газообразной диэлектрической среды для высоковольтных выключателей на основе гексафторида серы , распределительных устройств и другого электрооборудования , часто заменяя масляные выключатели (OCB), которые могут содержать вредные полихлорированные бифенилы (ПХБ). SF
6Газ под давлением используется в качестве изолятора в распределительных устройствах с газовой изоляцией (GIS), поскольку он имеет гораздо более высокую диэлектрическую прочность, чем воздух или сухой азот . Высокая диэлектрическая прочность является результатом высокой электроотрицательности и плотности газа . Это свойство позволяет значительно уменьшить размер электрооборудования. Это делает GIS более подходящим для определенных целей, таких как размещение внутри помещений, в отличие от электрооборудования с воздушной изоляцией, которое занимает значительно больше места.
Газоизолированные электроприборы также более устойчивы к воздействию загрязнений и климата, а также более надежны в долгосрочной эксплуатации из-за контролируемой рабочей среды. Воздействие дуги химически разрушает SF
6хотя большинство продуктов разложения имеют тенденцию быстро повторно образовывать SF
6, процесс, называемый «самовосстановлением». [19] Дуга или коронный разряд могут производить дисульфур декафторид ( S
2Ф
10), высокотоксичный газ , по токсичности схожий с фосгеном . S
2Ф
10считался потенциальным боевым отравляющим веществом во время Второй мировой войны , поскольку не вызывает слезотечения или раздражения кожи, поэтому не обеспечивает предупреждения о воздействии.
СФ
6также часто встречается в качестве высоковольтного диэлектрика в источниках высокого напряжения ускорителей частиц , таких как генераторы Ван де Граафа и Пеллетроны , а также в высоковольтных просвечивающих электронных микроскопах .
Альтернативы SF
6в качестве диэлектрического газа включают несколько фторкетонов. [20] [21] Компактная технология GIS, которая сочетает вакуумное переключение с изоляцией из чистого воздуха, была введена для подмножества приложений до 420 кВ . [22]
Медицинское применение
СФ
6используется для тампонады или закупорки отверстия сетчатки при операциях по восстановлению отслойки сетчатки [23] в виде газового пузырька. Он инертен в стекловидной камере . [24] Пузырь изначально удваивает свой объем за 36 часов из-за попадания в него кислорода и азота, прежде чем впитаться в кровь в течение 10–14 дней. [25]
СФ
6используется в качестве контрастного вещества для ультразвуковой визуализации. Микропузырьки гексафторида серы вводятся в растворе путем инъекции в периферическую вену. Эти микропузырьки улучшают видимость кровеносных сосудов для ультразвука. Это применение использовалось для исследования васкуляризации опухолей. [26] Он остается видимым в крови в течение 3–8 минут и выдыхается легкими. [27]
Трассирующий состав
Гексафторид серы был индикаторным газом, который использовался в первой калибровке модели дисперсии воздуха на дорогах ; эта исследовательская программа спонсировалась Агентством по охране окружающей среды США и проводилась в Саннивейле, Калифорния, на шоссе 101 США . [28] Газообразный SF
6используется в качестве индикаторного газа в краткосрочных экспериментах по эффективности вентиляции в зданиях и внутренних помещениях, а также для определения скорости инфильтрации . Два основных фактора рекомендуют его использование: его концентрацию можно измерить с удовлетворительной точностью при очень низких концентрациях, а атмосфера Земли имеет незначительную концентрацию SF
6.
Гексафторид серы использовался в качестве нетоксичного испытательного газа в эксперименте на станции метро St John's Wood в Лондоне , Великобритания, 25 марта 2007 года. [29] Газ выпускался по всей станции и контролировался по мере его распространения. Целью эксперимента, о котором ранее в марте объявил государственный секретарь по транспорту Дуглас Александр , было исследование того, как токсичный газ может распространяться по станциям и зданиям лондонского метрополитена во время террористической атаки.
Гексафторид серы также обычно используется в качестве индикаторного газа при испытании на герметичность лабораторных вытяжных шкафов. Газ используется на заключительном этапе квалификации вытяжных шкафов ASHRAE 110. Внутри вытяжного шкафа образуется газовый шлейф, и проводится ряд испытаний, в то время как газоанализатор, установленный снаружи вытяжного шкафа, отбирает пробы SF6 для проверки герметичности вытяжного шкафа.
Он успешно использовался в качестве трассера в океанографии для изучения диапикнического смешивания и газообмена между воздухом и морем. [30]
Другие применения
- Магниевая промышленность использует SF
6как инертный «покровный газ» для предотвращения окисления во время литья , [31] и других процессов, включая плавку. [32] Когда-то он был крупнейшим потребителем, но его потребление значительно сократилось из-за его улавливания и переработки. [10] - В окнах с изолированным остеклением его использовали в качестве наполнителя для улучшения тепло- и звукоизоляционных характеристик. [33] [34]
- СФ
6 Плазма используется в полупроводниковой промышленности в качестве травителя в таких процессах, как глубокое реактивно-ионное травление . Небольшая часть SF
6распадается в плазме на серу и фтор, при этом ионы фтора вступают в химическую реакцию с кремнием. [35] - Заполненные им шины дольше сдуваются из-за диффузии через резину из-за большего размера молекул. [33]
- Nike также использовала его для получения патента и заполнения подушек во всех своих кроссовках под брендом «Air» с 1992 по 2006 год. [36] 277 тонн было использовано во время пика в 1997 году. [33]
- Двигательная установка замкнутого цикла Ренкина торпеды Mark 50 ВМС США работает на основе гексафторида серы, который вступает в экзотермическую реакцию с твердым литием . [37]
- Волноводы в мощных микроволновых системах герметизируются им. Газ электрически изолирует волновод, предотвращая внутреннюю дугу.
- Электростатические громкоговорители используют его из-за его высокой диэлектрической прочности и большого молекулярного веса. [38]
- Из него в качестве сырья производится химическое оружие — декафторид дисеры .
- В развлекательных целях, при дыхании, SF
6заставляет голос становиться значительно ниже, так как его плотность намного выше, чем у воздуха. Это явление связано с более известным эффектом вдыхания гелия низкой плотности , который заставляет голос человека становиться намного выше. Оба эти эффекта следует применять с осторожностью, поскольку эти газы вытесняют кислород , который легкие пытаются извлечь из воздуха. Гексафторид серы также является мягким анестетиком. [39] [40] - Для научных демонстраций/магии в качестве «невидимой воды», поскольку в резервуаре можно плавать как легкой фольгированной лодочке, так и наполненному воздухом воздушному шару.
- Он используется для эталонных и калибровочных измерений в экспериментах по ассоциативному и диссоциативному присоединению электронов (DEA) [41] [42]
Парниковый газ
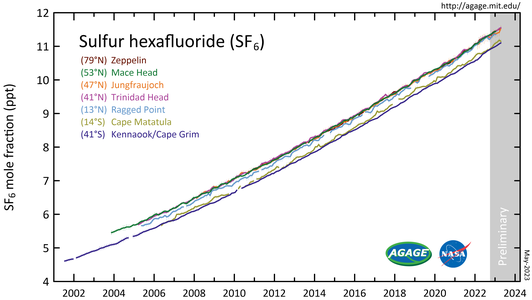
- Гексафторид серы (SF 6 ) измеряется в ходе Advanced Global Atmospheric Gases Experiment (AGAGE) в нижних слоях атмосферы ( тропосфере ) на станциях по всему миру. Содержание дано в виде среднемесячных молярных долей без загрязнения в частях на триллион .
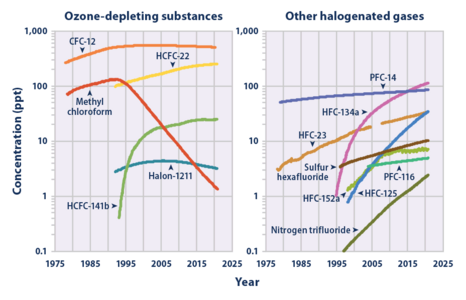
- Численность и темпы роста SF
6в тропосфере Земли (1978-2018). [10] - Концентрация SF6 в атмосфере по сравнению с аналогичными искусственными газами (правый график). Обратите внимание на логарифмическую шкалу.
По данным Межправительственной группы экспертов по изменению климата , Сан-Франциско
6является самым мощным парниковым газом . Его потенциал глобального потепления в 23 900 раз больше, чем у CO
2при сравнении за 100-летний период. [43] Гексафторид серы инертен в тропосфере и стратосфере и чрезвычайно долгоживущ, предполагаемое время жизни в атмосфере составляет 800–3200 лет. [44]
Измерения SF6 показывают , что его глобальное среднее соотношение смешивания увеличилось с устойчивой базы около 54 частей на квадриллион [12] до индустриализации до более чем 11,5 частей на триллион (ppt) по состоянию на октябрь 2023 года и увеличивается примерно на 0,4 ppt (3,5%) в год. [9] [45] Средние мировые концентрации SF6 увеличивались примерно на 7% в год в течение 1980-х и 1990-х годов, в основном в результате его использования в производстве магния , а также электроэнергетическими компаниями и производителями электроники. Учитывая небольшие количества выбрасываемого SF6 по сравнению с диоксидом углерода , его общий индивидуальный вклад в глобальное потепление оценивается менее чем в 0,2%, [46] однако коллективный вклад его и аналогичных искусственных галогенированных газов достиг примерно 10% по состоянию на 2020 год. [47] Альтернативы проходят испытания. [48] [49]
В Европе, СФ
6подпадает под действие директивы по фторсодержащим газам , которая запрещает или контролирует их использование в различных целях. [50] С 1 января 2006 года SF
6запрещен как индикаторный газ и во всех применениях, за исключением высоковольтных распределительных устройств . [51] В 2013 году сообщалось, что трехлетние усилия Министерства энергетики США по выявлению и устранению утечек в его лабораториях в Соединенных Штатах, таких как Принстонская лаборатория физики плазмы , где газ используется в качестве высоковольтного изолятора, были продуктивными, сократив ежегодные утечки на 1030 килограммов (2280 фунтов). Это было сделано путем сравнения закупок с запасами, предполагая, что разница была утечкой, а затем обнаружения и устранения утечек. [52]
Физиологические эффекты и меры предосторожности
Гексафторид серы — нетоксичный газ, но, вытесняя кислород из легких, он также несет риск асфиксии при вдыхании слишком большого количества. [53] Поскольку он плотнее воздуха, значительное количество газа при высвобождении осядет в низинных областях и будет представлять значительный риск асфиксии, если кто-то войдет в эту область. Это особенно актуально для его использования в качестве изолятора в электрооборудовании, поскольку рабочие могут находиться в траншеях или ямах под оборудованием, содержащим SF
6. [54]
Как и у всех газов, плотность SF
6влияет на резонансные частоты голосового тракта, тем самым радикально изменяя качество вокального звука, или тембр , тех, кто его вдыхает. Он не влияет на колебания голосовых связок. Плотность гексафторида серы относительно высока при комнатной температуре и давлении из-за большой молярной массы газа . В отличие от гелия , который имеет молярную массу около 4 г/моль и повышает голос, SF
6имеет молярную массу около 146 г/моль, а скорость звука через газ составляет около 134 м/с при комнатной температуре, что понижает голос. Для сравнения, молярная масса воздуха, который состоит примерно на 80% из азота и на 20% из кислорода, составляет около 30 г/моль, что приводит к скорости звука 343 м/с. [55]
Гексафторид серы обладает анестезирующей силой, немного меньшей, чем закись азота ; [56] он классифицируется как слабое анестезирующее средство. [57]
Смотрите также
- Гексафторид селена
- Гексафторид теллура
- Гексафторид урана
- Гипервалентная молекула
- Галогенуглерод — еще одна группа основных парниковых газов.
- Трифторметилсульфур пентафторид , похожий газ
Ссылки
- ^ "Sulfur Hexafluoride - PubChem Public Chemical Database". PubChem . Национальный центр биотехнологической информации . Архивировано из оригинала 3 ноября 2012 года . Получено 22 февраля 2013 года .
- ^ abcde Карманный справочник NIOSH по химическим опасностям. "#0576". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Хорстманн С., Фишер К., Гмелинг Дж. (2002). «Измерение и расчет критических точек для бинарных и тройных смесей». Журнал AIChE . 48 (10): 2350–2356. Bibcode : 2002AIChE..48.2350H. doi : 10.1002/aic.690481024. ISSN 0001-1541.
- ^ Assael MJ, Koini IA, Antoniadis KD, Huber ML, Abdulagatov IM, Perkins RA (2012). "Reference Correlation of the Thermal Conductivity of Sulfur Hexafluoride from the Triple Point to 1000 K and up to 150 MPa". Journal of Physical and Chemical Reference Data . 41 (2): 023104–023104–9. Bibcode :2012JPCRD..41b3104A. doi :10.1063/1.4708620. ISSN 0047-2689. S2CID 18916699.
- ^ Assael MJ, Kalyva AE, Monogenidou SA, Huber ML, Perkins RA, Friend DG, May EF (2018). «Эталонные значения и эталонные корреляции для теплопроводности и вязкости жидкостей». Журнал физических и химических справочных данных . 47 (2): 021501. Bibcode : 2018JPCRD..47b1501A. doi : 10.1063/1.5036625. ISSN 0047-2689. PMC 6463310. PMID 30996494 .
- ^ ab Zumdahl, Steven S. (2009). Химические принципы 6-е изд . Houghton Mifflin Company. стр. A23. ISBN 978-0-618-94690-7.
- ^ GHS: Запись о швефельгексафториде в базе данных веществ GESTIS Института безопасности и гигиены труда , доступ 13 декабря 2021 г.
- ^ Нимейер Л. (1998), Кристофору Л. Г., Олтофф Дж. К. (ред.), «Переработка SF6 в электроэнергетическом оборудовании», Газовые диэлектрики VIII , Бостон, Массачусетс: Springer US, стр. 431–442, doi : 10.1007/978-1-4615-4899-7_58, ISBN 978-1-4615-4899-7, получено 2024-08-08
- ^ ab "Тенденции в атмосферном гексафториде серы". Национальное управление океанических и атмосферных исследований США . Получено 28 декабря 2023 г.
- ^ abc Simmonds, PG, Rigby, M., Manning, AJ, Park, S., Stanley, KM, McCulloch, A., Henne, S., Graziosi, F., Maione, M. и 19 других (2020) «Растущая атмосферная нагрузка парникового газа гексафторида серы (SF 6 )». Atmos. Chem. Phys. , 20 : 7271–7290. doi :10.5194/acp-20-7271-2020.
 Материал скопирован из этого источника, который доступен по лицензии Creative Commons Attribution 4.0 International.
Материал скопирован из этого источника, который доступен по лицензии Creative Commons Attribution 4.0 International. - ^ Кребер Д., Дэвис Б., Кашани-Неджад С. (2011). «Производство металлического магния в Канаде». В Kapusta J., Mackey P., Stubina N. (ред.). Канадский металлургический и материалоемкий ландшафт 1960–2011 гг. Канадский институт металлургии.
- ^ ab Бузенберг, Э. и Пламмер, Н. (2000). «Датирование молодых грунтовых вод с помощью гексафторида серы: естественные и антропогенные источники гексафторида серы». Исследования водных ресурсов . 36 (10). Американский геофизический союз: 3011–3030. Bibcode : 2000WRR....36.3011B. doi : 10.1029/2000WR900151 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Winter RW, Pugh JR, Cook PW (9–14 января 2011 г.). SF 5 Cl, SF 4 и SF 6 : их производство с помощью брома и новый метод приготовления SF 5 Br . 20-я зимняя конференция по фтору .
- ^ Дювард Шрайвер, Питер Аткинс (2010). Неорганическая химия . WH Freeman. стр. 409. ISBN 978-1429252553.
- ^ Радж Г (2010). Продвинутая неорганическая химия: Том II (12-е изд.). Издательство GOEL. С. 160.Выдержка из страницы 160
- ^ Stöven T, Tanhua T, Hoppema M, Bullister JL (2015-09-18). «Перспективы применения нестационарных трассеров и предельные случаи». Ocean Science . 11 (5): 699–718. Bibcode :2015OcSci..11..699S. doi : 10.5194/os-11-699-2015 . ISSN 1812-0792.
- ^ Константин Т. Дервос, Панайота Вассилу (2000). «Гексафторид серы: глобальные экологические эффекты и образование токсичных побочных продуктов». Журнал Ассоциации по управлению воздухом и отходами . 50 (1). Тейлор и Фрэнсис: 137–141. Bibcode : 2000JAWMA..50..137D. doi : 10.1080/10473289.2000.10463996 . PMID 10680375. S2CID 8533705.
- ^ Дебора Оттингер, Молли Аверит, Дебора Харрис (2015). «Потребление и поставки гексафторида серы в США, представленные в рамках программы отчетности по парниковым газам». Журнал интегративных наук об окружающей среде . 12 (sup1). Тейлор и Фрэнсис: 5–16. doi : 10.1080/1943815X.2015.1092452 .
- ^ Якоб Ф., Перьяник Н., Гексафторид серы, уникальный диэлектрик (PDF) , Analytical ChemTech International, Inc., архивировано (PDF) из оригинала 2016-03-04
- ^ "Архивная копия" (PDF) . Архивировано (PDF) из оригинала 2017-10-12 . Получено 2017-10-12 .
{{cite web}}: CS1 maint: архивная копия как заголовок ( ссылка ) - ^ Kieffel Y, Biquez F (1 июня 2015 г.). «Альтернативная разработка SF 6 для высоковольтных распределительных устройств». Конференция IEEE по электроизоляции (EIC) 2015 г. стр. 379–383. doi :10.1109/ICACACT.2014.7223577. ISBN 978-1-4799-7352-1. S2CID 15911515 — через IEEE Xplore.
- ^ «Устойчивая технология коммутационных устройств для будущего с нулевым уровнем выбросов CO2». Siemens Energy. 2020-08-31 . Получено 2021-04-27 .
- ^ Daniel A. Brinton, CP Wilkinson (2009). Отслоение сетчатки: принципы и практика . Oxford University Press. стр. 183. ISBN 978-0199716210.
- ^ Голам А. Пейман, д-р медицины, Стивен А. Мефферт, д-р медицины, Мэнди Д. Конвей (2007). Витреоретинальные хирургические методы . Informa Healthcare. стр. 157. ISBN 978-1841846262.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Hilton GF, Das T, Majji AB, Jalali S (1996). «Пневматическая ретинопексия: принципы и практика». Indian Journal of Ophthalmology . 44 (3): 131–143. PMID 9018990.
- ^ Lassau N, Chami L, Benatsou B, Peronneau P, Roche A (декабрь 2007 г.). «Динамическая контрастная ультрасонография (DCE-US) с количественной оценкой перфузии опухоли: новый диагностический инструмент для оценки ранних эффектов антиангиогенного лечения». Eur Radiol . 17 (Suppl. 6): F89–F98. doi :10.1007/s10406-007-0233-6. PMID 18376462. S2CID 42111848.
- ^ "SonoVue, INN-гексафторид серы - Приложение I - Краткое описание характеристик продукта" (PDF) . Европейское агентство по лекарственным средствам . Получено 24.02.2019 .
- ↑ C Michael Hogan (10 сентября 2011 г.). «Источник линии загрязнения воздуха». Энциклопедия Земли. Архивировано из оригинала 29 мая 2013 г. Получено 22 февраля 2013 г.
- ^ "Испытание 'ядовитого газа' в метро". BBC News . 25 марта 2007 г. Архивировано из оригинала 15 февраля 2008 г. Получено 22 февраля 2013 г.
- ^ Fine RA (2010-12-15). «Наблюдения за CFC и SF6 как океаническими трассерами». Annual Review of Marine Science . 3 (1): 173–195. doi :10.1146/annurev.marine.010908.163933. ISSN 1941-1405. PMID 21329203.
- ^ Скотт К. Бартос (февраль 2002 г.). «Обновление о партнерстве EPA с маниевой промышленностью по защите климата» (PDF) . Агентство по охране окружающей среды США . Архивировано из оригинала (PDF) 10 октября 2012 г. . Получено 14 декабря 2013 г. .
- ^ Ayres J (2000). «Канадская перспектива управления SF6 в магниевой промышленности» (PDF) . Environment Canada.
- ^ abc J. Harnisch и W. Schwarz (2003-02-04). "Окончательный отчет о расходах и влиянии на выбросы потенциальной нормативной базы для сокращения выбросов гидрофторуглеродов, перфторуглеродов и гексафторида серы" (PDF) . Ecofys GmbH.
- ^ Хопкинс С. (2007). Звукоизоляция — Google Books. Elsevier / Butterworth-Heinemann. С. 504–506. ISBN 9780750665261.
- ^ Y. Tzeng, TH Lin (сентябрь 1987 г.). "Сухое травление кремниевых материалов в плазме на основе SF6" (PDF) . Журнал Электрохимического Общества. Архивировано из оригинала (PDF) 6 апреля 2012 г. . Получено 22 февраля 2013 г. .
- ↑ Стэнли Холмс (24 сентября 2006 г.). «Nike Goes For The Green». Журнал Bloomberg Business Week. Архивировано из оригинала 3 июня 2013 г. Получено 14 декабря 2013 г.
- ^ Хьюз, TG, Смит, RB, Кили, DH (1983). «Система движения с накопленной химической энергией для подводных применений». Журнал энергетики . 7 (2): 128–133. Bibcode : 1983JEner...7..128H. doi : 10.2514/3.62644.
- ^ Дик Олшер (26 октября 2009 г.). «Достижения в технологии громкоговорителей — перспектива на 50 лет». The Absolute Sound. Архивировано из оригинала 14 декабря 2013 г. Получено 14 декабря 2013 г.
- ^ Эдмонд И Эгер, доктор медицины и др. (10 сентября 1968 г.). «Анестезиологическая сила гексафторида серы, тетрафторида углерода, хлороформа и этана у собак: корреляция с гидратной и липидной теориями анестезиологического действия». Анестезиология: Журнал Американского общества анестезиологов . 30 (2). Анестезиология - Журнал Американского общества анестезиологов, Inc: 127–134.
- ^ WTOL (2015-01-27). Звучит как Дарт Вейдер с гексафторидом серы. YouTube . Станция воображения .
- ^ Braun M, Marienfeld S, Ruf MW, Hotop H (2009-05-26). "Высокоразрешающее присоединение электронов к молекулам CCl4 и SF6 в расширенных диапазонах энергий с помощью метода (EX)LPA". Journal of Physics B: Atomic, Molecular and Optical Physics . 42 (12): 125202. Bibcode : 2009JPhB...42l5202B. doi : 10.1088/0953-4075/42/12/125202. ISSN 0953-4075. S2CID 122242919.
- ^ Fenzlaff M, Gerhard R, Illenberger E (1988-01-01). "Ассоциативное и диссоциативное присоединение электронов SF6 и SF5Cl". Журнал химической физики . 88 (1): 149–155. Bibcode : 1988JChPh..88..149F. doi : 10.1063/1.454646. ISSN 0021-9606.
- ^ "2.10.2 Прямые потенциалы глобального потепления". Межправительственная группа экспертов по изменению климата . 2007. Архивировано из оригинала 2 марта 2013 года . Получено 22 февраля 2013 года .
- ^ AR Ravishankara, S. Solomon, AA Turnipseed, RF Warren, Solomon, Turnipseed, Warren (8 января 1993 г.). "Atmospheric Lifetimes of Long-Lived Halogenated Species". Science . 259 (5092): 194–199. Bibcode :1993Sci...259..194R. doi :10.1126/science.259.5092.194. PMID 17790983. S2CID 574937. Архивировано из оригинала 24 сентября 2015 г. Получено 22 февраля 2013 г.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ "Данные по гексафториду серы (SF6) из почасовых проб in situ, проанализированных на газовом хроматографе, расположенном на мысе Мататулу (SMO)". 7 июля 2020 г. Получено 8 августа 2020 г.
- ^ "SF6 Sulfur Hexafluoride". Блог PowerPlantCCS. 19 марта 2011 г. Архивировано из оригинала 30 декабря 2012 г. Получено 22 февраля 2013 г.
- ^ Батлер Дж. и Монцка С. (2020). «Ежегодный индекс парниковых газов NOAA (AGGI)». Лаборатория глобального мониторинга NOAA /Исследовательские лаборатории системы Земли.
- ^ "g3, решение без SF6 на практике | Think Grid". think-grid.org . 18 февраля 2019 г. Архивировано из оригинала 30 октября 2020 г. Получено 6 февраля 2020 г.
- ^ Мохамед Раби, Кристиан М. Франк (2018). «Оценка экологически чистых газов для электроизоляции для замены самого мощного промышленного парникового газа SF6». Environmental Science & Technology . 52 (2). Американское химическое общество: 369–380. Bibcode : 2018EnST...52..369R. doi : 10.1021/acs.est.7b03465. hdl : 20.500.11850/238519 . PMID 29236468.
- ^ Дэвид Никель (15.01.2020). «Гексафторид серы: правда и мифы об этом парниковом газе». phys.org . Получено 18.10.2020 .
- ^ "Климат: депутаты Европарламента придают законопроекту о фторсодержащих газах "зеленый импульс". www.euractiv.com . EurActiv.com . 13 октября 2005 г. Архивировано из оригинала 3 июня 2013 г. Получено 22 февраля 2013 г.
- ^ Майкл Уайнс (13 июня 2013 г.). «Крестовый поход Министерства энергетики против утечек мощного парникового газа приносит результаты». The New York Times . Архивировано из оригинала 14 июня 2013 г. Получено 14 июня 2013 г.
- ^ "Sulfur Hexafluoride". Hazardous Substances Data Bank . US National Library of Medicine. Архивировано из оригинала 9 мая 2018 года . Получено 26 марта 2013 года .
- ^ "Руководство по безопасному использованию SF6 в газе". UNIPEDE/ EURELECTRIC . Архивировано из оригинала 2013-10-04 . Получено 2013-09-30 .
- ^ "Физика в речи". Университет Нового Южного Уэльса. Архивировано из оригинала 21 февраля 2013 года . Получено 22 февраля 2013 года .
- ^ Адриани Дж (1962). Химия и физика анестезии (2-е изд.). Иллинойс: Thomas Books. стр. 319. ISBN 9780398000110.
- ^ Weaver RH, Virtue RW (1 ноября 1952 г.). «Слабые анестезирующие свойства гексафторида серы». Анестезиология . 13 (6): 605–607. doi : 10.1097/00000542-195211000-00006 . PMID 12986223. S2CID 32403288.
Дальнейшее чтение
- "Гексафторид серы". Air Liquide Gas Encyclopedia. Архивировано из оригинала 31 марта 2012 года . Получено 22 февраля 2013 года .
- Христофору, Лукас Г., Исидор Зауэрс , ред. (1991). Газообразные диэлектрики VI . Plenum Press. ISBN 978-0-306-43894-3.
- Холлеман А.Ф., Виберг Э. (2001). Неорганическая химия . Сан-Диего: Academic Press. ISBN 0-12-352651-5.
- Халифа М. (1990). Высоковольтная техника: теория и практика . Нью-Йорк: Марсель Деккер. ISBN 978-0-8247-8128-6. OCLC 20595838.
- Маллер В.Н., Найду М.С. (1981). Преимущества высоковольтной изоляции и прерывания дуги в элегазе и вакууме . Оксфорд; Нью-Йорк: Pergamon Press. ISBN 978-0-08-024726-7. OCLC 7866855.
- Партнерство по сокращению выбросов SF6 для электроэнергетических систем
- Мэтт Макграт (13 сентября 2019 г.). «Изменение климата: «грязный секрет» электротехнической промышленности усиливает потепление». BBC News . Получено 14 сентября 2019 г. .
Внешние ссылки
- Информационный бюллетень по фторидам и их соединениям — Национальный реестр загрязняющих веществ
- Газы с высоким ПГП и изменение климата с сайта Агентства по охране окружающей среды США
- Международная конференция по SF6 и окружающей среде (сопутствующий архив)
- CDC - Карманный справочник NIOSH по химическим опасностям






![Распространенность и скорость роста SF 6 в тропосфере Земли (1978-2018 гг.)[10].](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7b/AGAGE_sulfur_hexafluroride_growth.png/404px-AGAGE_sulfur_hexafluroride_growth.png)