Гексафторид урана
 | |
 | |
 | |
| Имена | |
|---|---|
| Имена ИЮПАК Гексафторид урана Фторид урана(VI) | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| Сокращения | шестигранник |
| ЧЭБИ | |
| ChemSpider | |
| Информационная карта ECHA | 100.029.116 |
| Номер ЕС |
|
| 2923 | |
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
| Номер ООН | 2978 (<1% 235 U ) 2977 (>1% 235 U ) |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| УФ 6 | |
| Молярная масса | 352,02 г/моль |
| Появление | Бесцветное твердое вещество |
| Плотность | 5,09 г/см 3 , твердый |
| Точка кипения | 56,5 °C (133,7 °F; 329,6 K) (возгоняется при атмосферном давлении) |
| Гидролизуется | |
| Растворимость |
|
| Структура | |
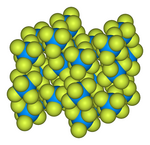
| Орторомбическая , oP28 | |
| ПНМА, № 62 | |
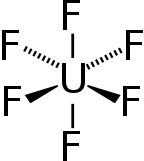
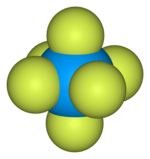
| Октаэдрический ( О h ) | |
| 0 | |
| Термохимия | |
Стандартная молярная энтропия ( S ⦵ 298 ) |
|
Стандартная энтальпия образования (Δ f H ⦵ 298 ) |
|
| Опасности | |
| Охрана труда и техника безопасности (OHS/OSH): | |
Основные опасности | Токсичный, едкий, радиоактивный [3] |
| Маркировка СГС : | |
   | |
| Опасность | |
| Н300 , Н330 , Н373 , Н411 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Паспорт безопасности (SDS) | МКХС 1250 |
| Родственные соединения | |
Другие анионы | Гексахлорид урана |
Другие катионы | |
Сопутствующие фториды урана | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гексафторид урана , иногда называемый гексом , представляет собой неорганическое соединение с формулой UF6 . Гексафторид урана представляет собой летучее , токсичное белое твёрдое вещество , которое используется в процессе обогащения урана , который производит топливо для ядерных реакторов и ядерного оружия . [4]
Подготовка
Диоксид урана преобразуется с помощью плавиковой кислоты (HF) в тетрафторид урана : [4]
- UO2 + 4HF → UF4 + 2H2O
В образцах, загрязненных триоксидом урана , оксифторид образуется на этапе HF:
- UO3 + HF → UF2O2 + H2O
Полученный UF4 затем окисляется фтором с образованием гексафторида :
- УФ 4 + Ф 2 → УФ 6
Характеристики
Физические свойства
При атмосферном давлении UF 6 возгоняется при температуре 56,5 °C. [5]

Структура твердого тела была определена методом нейтронной дифракции при 77 К и 293 К. [6] [7]
- Шаростержневая модель элементарной ячейки гексафторида урана [8]
- Длины связей и углы газообразного гексафторида урана [9]
Химические свойства
UF 6 реагирует с водой , выделяя плавиковую кислоту . Соединение реагирует с алюминием , образуя поверхностный слой AlF 3 , который препятствует любой дальнейшей реакции соединения.
Гексафторид урана является слабым окислителем . [10] Он является кислотой Льюиса , о чем свидетельствует его связывание с образованием гептафторураната (VI), [UF 7 ] − . [11]
Полимерные фториды урана (VI), содержащие органические катионы, были выделены и охарактеризованы методом рентгеновской дифракции. [12]
Применение в топливном цикле

Как одно из самых летучих соединений урана, гексафторид урана относительно удобен в обработке и используется в обоих основных методах обогащения урана , а именно в газовой диффузии и методе газового центрифуги . Поскольку тройная точка UF6 ; 64 ° C (147 °F; 337 K) и 152 кПа (22 фунта на квадратный дюйм; 1,5 атм); [13] близка к условиям окружающей среды, фазовые переходы могут быть достигнуты с небольшой термодинамической работой .
Фтор имеет только один устойчивый изотоп природного происхождения, поэтому изотопологи UF6 различаются по молекулярной массе исключительно в зависимости от присутствующего изотопа урана . [14] Это различие является основой физического разделения изотопов при обогащении .
Все остальные фториды урана — нелетучие твердые вещества, представляющие собой координационные полимеры .
Коэффициент пересчета для изотополога 238 U UF 6 («гекс») в «массу U» составляет 0,676. [15]
Газовая диффузия требует примерно в 60 раз больше энергии, чем процесс с использованием газовой центрифуги: ядерное топливо, произведенное с использованием газовой диффузии, производит в 25 раз больше энергии, чем используется в процессе диффузии, в то время как топливо, произведенное с использованием центрифуги, производит в 1500 раз больше энергии, чем используется в процессе с использованием центрифуги.
Помимо использования в обогащении, гексафторид урана использовался в передовом методе переработки ( летучесть фторида ), который был разработан в Чешской Республике . В этом процессе отработанное ядерное топливо обрабатывается газообразным фтором для преобразования оксидов или элементарных металлов в смесь фторидов. Затем эта смесь перегоняется для разделения различных классов материалов. Некоторые продукты деления образуют нелетучие фториды, которые остаются в виде твердых веществ и затем могут быть либо подготовлены для хранения в качестве ядерных отходов, либо подвергнуты дальнейшей переработке либо методами, основанными на сольватации , либо электрохимически .
Обогащение урана производит большие количества обедненного гексафторида урана (D UF 6 или D- UF 6 ) в качестве отходов. Длительное хранение D- UF 6 представляет риски для окружающей среды, здоровья и безопасности из-за его химической нестабильности. Когда UF 6 подвергается воздействию влажного воздуха, он реагирует с водой в воздухе, образуя UO 2 F 2 ( фторид уранила ) и HF ( фтористый водород ), оба из которых являются высококоррозионными и токсичными. В 2005 году 686 500 тонн D- UF 6 были размещены в 57 122 баллонах для хранения, расположенных недалеко от Портсмута, Огайо ; Ок-Риджа, Теннесси ; и Падьюки, Кентукки . [16] [17] Баллоны для хранения должны регулярно проверяться на наличие признаков коррозии и утечек. Предполагаемый срок службы стальных баллонов измеряется десятилетиями. [18]
Аварии и утилизация
В США произошло несколько аварий, связанных с гексафторидом урана, включая аварию при заполнении баллона и выброс материала на предприятии Sequoyah Fuels Corporation в 1986 году, где, по оценкам, вытекло 29 500 фунтов газообразного UF6 . [19] [20] Правительство США перерабатывало D UF6 в твердые оксиды урана для утилизации. [21] Такая утилизация всего запаса D UF6 может обойтись в сумму от 15 до 450 миллионов долларов. [22]
Ссылки
- ^ "Гексафторид урана". Архивировано из оригинала 2013-09-16 . Получено 2013-08-08 .
- ^ abcd Джонсон, Джеральд К. (1979). «Энтальпия образования гексафторида урана». Журнал химической термодинамики . 11 (5): 483–490. doi :10.1016/0021-9614(79)90126-5.
- ^ Фторид урана(VI)
- ^ ab Peehs, Martin; Walter, Thomas; Walter, Sabine; Zemek, Martin (2007). "Уран, сплавы урана и соединения урана". Энциклопедия промышленной химии Ульмана . doi :10.1002/14356007.a27_281.pub2. ISBN 978-3-527-30385-4.
- ^ Брикведде, Фердинанд Г.; Хоге, Гарольд Дж.; Скотт, Рассел Б. (1948). «Низкотемпературные теплоемкости, энтальпии и энтропии UF4 и UF6». J. Chem. Phys. 16 (5): 429–436. Bibcode :1948JChPh..16..429B. doi : 10.1063/1.1746914 .
- ^ JH Levy; John C. Taylor; Paul W. Wilson (1976). «Структура фторидов. Часть XII. Исследование нейтронной дифракции на одном кристалле гексафторида урана при 293 К». J. Chem. Soc., Dalton Trans. (3): 219–224. doi :10.1039/DT9760000219.
- ^ JH Levy, JC Taylor и AB Waugh (1983). "Нейтронные порошковые структурные исследования UF 6 , MoF 6 и WF 6 при 77 К". Журнал химии фтора . 23 : 29–36. doi :10.1016/S0022-1139(00)81276-2.
- ^ JC Taylor, PW Wilson, JW Kelly: «Структуры фторидов. I. Отклонения от идеальной симметрии в структуре кристаллического UF 6 : нейтронографический анализ», Acta Crystallogr. , 1973 , B29 , стр. 7–12; doi :10.1107/S0567740873001895.
- ^ Кимура, Масао; Шомакер, Вернер; Смит, Дарвин В.; Бернард (1968). «Исследование электронно-дифракционного анализа гексафторидов вольфрама, осмия, иридия, урана, нептуния и плутония». J. Chem. Phys. 48 (8): 4001–4012. Bibcode :1968JChPh..48.4001K. doi :10.1063/1.1669727. Архивировано из оригинала 2023-01-11 . Получено 2020-10-10 .
- ^ GH Olah; J. Welch (1978). «Синтетические методы и реакции. 46. Окисление органических соединений гексафторидом урана в растворах галогеналканов». J. Am. Chem. Soc. 100 (17): 5396–5402. doi :10.1021/ja00485a024.
- ^ JA Berry; RT Poole; A. Prescott; DWA Sharp; JM Winfield (1976). «Окислительные и акцепторные свойства гексафторида урана в ацетонитриле в качестве фторид-иона». J. Chem. Soc., Dalton Trans. (3): 272–274. doi :10.1039/DT9760000272.
- ^ SM Walker; PS Halasyamani; S. Allen; D. O'Hare (1999). "От молекул к каркасам: переменная размерность в системе UO 2 (CH 3 COO) 2 ·2H 2 O/HF(aq)/пиперазин. Синтезы, структуры и характеристика нульмерного (C 4 N 2 H 12 )UO 2 F 4 ·3H 2 O, одномерного (C 4 N 2 H 12 ) 2 U 2 F 12 ·H 2 O, двумерного (C 4 N 2 H 12 ) 2 (U 2 O 4 F 5 ) 4 ·11H 2 O и трехмерного (C 4 N 2 H 12 )U 2 O 4 F 6 ". J. Am. Chem. Soc . 121 (45): 10513–10521. doi :10.1021/ja992145f.
- ^ "Гексафторид урана: Источник: Приложение A PEIS (DOE/EIS-0269): Физические свойства". web.evs.anl.gov . Получено 18.08.2022 .
- ^ "Обогащение урана и процесс газовой диффузии". USEC Inc. Архивировано из оригинала 2007-10-19 . Получено 2007-09-24 .
- ^ "Конвертер единиц молярной массы калькулятор". TranslatorsCafé . Миссиссога, Онтарио, Канада: ANVICA Software Development. 1 февраля 2021 г.
- ^ "Сколько обедненного гексафторида урана хранится в Соединенных Штатах?". Часто задаваемые вопросы об обедненном UF 6 . Аргоннская национальная лаборатория .
- ^ "Depleted UF6 Management Program Documents". Архивировано из оригинала 2008-02-16 . Получено 2006-05-17 .
- ^ «Что такое DUF6? Опасен ли он и что с ним делать?». Институт исследований энергетики и окружающей среды. 2007-09-24.
- ^ Brugge, D.; Delemos, JL; Bui, C. (2007). «Выброс топлива Sequoyah Corporation и разлив в Church Rock: нераскрытые ядерные выбросы в общинах американских индейцев». American Journal of Public Health . 97 (9): 1595–1600. doi :10.2105/AJPH.2006.103044. PMC 1963288. PMID 17666688 .
- ^ "Были ли аварии, связанные с гексафторидом урана?". Часто задаваемые вопросы об обедненном UF 6. Аргоннская национальная лаборатория. Архивировано из оригинала 2017-06-09.
- ^ "Что произойдет с гексафторидом урана, хранящимся в Соединенных Штатах?". Часто задаваемые вопросы об обедненном UF 6. Аргоннская национальная лаборатория.
- ^ «Существуют ли в настоящее время какие-либо действующие объекты по утилизации, которые могут принять весь обедненный оксид урана, который будет получен в результате конверсии обедненного запаса UF6 Министерства энергетики?». Часто задаваемые вопросы об обедненном UF6 . Аргоннская национальная лаборатория.
Дальнейшее чтение
- Gmelins Handbuch der anorganischen Chemie , System Nr. 55, Уран, Тейл А, с. 121–123.
- Gmelins Handbuch der anorganischen Chemie , System Nr. 55, Уран, Тейл С 8, с. 71–163.
- Р. ДеВитт: Гексафторид урана: обзор физико-химических свойств , Технический отчет, GAT-280; Goodyear Atomic Corp., Портсмут, Огайо; 12 августа 1960 г.; doi : 10.2172/4025868.
- Ингмар Гренте, Януш Дрождзински, Такео Фуджино, Эдгар К. Бак, Томас Э. Альбрехт-Шмитт , Стивен Ф. Вольф: Уран, архив 2012-01-18 в Wayback Machine , в: Лестер Р. Морсс, Норман М. Эдельштейн, Жан Фугер (Hrsg.): Химия актинидных и трансактинидных элементов , Springer, Дордрехт 2006; ISBN 1-4020-3555-1 , стр. 253–698; doi :10.1007/1-4020-3598-5_5 (стр. 530–531, 557–564).
- Патент США 2535572: Приготовление UF6; 26 декабря 1950 г.
- Патент США 5723837: Очистка гексафторида урана; 3 марта 1998 г.
Внешние ссылки
- Саймон Коттон (Школа Аппингема, Ратленд, Великобритания): Гексафторид урана.
- Гексафторид урана (UF6) – Физические и химические свойства UF6 и его использование в переработке урана – Гексафторид урана и его свойства
- Гексафторид урана в WebElements
- Импорт западного обедненного гексафторида урана (урановых хвостов) в Россию [ссылка недоступна 30 июня 2017 г.]




![Шаростержневая модель элементарной ячейки гексафторида урана[8]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c6/Uranium-hexafluoride-unit-cell-3D-balls.png/180px-Uranium-hexafluoride-unit-cell-3D-balls.png)
![Длины связей и углы газообразного гексафторида урана[9]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Uranium_hexafluoride_dimensions.svg/180px-Uranium_hexafluoride_dimensions.svg.png)



