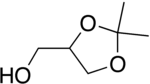
Солкеталь
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК (2,2-Диметил-1,3-диоксолан-4-ил)метанол | |
| Другие имена Изопропилиден глицерин | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| Информационная карта ECHA | 100.002.626 |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С6Н12О3 | |
| Молярная масса | 132,159 г·моль −1 |
| Появление | прозрачная бесцветная жидкость |
| Плотность | 1,063 г/мл при 25 °C |
| Точка кипения | 188–189 °C (370–372 °F; 461–462 K) |
| Смешивающийся | |
| Растворимость | Смешивается с большинством органических растворителей (спирты, эфиры, углеводороды) |
| Опасности | |
| точка возгорания | 80 °C (176 °F; 353 К) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Solketal — защищенная форма глицерина с изопропилиденацетальной группой, соединяющей две соседние гидроксильные группы. Solketal содержит хиральный центр на центральном углероде глицериновой цепи, поэтому его можно приобрести либо в виде рацемата , либо в виде одного из двух энантиомеров . Solketal широко использовался в синтезе моно-, ди- и триглицеридов путем образования сложноэфирной связи. Свободная гидроксильная группа solketal может быть этерифицирована карбоновой кислотой с образованием защищенного моноглицерида. Затем изопропиленовую группу можно удалить с помощью кислотного катализатора в водной или спиртовой среде. Затем незащищенный диол можно этерифицировать далее с образованием ди- или триглицерида.
Другой путь к определенным ди- или триглицеридам включает преобразование солкеталя в глицидол (2,3-эпокси-1-пропанол) и этерификацию его одной жирной кислотой перед открытием эпоксида путем нагревания в присутствии второй жирной кислоты и катализатора. Эта вторая жирная кислота помещается на третий атом углерода, а затем третья жирная кислота может быть добавлена ко второму атому углерода. [1]
Ссылки
- ^ CM Lok, JP Ward, DA van Dorp (март 1976). «Синтез хиральных глицеридов, начиная с D- и L-серина». Химия и физика липидов . 16 (2): 115– 122. doi :10.1016/0009-3084(76)90003-7. PMID 1269065.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )
Эта статья включает список ссылок , связанных с ней материалов или внешних ссылок , но ее источники остаются неясными, поскольку в ней отсутствуют встроенные цитаты . ( Июль 2013 г. ) |
- Мэри Рэнолл и Мелвин С. Ньюман (1955). "dl-ИЗОПРОПИЛИДЕНГЛИЦЕРОЛ". Органические синтезы . 28 : 73; Собрание томов , т. 3, стр. 502.
- Сандерсон, Джон Р.; Линь, Цзян Дж.; Дюранло, Роджер Г.; Йеки, Эрнест Л.; Маркиз, Эдвард Т. (1988). «Свободные радикалы в органическом синтезе. Новый синтез глицерина на основе этиленгликоля и формальдегида». Журнал органической химии . 53 (12): 2859. doi :10.1021/jo00247a043.
- "Solketal". Логотип chemBlink Inc. Онлайн-база данных химикатов со всего мира. Архивировано из оригинала 13 декабря 2010 г.
- Мацумото, Ёсихико; Мита, Кейсуке; Хашимото, Кейджи; Иио, Хидео; Токорояма, Такаши (1996). «Селективное расщепление эфиров с использованием катализаторов на основе алюмосиликатного геля, приготовленных методом золь-гель». Тетраэдр . 52 (28): 9387. doi :10.1016/0040-4020(96)00501-7.



