Пирамидальный алкен
Пирамидальные алкены — это алкены , в которых два атома углерода, образующие двойную связь , не копланарны с их четырьмя заместителями . Эта деформация является результатом геометрических ограничений. Пирамидальные алкены представляют интерес только потому, что из них можно многое узнать о природе химических связей . [1]
Энергетика
Скручивание до двугранного угла 90° между двумя группами на углероде требует меньше энергии, чем прочность пи-связи , и связь все еще сохраняется. Углерод двойной связи становится пирамидальным , что позволяет сохранить некоторое выравнивание p-орбитали — и, следовательно, пи-связь. Две другие присоединенные группы остаются под большим двугранным углом. Это противоречит распространенному утверждению учебника о том, что два углерода сохраняют свою плоскую природу при скручивании, и в этом случае p-орбитали будут достаточно далеко вращаться друг от друга, чтобы не поддерживать пи-связь. В алкене, скрученном на 90°, p-орбитали смещены всего на 42°, а энергия деформации составляет всего около 40 ккал/моль. Напротив, полностью разорванная пи-связь имеет энергетическую стоимость около 65 ккал/моль. [2]
Примеры
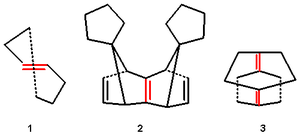
В циклогептене ( 1.1 ) цис- изомер представляет собой обычную ненапряженную молекулу, но гептановое кольцо слишком мало для размещения транс -конфигурированной алкеновой группы, что приводит к напряжению и скручиванию двойной связи. Смещение p-орбитали минимизируется степенью пирамидализации . В родственных анти-Бредтовских молекулах доминирует не пиримидализация, а скручивание.
Существуют также пирамидальные каркасные алкены , в которых преобладает симметричный изгиб заместителей без смещения p-орбиталей.
Угол пирамидализации φ ( b ) определяется как угол между плоскостью, образованной одним из двухсвязанных атомов углерода и его двумя заместителями, и продолжением двойной связи и рассчитывается как:
Угол изгиба бабочки или угол складывания ψ ( c ) определяется как угол между двумя плоскостями и может быть получен путем усреднения двух углов кручения R 1 C=CR 3 и R 2 C=CR 4 .
В алкенах 1.2 и 1.3 эти углы определяются с помощью рентгеновской кристаллографии как соответственно 32.4°/22.7° и 27.3°/35.6°. Хотя эти алкены стабильны, они очень реакционноспособны по сравнению с обычными алкенами. Они склонны к димеризации, создавая циклобутановые кольца, или реагируют с кислородом с образованием эпоксидов .
Соединение тетрадегидродиантрацен, также с углом пирамидализации 35°, синтезируется в фотохимической реакции циклоприсоединения бромантрацена с последующим отщеплением бромистого водорода .
Это соединение очень реактивно в реакциях Дильса-Альдера из-за пространственных взаимодействий между двумя алкеновыми группами. Эта повышенная реактивность в свою очередь позволила синтезировать первый в истории аромат Мебиуса .
В одном исследовании [3] был синтезирован напряженный алкен 4.4 с самыми высокими углами пирамидализации на сегодняшний день, 33,5° и 34,3°. Это соединение является двойным аддуктом Дильса-Альдера дииодциклофана 4.1 и антрацена 4.3 в результате реакции в присутствии трет-бутоксида калия в кипящем дибутиловом эфире через промежуточный диарино 4.2 . Это стабильное соединение, но будет медленно реагировать с кислородом до эпоксида, если оставить его в виде раствора хлороформа .
В одном исследовании [4] выделение пирамидального алкена даже путем матричной изоляции при чрезвычайно низких температурах невозможно , если только он не стабилизирован координацией металла :
Реакция дииодида 5.1 на рисунке 5 с амальгамой натрия в присутствии этиленбис(трифенилфосфин)платины(0) не дает промежуточного алкена 5.2, но стабилизирует платину 5.3 . Сигма-связь в этом соединении разрушается при реакции с этанолом .
Ссылки
- ^ Васкес, Сантьяго; Кэмпс, Пелайо (2005). «Химия пирамидальных алкенов». Тетраэдр . 61 (22): 5147–5208. doi :10.1016/j.tet.2005.03.055.
- ^ Барроуз, Сьюзан Э.; Эберлейн, Томас Х. (2005). «Понимание вращения вокруг двойной связи C=C». J. Chem. Educ . 82 (9): 1329. Bibcode : 2005JChEd..82.1329B. doi : 10.1021/ed082p1329.
- ^ Dolbier, WR Jr; Zhai, Y.-A.; Battiste, MA; Abboud, KA; Ghiviriga, I. (2005). "Высокопирамидализованный клеточный алкен, образованный посредством двойного циклоприсоединения Дильса-Альдера син -4,5,13,14-бис(дегидро)октафторпарациклофана к антрацену". J. Org. Chem. 70 (25): 10336–10341. doi :10.1021/jo051488v. PMID 16323842.
- ^ Theophanous, Fanitsa A.; Tasiopoulos, Anastasios J.; Nicolaides, Athanassios; Zhou, Xin; Johnson, William TG; Borden, Weston Thatcher (2006). «Доказательства образования комплекса (Ph 3 P) 2 Pt 3,7-диметилтрицикло[3.3.0.0 3,7 ]окт-1(5)-ена, наиболее высокопирамидализованного алкена в гомологическом ряду. Выделение и рентгеновская структура продукта присоединения этанола к комплексу». Org. Lett. 8 (14): 3001–3004. doi :10.1021/ol060994j. PMID 16805537.