Трополон
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК 2-Гидроксициклогепта-2,4,6-триен-1-он | |||
| Другие имена 2-гидрокситропон; пурпурокатехин | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ЧЭБИ |
| ||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.007.799 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
| МеШ | Д014334 | ||
CID PubChem |
| ||
| УНИИ | |||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С7Н6О2 | |||
| Молярная масса | 122,12 г/моль | ||
| Температура плавления | от 50 до 52 °C (от 122 до 126 °F; от 323 до 325 K) | ||
| Точка кипения | от 80 до 84 °C (от 176 до 183 °F; от 353 до 357 K) (0,1 мм рт. ст.) | ||
| Кислотность ( pK a ) | 6,89 (и -0,5 для сопряженной кислоты) | ||
| -61·10 −6 см 3 /моль | |||
| Опасности | |||
| Маркировка СГС : [2] | |||
   | |||
| Опасность | |||
| Н314 , Н317 , Н410 | |||
| P260 , P261 , P264 , P272 , P273 , P280 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , П333+П313 , П363 , П391 , П405 , П501 | |||
| точка возгорания | 112 °C (234 °F; 385 К) | ||
| Родственные соединения | |||
Родственные соединения | Хинокитиол (4-изопропил-трополон) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Трополон — органическое соединение с химической формулой C7H5 (OH)O . Это бледно-желтое твердое вещество, растворимое в органических растворителях. Соединение представляет интерес для химиков-исследователей из-за своей необычной электронной структуры и роли в качестве предшественника лиганда. Хотя его обычно не получают из тропона , его можно рассматривать как его производное с гидроксильной группой в 2-м положении.
Синтез и реакции
Было описано много методов синтеза трополона. [ 3] Один из них включает бромирование 1,2-циклогептандиона N -бромсукцинимидом с последующим дегидрогалогенированием при повышенных температурах, в то время как другой использует ацилоиновую конденсацию этилового эфира пимелиновой кислоты с последующим окислением ацилоина бромом . [4]
Альтернативный путь – это [2+2] циклоприсоединение циклопентадиена с кетеном с образованием бицикло[3.2.0]гептильной структуры с последующим гидролизом и разрывом связи слияния с образованием одного кольца: [3]
Гидроксильная группа трополона является кислотной , с p K a 7, что находится между фенолом (10) и бензойной кислотой (4). Повышенная кислотность по сравнению с фенолом обусловлена резонансной стабилизацией с карбонильной группой, как винилогической карбоновой кислотой. [4]
Соединение легко подвергается O - алкилированию с образованием производных циклогептатриенила, которые в свою очередь являются универсальными синтетическими промежуточными продуктами. [5] С катионами металлов оно подвергается депротонированию с образованием бидентатного лиганда, например, в комплексе Cu(O 2 C 7 H 5 ) 2. [4]
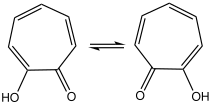
Карбонильная группа также сильно поляризована, как это обычно бывает у тропонов . Между ней и гидроксильной группой может быть значительная водородная связь , что приводит к быстрой таутомеризации : структура симметрична на шкале времени ЯМР. [6]
Естественное явление
Было выделено около 200 природных производных трополона, в основном из растений и грибов . [7] [8] [9] [10] Соединения трополона и их производные включают долабрины, долабринолы, туяплицины , туяплицинолы, стипитатовую кислоту , стипитатоновую кислоту, нооткатин, нооткатинол, пуберуловую кислоту , пуберулоновую кислоту, сепедонин, 4-ацетилтрополон, пигмаеин, изопигмаеин, процеин, ханутин, бензотрополоны (такие как пурпурогаллин , кроциподин, гупиолон А и В), теафлавин и производные бромотрополоны, тропоизохинолины и трополоизохинолины (такие как грандирубрин, имерубрин, изоимерубрин, парейтропон, парейрубрин А и В), колхицин , колхикон и другие. [11] Трополон возникает через поликетидный путь, который дает фенольный промежуточный продукт, который подвергается расширению кольца. [5]
Они особенно часто встречаются в определенных видах растений, таких как семейства Cupressaceae и Liliaceae . [9] Трополоны в основном встречаются в сердцевине, листьях и коре растений, поэтому эфирные масла богаты различными типами трополонов. Первые природные производные трополонов были изучены и очищены в середине 1930-х и начале 1940-х годов. [12] Thuja plicata , Thujopsis dolabrata , Chamaecyparis obtusa , Chamaecyparis taiwanensis и Juniperus thurifera были в списке деревьев, из которых были идентифицированы первые трополоны. Первыми синтетическими трополонами были туяплицины, полученные Ральфом Рафаэлем . [13]
Производные трополона
| Имя | Химическая структура | Природные источники |
|---|---|---|
| Трополон |  | Pseudomonas lindbergii , Pseudomonas plantarii [14] [15] [16] и грибная тирозиназа . [17] |
| Хинокитиол |  | Деревья семейства кипарисовых [18] |
| Степитовая кислота |  | Talaromyces stipitatus [19] |
| Колхицин |  | Безвременник осенний , Gloriosa superba [20] |
| Сорт | Примеры | Основные природные источники [11] [9] [21] [22] | Направления исследований [9] [23] [11] [24] [25] | Запатентовано в продуктах [9] [26] |
|---|---|---|---|---|
| Простые трополоны | Трополон | Pseudomonas lindbergii , Pseudomonas plantarii | Антибактериальное, противогрибковое, инсектицидное, пестицидное, ингибирующее рост растений, противовоспалительное, антиоксидантное, нейропротекторное, антипротеазное, противопожарное (антитирозиназное и антиполифенолоксидазное), противоопухолевое, хелатирующее | - |
| Долабрины | β-долабрин, α-долабринол | Caragana pygmaea , Cupressus goveniana , Cupressus abramsiana , Thujopsis dolabrata | Антибактериальное, противогрибковое, инсектицидное, пестицидное, ингибирующее рост растений, ингибирующее протеазу | Средство от насекомых, дезодорант |
| Туяплицины | α-туяплицин, β-туяплицин ( хинокитиол ), γ-туяплицин, туяплицинол | Chamaecyparis obtusa , Thuja plicata , Thujopsis dolabrata , Juniperus cedrus , Cedrus atlantica , Cupressus lusitanica , Chamaecyparis Lawsoniana , Chamaecyparis taiwanensis , Chamaecyparis thoides , Cupressus arizonica , Cupressus macnabiana , Cupressus macrocarpa , Cupressus guadalupensis , Juniperus chinensis , Juniperus communis , Juniperus Californica , Juniperus occidentalis , Juniperus oxycedrus , Juniperus sabina , Calocedrus decurrens , Calocedrus formosana , Platycladus orientalis , Thuja occidentalis , Thuja Standishii , Tetraclinis articulata , Cattleya forbesii , Carya glabra | Противогрибковое, антибактериальное, против потемнения (анти-тирозиназное), хелатирующее, инсектицидное, пестицидное, противомалярийное, противовирусное, противовоспалительное, ингибирующее рост растений, антипротеазное, противодиабетическое, противоопухолевое, химиосенсибилизирующее, антиоксидантное, нейропротекторное, ветеринарное | Средство от насекомых, дезодорант, зубная паста, спрей для полости рта, уход за кожей и волосами, консервант для древесины, пищевая добавка , упаковка для пищевых продуктов |
| Сесквитерпеновые трополоны | Нооткатин, нооткатинол, нооткатол, нооткатен, валентен-13-ол, нооткастатин | Chamaecyparis nootkatensis , Грейпфрут | Противогрибковое, противопожарное (антитирозиназное), инсектицидное, фунгицидное, противоопухолевое | Средства от насекомых, ароматизаторы, парфюмерия |
| Пигмеи | Пигмеин, Изопигмеин | Caragana pygmaea , Cupressus goveniana , Cupressus abramsiana | - | - |
| Бензотрополоны | Пурпурогаллин , кроциподин, гупиолон А и В | Виды Quercus , Leccinum crocipodium , Goupia glabra | Антибактериальное, ингибирующее рост растений, ингибирующее протеазу, противоопухолевое, противомалярийное, антиоксидантное, противовирусное | Пищевая добавка |
| Теафлавины | Теафлавин , теафлавовая кислота, теафлаваты А и В | Camellia sinensis ,виды Quercus | Антибактериальное, противовоспалительное, антиоксидантное, противовирусное, антидиабетическое, химиосенсибилизирующее | - |
| Тропоизохинолины и трополоизохинолины | Грандирубрин, имерубрин, изоимерубрин, пареитропон, парейрубрин А и В | Чиссампелос парейра , Abuta grandifolia | Противолейкемический | - |
| Тропоновые алкалоиды | Колхицин , демекольцин | Безвременник осенний , Gloriosa superba | Антимитотическое, противовоспалительное, противоподагрическое, селекционное средство для растений | Фармацевтический препарат |
Ссылки
- ^ Трополон [ постоянная мертвая ссылка ] в Sigma-Aldrich
- ^ "Трополон". pubchem.ncbi.nlm.nih.gov .
- ^ аб Миннс РА (1977). «Трополон». Орг. Синтез. 57 : 117. дои : 10.15227/orgsyn.057.0117.
- ^ abc Pauson PL (1955). «Тропоны и трополоны». Chem. Rev. 55 (1): 9–136. doi :10.1021/cr50001a002.
- ^ ab Pietra F (1973). «Семичленные сопряженные карбо- и гетероциклические соединения и их гомоконъюгированные аналоги и комплексы металлов. Синтез, биосинтез, структура и реакционная способность». Chemical Reviews . 73 (4): 293–364. doi :10.1021/cr60284a002.
- ^ Jin L (февраль 1987). Детоксикация туяплицинов в живых деревьях западного красного кедра ( Thuja plicata Donn.) микроорганизмами (PhD). Университет Британской Колумбии.
- ^ Бентли Р. (2008). «Новый взгляд на природные трополоны». Nat. Prod. Rep . 25 (1): 118–138. doi :10.1039/b711474e. PMID 18250899.
- ^ Guo H, Roman D, Beemelmanns C (2019). «Натуральные продукты Tropolone». Natural Product Reports . 36 (8): 1137–1155. doi :10.1039/c8np00078f. PMID 30556819.
- ^ abcde Zhao JZ (30 сентября 2007 г.). «Тропоноиды растений: химия, биологическая активность и биосинтез». Current Medicinal Chemistry . 14 (24): 2597–2621. doi :10.2174/092986707782023253. PMID 17979713.
- ^ Бентли Р. (2008). «Новый взгляд на природные трополоны». Nat. Prod. Rep . 25 (1): 118–138. doi :10.1039/b711474e. PMID 18250899.
- ^ abc Liu N, Song W, Schienebeck CM, Zhang M, Tang W (декабрь 2014 г.). «Синтез природных тропонов и трополонов». Tetrahedron . 70 (49): 9281–9305. doi :10.1016/j.tet.2014.07.065. PMC 4228802 . PMID 25400298.
- ^ Nakanishi K (июнь 2013 г.). «Автографические книги химиков 1953–1994 гг. Тетсуо Нозоэ»: эссе: «Автографические книги химиков 1953–1994 гг. Тетсуо Нозоэ»: эссе. The Chemical Record . 13 (3): 343–352. doi : 10.1002/tcr.201300007 . PMID 23737463.
- ^ Кук Дж. В., Рафаэль РА, Скотт А. И. (1951). «149. Трополоны. Часть II. Синтез α-, β- и γ-туяплицинов». J. Chem. Soc. : 695–698. doi :10.1039/JR9510000695.
- ^ Liu N, Song W, Schienebeck CM, Zhang M, Tang W (декабрь 2014 г.). «Синтез природных тропонов и трополонов». Tetrahedron . 70 (49): 9281–9305. doi :10.1016/j.tet.2014.07.065. PMC 4228802 . PMID 25400298.
- ^ Valero E, Garcia-Moreno M, Varon R, Garcia-Carmona F (1991). «Зависимое от времени ингибирование полифенолоксидазы винограда трополоном». Журнал сельскохозяйственной и пищевой химии . 39 (6): 1043–1046. Bibcode : 1991JAFC...39.1043V. doi : 10.1021/jf00006a007.
- ^ Чеджи, Рассел. Вторичные метаболиты западного красного кедра (Thuja plicata): их биотехнологическое применение и роль в обеспечении естественной долговечности . LAP Lambert Academic Publishing, 2010, ISBN 3-8383-4661-0 , ISBN 978-3-8383-4661-8
- ^ Kahn V, Andrawis A (1985). «Ингибирование грибной тирозиназы трополоном». Фитохимия . 24 (5): 905–908. Bibcode : 1985PChem..24..905K. doi : 10.1016/S0031-9422(00)83150-7.
- ^ Saniewski M, Horbowicz M, Kanlayanarat S (10 сентября 2014 г.). «Биологическая активность тропоноидных растений и их использование в сельском хозяйстве. Обзор». Журнал исследований в области садоводства . 22 (1): 5–19. doi : 10.2478/johr-2014-0001 .
- ^ Davison J, al Fahad A, Cai M, Song Z, Yehia SY, Lazarus CM, Bailey AM, Simpson TJ, Cox RJ (15 мая 2012 г.). «Генетические, молекулярные и биохимические основы биосинтеза трополона грибами». Труды Национальной академии наук . 109 (20): 7642–7647. doi : 10.1073/pnas.1201469109 . PMC 3356636. PMID 22508998 .
- ^ Keith MP, Gilliland WR, Uhl K (2009). «ПОЖАЛОБА». Фармакология и терапия : 1039–1046. doi :10.1016/B978-1-4160-3291-5.50079-2. ISBN 978-1-4160-3291-5.
- ^ Karchesy JJ, Kelsey RG, González-Hernández MP (май 2018 г.). «Желтый кедр, Callitropsis (Chamaecyparis) nootkatensis, вторичные метаболиты, биологическая активность и химическая экология». Журнал химической экологии . 44 (5): 510–524. Bibcode : 2018JCEco..44..510K. doi : 10.1007/s10886-018-0956-y. PMID 29654493. S2CID 4839697.
- ^ Токсикологические чрезвычайные ситуации Голдфранка . Нельсон, Льюис, 1963- (Одиннадцатое изд.). Нью-Йорк. 11 апреля 2019 г. ISBN 978-1-259-85961-8. OCLC 1020416505.
{{cite book}}: CS1 maint: местоположение отсутствует издатель ( ссылка ) CS1 maint: другие ( ссылка ) - ^ Карлссон Б., Эрдтман Х., Фрэнк А., Харви В.Е., Эстлинг С. (1952). «Химия Cupressales естественного порядка. VIII. Составляющие сердцевины Chamaecyparis nootkatensis - карвакрол, нооткатин и каминовая кислота». Acta Chemica Scandinavica . 6 : 690–696. doi : 10.3891/acta.chem.scand.06-0690 .
- ^ Dalbeth N, Lauterio TJ, Wolfe HR (октябрь 2014 г.). «Механизм действия колхицина при лечении подагры». Clinical Therapeutics . 36 (10): 1465–1479. doi : 10.1016/j.clinthera.2014.07.017 . PMID 25151572.
- ^ Гриффитс А. Дж., Гелбарт В. М., Миллер Дж. Х. (1999). «Современный генетический анализ: изменения в числе хромосом». Современный генетический анализ . WH Freeman, Нью-Йорк.
- ^ US EPA O (10 августа 2020 г.). «Nootkatone теперь зарегистрирован EPA». US EPA .