Протеин А
| Белок А, домен связывания Ig | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
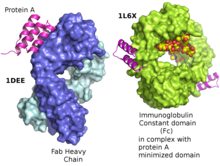 Структура домена белка А в виде трехспирального пучка, связывающегося с тяжелой вариабельной цепью человеческого Fab VH3 (слева). [1] Минимизированный белок А, связанный с Fc-фрагментом Ритуксимаба (справа). [2] Uniprot P02976 . | |||||||||||
| Идентификаторы | |||||||||||
| Символ | СпА | ||||||||||
| Пфам | ПФ02216 | ||||||||||
| ИнтерПро | IPR003132 | ||||||||||
| СКОП2 | 1DEE / ОБЛАСТЬ ПРИМЕНЕНИЯ / SUPFAM | ||||||||||
| |||||||||||
Белок А — это поверхностный белок массой 42 кДа , изначально обнаруженный в клеточной стенке бактерий Staphylococcus aureus . Он кодируется геном spa , а его регуляция контролируется топологией ДНК, клеточной осмолярностью и двухкомпонентной системой, называемой ArlS-ArlR. Он нашел применение в биохимических исследованиях из-за своей способности связывать иммуноглобулины . Он состоит из пяти гомологичных доменов связывания Ig, которые сворачиваются в трехспиральный пучок. Каждый домен способен связывать белки многих видов млекопитающих, в первую очередь IgG . Он связывает тяжелую цепь в области Fc большинства иммуноглобулинов, а также в области Fab в случае семейства человеческих VH3. Благодаря этим взаимодействиям в сыворотке, где молекулы IgG связаны в неправильной ориентации (по отношению к нормальной функции антител ), бактерии нарушают опсонизацию и фагоцитоз . [3]
История
В качестве побочного продукта своей работы над типоспецифическими антигенами стафилококка Вервей в 1940 году сообщил, что фракция белка, полученная из экстрактов этих бактерий, неспецифически преципитировала кроличьи антисыворотки, полученные против различных типов стафилококков. [4] В 1958 году Йенсен подтвердил открытие Вервея и показал, что сыворотки кроликов до иммунизации, а также нормальные сыворотки человека связываются с активным компонентом в экстракте стафилококка; он обозначил этот компонент как антиген А (потому что он был обнаружен во фракции А экстракта), но считал, что это полисахарид. [5] Неправильная классификация белка была результатом ошибочных тестов, [6] но вскоре после этого (1962) Лёфквист и Шёквист исправили ошибку и подтвердили, что антиген А на самом деле был поверхностным белком на бактериальной стенке определенных штаммов S. aureus . [7] Группа ученых из Бергена из Норвегии назвала белок «Белок А» в честь антигенной фракции, выделенной Йенсеном. [8]
Связывание антител с белком А
С помощью кристаллографического уточнения было показано, что первичный сайт связывания для белка A находится в области Fc, между доменами C H 2 и C H 3. [9] Кроме того, было показано, что белок A связывает молекулы человеческого IgG, содержащие фрагменты IgG F(ab')2 из семейства генов человека VH3. [10]
Белок А может связываться с высокой степенью сродства с Fc-фрагментом иммуноглобулина определенных видов, как показано в таблице ниже. [11]
| Разновидность | Подкласс | Связывание |
|---|---|---|
| Человек | IgA | переменная |
| IgD | слабый или никакой | |
| IgE | слабый или никакой | |
| IgG 1 | сильный | |
| IgG 2 | сильный | |
| IgG 3 | слабый или никакой | |
| IgG 4 | сильный | |
| IgM | переменная | |
| Желток птичьего яйца | IgY | слабый или никакой |
| Бычий | середина | |
| Собачий | середина | |
| Козел | слабый или никакой | |
| морская свинка | IgG 1 | сильный |
| хомяк | слабый | |
| Лошадь | середина | |
| Коала | слабый или никакой | |
| Лама | слабый или никакой | |
| Обезьяна (резус) | сильный | |
| Мышиный | IgG 1 | слабый |
| IgG 2a | сильный | |
| IgG 2 | от среднего до сильного | |
| IgG 3 | середина | |
| IgM | переменная | |
| Свинья | от среднего до сильного | |
| Кролик | сильный | |
| Крыса | IgG 1 | слабый или никакой |
| IgG 2a | слабый или никакой | |
| IgG 2b | слабый или никакой | |
| IgG 3 | слабый | |
| Овца | слабый или никакой |
Другие белки, связывающие антитела
Помимо белка А, для очистки, иммобилизации или обнаружения иммуноглобулинов обычно используются другие бактериальные белки, связывающие иммуноглобулины, такие как белок G , белок A/G и белок L.
Роль в патогенезе
Как патоген, Staphylococcus aureus использует белок A, наряду с множеством других белков и поверхностных факторов, чтобы способствовать своему выживанию и вирулентности. С этой целью белок A играет многогранную роль:
- Связывая Fc-фрагмент антител, белок А делает их недоступными для опсонинов, тем самым нарушая фагоцитоз бактерий посредством атаки иммунных клеток.
- Белок А облегчает прикрепление S. aureus к поверхностям, покрытым человеческим фактором Виллебранда (vWF), тем самым повышая инфекционность бактерий в месте проникновения через кожу.
- Протеин А может вызывать воспаление легочной ткани, связываясь с рецепторами фактора некроза опухоли 1 (TNFR-1). Было показано, что это взаимодействие играет ключевую роль в патогенезе стафилококковой пневмонии.
- Было показано, что белок А подавляет гуморальный (опосредованный антителами) иммунитет, что, в свою очередь, означает, что люди могут повторно заражаться S. aureus , поскольку они не могут выработать сильный иммунный ответ.
- Было показано, что белок А способствует образованию биопленок как в случае, когда белок ковалентно связан с клеточной стенкой бактерий, так и в растворе. [12]
Белок А помогает ингибировать фагоцитарное поглощение и действует как иммунологическая маскировка. Более высокие уровни белка А в различных штаммах S. aureus связаны с носовым носительством этой бактерии. [13]
Мутанты S. aureus, лишенные белка А, более эффективно фагоцитируются in vitro, а мутанты в моделях инфекции обладают сниженной вирулентностью. [14]
Производство
Белок А производится и очищается в процессе промышленной ферментации для использования в иммунологии, биологических исследованиях и промышленных приложениях (см. ниже). Природный (или нативный) белок А может быть культивирован в Staphylococcus aureus и содержит пять гомологичных областей связывания антител, описанных выше, и C-концевую область для прикрепления к клеточной стенке. Сегодня белок А чаще всего производится рекомбинантным способом в Escherichia coli . ( Brevibacillus также показал себя эффективным хозяином. [15] ) Рекомбинантные версии белка А также содержат пять гомологичных доменов связывания антител, но могут различаться в других частях структуры для облегчения связывания с пористыми субстратами. [16] Также доступны сконструированные версии белка, первой из которых был rProtein A, B4, C-CYS. [17] Сконструированные версии представляют собой мультимеры (обычно тетрамеры, пентамеры или гексамеры) одного домена, который был модифицирован для улучшения удобства использования в промышленных приложениях.
Исследовать
Белок А часто связывается с другими молекулами, такими как флуоресцентный краситель , ферменты , биотин , коллоидное золото или радиоактивный йод, не влияя на сайт связывания антитела. Примеры, включая окрашивание белком А–золото (PAG), используемое в иммунозолотой маркировке , связанный с флуорофором белок А для иммунофлуоресценции и связанный с ДНК-цепью белок А для визуализации ДНК-PAINT. [18] Он также широко используется в сочетании с магнитными, латексными и агарозными шариками.
Белок А часто иммобилизуют на твердой подложке и используют в качестве надежного метода очистки общего IgG из сырых белковых смесей, таких как сыворотка или асцитная жидкость, или в сочетании с одним из вышеперечисленных маркеров для обнаружения присутствия антител. Первый пример связывания белка А с пористой бусиной для очистки IgG был опубликован в 1972 году. [19] Исследования иммунопреципитации с белком А, конъюгированным с бусинами, также обычно используются для очистки белков или белковых комплексов косвенно через антитела против интересующего белка или белкового комплекса.
Роль в промышленной очистке антител

Первая ссылка в литературе на коммерчески доступную хроматографическую смолу на основе белка А появилась в 1976 году. [20] Сегодня хроматографическое разделение с использованием белка А, иммобилизованного на пористых субстратах, является наиболее широко распространенным методом очистки моноклональных антител (mAbs) из супернатанта клеточной культуры урожая. [21] Выбор белка А в качестве предпочтительного метода обусловлен высокой чистотой и выходом, которые легко и надежно достигаются. Это формирует основу для общей «платформы» очистки антител, которая упрощает производственные операции и сокращает время и усилия, необходимые для разработки процессов очистки. [22] Типичный процесс очистки mAb показан справа. Несмотря на долгую историю хроматографии на основе белка А для производства антител, этот процесс все еще совершенствуется сегодня. Непрерывная хроматография, точнее периодическая противоточная хроматография , значительно увеличивает производительность этапа очистки.
Ссылки
- ^ Graille M, Stura EA, Corper AL, Sutton BJ, Taussig MJ, Charbonnier JB, Silverman GJ (май 2000 г.). «Кристаллическая структура домена белка Staphylococcus aureus A в комплексе с фрагментом Fab антитела IgM человека: структурная основа распознавания рецепторов B-клеток и суперантигенной активности». Труды Национальной академии наук Соединенных Штатов Америки . 97 (10): 5399–404. Bibcode : 2000PNAS...97.5399G. doi : 10.1073/pnas.97.10.5399 . PMC 25840. PMID 10805799 .
- ^ Idusogie EE, Presta LG, Gazzano-Santoro H, Totpal K, Wong PY, Ultsch M и др. (апрель 2000 г.). «Картирование сайта связывания C1q на ритуксане, химерном антителе с Fc человеческого IgG1». Журнал иммунологии . 164 (8): 4178–84. doi : 10.4049/jimmunol.164.8.4178 . PMID 10754313.
- ^ Keener AB, Thurlow LT, Kang S, Spidale NA, Clarke SH, Cunnion KM и др. (февраль 2017 г.). «Протеин A золотистого стафилококка нарушает иммунитет, опосредованный долгоживущими плазматическими клетками». Журнал иммунологии . 198 (3): 1263–1273. doi :10.4049/jimmunol.1600093. PMC 5266639. PMID 28031339 .
- ^ Verwey WF (апрель 1940 г.). «Тип-специфический антигенный белок, полученный из стафилококка». Журнал экспериментальной медицины . 71 (5): 635–44. doi :10.1084/jem.71.5.635. PMC 2135093. PMID 19870987 .
- ^ Йенсен, К (1958). «Нормально встречающееся антитело стафилококка в сыворотке человека». Acta Pathol. Microbiol. Scand . 44 (4): 421–428. doi :10.1111/j.1699-0463.1958.tb01093.x. PMID 17504410.
- ^ Диксон, Фрэнк Дж. (11 августа 1982 г.). ДОСТИЖЕНИЯ В ИММУНОЛОГИИ . Academic Press. стр. 158. ISBN 9780120224333.
- ^ Löfkvist T, Sjöquist J (ноябрь 1962 г.). «Химический и серологический анализ антигенных препаратов из золотистого стафилококка». Acta Pathologica et Microbiologica Scandinavica . 56 (3): 295–304. doi :10.1111/j.1699-0463.1962.tb04908.x.
- ^ Гров А., Миклестад Б., Оединг П. (1964). «Иммунохимические исследования антигенных препаратов из золотистого стафилококка. 1. Выделение и химическая характеристика антигена А». Acta Pathologica et Microbiologica Scandinavica . 61 (4): 588–96. doi :10.1111/apm.1964.61.4.588. PMID 14185494.
- ^ Deisenhofer J (апрель 1981 г.). «Кристаллографическое уточнение и атомные модели фрагмента Fc человека и его комплекса с фрагментом B белка A из Staphylococcus aureus при разрешении 2,9 и 2,8 А». Биохимия . 20 (9): 2361–70. doi :10.1021/bi00512a001. PMID 7236608.
- ^ Сассо Э.Х., Сильверман Г.Дж., Манник М. (сентябрь 1991 г.). «Человеческие IgA и IgG F(ab')2, которые связываются со стафилококковым белком А, принадлежат к подгруппе VHIII». Журнал иммунологии . 147 (6): 1877–83. doi : 10.4049/jimmunol.147.6.1877 . PMID 1909733. S2CID 35812099.
- ^ Аффинная хроматография (PDF) . Том 1: Антитела (ред. AF). GE Healthcare. 2016. стр. 48.
- ^ "Швейцарский армейский нож патогена". Маленькие вещи, рассмотренные . Получено 25-08-2016 .
- ^ Muthukrishnan G, Quinn GA, Lamers RP, Diaz C, Cole AL, Chen S, Cole AM (апрель 2011 г.). «Экзопротеом золотистого стафилококка выявляет предполагаемые детерминанты назального носительства». Journal of Proteome Research . 10 (4): 2064–78. doi :10.1021/pr200029r. PMC 3070068. PMID 21338050 .
- ^ Goodyear CS, Silverman GJ (май 2003 г.). «Смерть от суперантигена В-клеток: in vivo направленная на VH апоптотическая надклональная делеция В-клеток стафилококковым токсином». Журнал экспериментальной медицины . 197 (9): 1125–39. doi :10.1084/jem.20020552. PMC 2193973. PMID 12719481.
- ^ Kosugi A, JP, Yajima K, JP (18 ноября 2014 г.), Патент США: 8889389 - Процесс получения белка, подобного белку А, с использованием бактерии рода Brevibacillus , получено 26 августа 2016 г.
- ^ "usp31nf26s1_c130". www.uspbpep.com . Общие главы: КАЧЕСТВЕННЫЕ АТРИБУТЫ БЕЛКА А . Получено 26.08.2016 .
- ^ Hober S (12 июня 2012 г.), Патент США: 8198404 - Мутированный иммуноглобулин-связывающий белок , получено 26 августа 2016 г.
- ^ Schlichthaerle T, Ganji M, Auer A, Kimbu Wade O, Jungmann R (апрель 2019 г.). «Бактериально полученные связыватели антител как небольшие адаптеры для ДНК-PAINT микроскопии». ChemBioChem . 20 (8): 1032–1038. doi :10.1002/cbic.201800743. hdl : 21.11116/0000-0003-E68E-A . PMID 30589198. S2CID 58547594.
- ^ Hjelm H, Hjelm K, Sjöquist J (ноябрь 1972 г.). «Белок A из Staphylococcus aureus. Его выделение методом аффинной хроматографии и его использование в качестве иммуносорбента для выделения иммуноглобулинов». FEBS Letters . 28 (1): 73–6. doi : 10.1016/0014-5793(72)80680-X . PMID 4630462. S2CID 8733702.
- ^ Скварил, Ф. (1976-10-01). «Вопрос специфичности связывания подклассов человеческого IgG с протеином А-сефарозой». Иммунохимия . 13 (10): 871–872. doi :10.1016/0019-2791(76)90188-9. PMID 12109.
- ^ Shukla AA, Hubbard B, Tressel T, Guhan S, Low D (март 2007 г.). «Последующая обработка моноклональных антител — применение платформенных подходов». Журнал хроматографии. B, Аналитические технологии в биомедицинских и биологических науках . Производство, очистка, анализ процессов и продуктов поликлональных и моноклональных антител. 848 (1): 28–39. doi :10.1016/j.jchromb.2006.09.026. PMID 17046339.
- ^ Liu HF, Ma J, Winter C, Bayer R (2010-09-01). «Разработка процесса восстановления и очистки для производства моноклональных антител». mAbs . 2 (5): 480–99. doi :10.4161/mabs.2.5.12645. PMC 2958570 . PMID 20647768.