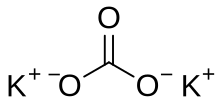
карбонат калия
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК карбонат калия | |
| Другие имена Карбонат калия, дикарбонат калия, субкарбонат калия, жемчужная зола, поташ, соль винного камня, соль полыни. | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ЧЭБИ | |
| ChemSpider | |
| Информационная карта ECHA | 100.008.665 |
| Номер E | E501(i) (регуляторы кислотности, ...) |
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| К 2КО 3 | |
| Молярная масса | 138,205 г/моль |
| Появление | Белое, гигроскопичное твердое вещество |
| Плотность | 2,43 г/см 3 |
| Температура плавления | 891 °C (1,636 °F; 1,164 K) |
| Точка кипения | Разлагается |
| 110,3 г/100 мл (20 °С) 149,2 г/100 мл (100 °С) | |
| Растворимость | |
| Кислотность ( pK a ) | 10.25 |
| −59,0·10 −6 см 3 /моль | |
| Термохимия [1] | |
Теплоемкость ( С ) | 114,4 Дж·моль −1 ·К −1 |
Стандартная молярная энтропия ( S ⦵ 298 ) | 155,5 Дж·моль −1 ·К −1 |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −1151,0 кДж·моль −1 |
Свободная энергия Гиббса (Δ f G ⦵ ) | −1063,5 кДж·моль −1 |
Энтальпия плавления (Δ f H ⦵ fus ) | 27,6 кДж·моль −1 |
| Опасности | |
| Маркировка СГС : | |
 | |
| Предупреждение | |
| Н302 , Н315 , Н319 , Н335 | |
| П261 , П305+П351+П338 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (ЛД, ЛК): | |
LD 50 ( средняя доза ) | 1870 мг/кг (перорально, крыса) [2] |
| Паспорт безопасности (SDS) | МКХС 1588 |
| Родственные соединения | |
Другие анионы | Бикарбонат калия |
Другие катионы | Карбонат лития Карбонат натрия Карбонат рубидия Карбонат цезия |
Родственные соединения | карбонат аммония |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Карбонат калия — неорганическое соединение с формулой K2CO3 . Это белая соль , которая растворяется в воде и образует сильнощелочной раствор. Она расплывается , часто выглядит как влажное или мокрое твердое вещество . Карбонат калия в основном используется в производстве мыла и стекла . [ 3] Обычно его можно найти в результате утечки щелочных батареек . [4]
История
Карбонат калия является основным компонентом поташа и более очищенной жемчужной золы или солей винного камня. Исторически жемчужная зола создавалась путем обжига поташа в печи для удаления примесей. Оставшийся мелкий белый порошок был жемчужной золой. Первый патент , выданный Патентным ведомством США, был выдан Сэмюэлю Хопкинсу в 1790 году за усовершенствованный метод изготовления поташа и жемчужной золы. [5]
В конце 18 века в Северной Америке , до изобретения разрыхлителя , жемчужный пепел использовался в качестве разрыхлителя для быстрого приготовления хлеба . [6] [7]
Производство
Современное коммерческое производство карбоната калия осуществляется путем реакции гидроксида калия с диоксидом углерода : [3]
- 2 КОН + СО 2 → К 2 СО 3 + Н 2 О
Из раствора кристаллизуется сесквигидрат K2CO3 · 3 ⁄ 2 H2O («гидрат калия»). Нагревание этого твердого вещества выше 200 °C (392 °F) дает безводную соль. В альтернативном методе хлорид калия обрабатывают диоксидом углерода в присутствии органического амина , чтобы получить бикарбонат калия , который затем прокаливают :
- 2 KHCO 3 → K 2 CO 3 + H 2 O + CO 2
Приложения
- (исторически) для производства мыла , стекла и посуды
- как мягкий осушающий агент , где другие осушающие агенты, такие как хлорид кальция и сульфат магния , могут быть несовместимы. Он не подходит для кислотных соединений , но может быть полезен для сушки органической фазы, если в ней есть небольшое количество кислотных примесей. Его также можно использовать для сушки некоторых кетонов , спиртов и аминов перед перегонкой. [8]
- в кулинарии , где он имеет множество традиционных применений. Он используется в некоторых видах китайской лапши и лунных пряниках , а также в азиатском травяном желе и японском рамене . В немецких рецептах имбирных пряников карбонат калия часто используется в качестве разрыхлителя, хотя и в сочетании с роговым зерном .
- при алкализации какао -порошка для производства шоколада по голландской технологии путем балансировки pH (т. е. снижения кислотности) натуральных какао-бобов ; это также усиливает аромат . Процесс добавления карбоната калия в какао-порошок обычно называется «Dutching» (а продукты называются какао-порошком, обработанным по голландской технологии), так как этот процесс был впервые разработан в 1828 году голландцем Конрадом Йоханнесом ван Хаутеном .
- как буферный агент при производстве медовухи или вина .
- В старинных документах сообщается, что его использовали для смягчения жесткой воды . [9]
- в качестве огнетушащего вещества при тушении фритюрниц и различных других пожаров класса B.
- при тушении пожаров конденсированным аэрозолем , хотя и в качестве побочного продукта нитрата калия .
- в качестве ингредиента в сварочных флюсах и в флюсовом покрытии электродов для дуговой сварки .
- в качестве ингредиента корма для животных для удовлетворения потребностей в калии сельскохозяйственных животных, таких как цыплята-бройлеры .
- как регулятор кислотности в шведском нюхательном табаке снюс
Ссылки
- ^ CRC handbook ofchemistry and physics: a ready-reference book of chemical and physical data . Уильям М. Хейнс, Дэвид Р. Лид, Томас Дж. Бруно (2016-2017, 97-е изд.). Бока-Ратон, Флорида. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: location missing publisher (link) CS1 maint: others (link) - ^ Чемберс, Майкл. "ChemIDplus - 584-08-7 - BWHMMNNQKKPAPP-UHFFFAOYSA-L - Карбонат калия [USP] - Поиск похожих структур, синонимы, формулы, ссылки на ресурсы и другая химическая информация". chem.sis.nlm.nih.gov . Архивировано из оригинала 2014-08-12.
- ^ аб Х. Шульц; Г. Бауэр; Э. Шахль; Ф. Хагедорн; П. Шмиттингер (2005). «Соединения калия». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a22_039. ISBN 3-527-30673-0.
- ↑ Лист, Дженни (19 октября 2022 г.). «Протекающие ячейки убивают вашу технику. Что происходит?». Hackaday . Архивировано из оригинала 30 мая 2023 г.
- ^ "Вехи в патентовании в США". www.uspto.gov . Получено 04.08.2023 .
- ↑ См. ссылки на «жемчужный пепел» в «Американской кулинарии» Амелии Симмонс, напечатанной издательством Hudson & Goodwin, Хартфорд, 1796 г.
- ^ Чивителло, Линда (2017). Войны за разрыхлитель: беспощадная борьба за еду, которая произвела революцию в кулинарии . Урбана, Иллинойс: University of Illinois Press. С. 18–22. ISBN 978-0-252-04108-2.
- ^ Леонард, Дж.; Лиго, Б.; Проктер, Г. «Продвинутая практическая органическая химия» 1998, Stanley Thomas Publishers Ltd.
- ↑ Чайлд, Лидия М. «Американская бережливая домохозяйка» 1832 г.
Библиография
- Научный словарь , Oxford University Press , Нью-Йорк , 2004
- Ю. Платонов, Эндрю; Евдокимов, Андрей; Курзин, Александр; Д. Майорова, Елена (29 июня 2002 г.). «Растворимость карбоната калия и гидрокарбоната калия в метаноле». Journal of Chemical & Engineering Data . 47 (5): 1175–1176. doi :10.1021/je020012v.
Внешние ссылки
- Международная карта химической безопасности 1588



