Гексафторид плутония
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК фторид плутония(VI) | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ChemSpider | |||
CID PubChem |
| ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| Характеристики | |||
| ПуФ 6 | |||
| Появление | Темно-красные, непрозрачные кристаллы | ||
| Плотность | 5,08 г·см −3 | ||
| Температура плавления | 52 °C (126 °F; 325 К) | ||
| Точка кипения | 62 °C (144 °F; 335 К) | ||
| Структура | |||
| Орторомбическая , oP28 | |||
| ПНМА, № 62 | |||
| октаэдрический ( О h ) | |||
| 0 Д | |||
| Родственные соединения | |||
Родственные фторплутонии | Трифторид плутония | ||
| Опасности | |||
| Маркировка СГС : | |||
    | |||
| Опасность | |||
| NFPA 704 (огненный алмаз) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Гексафторид плутония является высшим фторидом плутония и представляет интерес для лазерного обогащения плутония, в частности для получения чистого плутония-239 из облученного урана. Этот изотоп плутония необходим для предотвращения преждевременного воспламенения маломассивных конструкций ядерного оружия нейтронами, образующимися при спонтанном делении плутония-240 .
Подготовка
Гексафторид плутония получают путем фторирования тетрафторида плутония (PuF 4 ) мощными фторирующими агентами, такими как элементарный фтор. [2] [3] [4] [5]
- ПуФ
4+ Ф
2→ ПуФ
6
Эта реакция эндотермическая . Продукт образуется относительно быстро при температуре 750 °C, и высокие выходы могут быть получены путем быстрой конденсации продукта и выведения его из равновесия. [5]
Его также можно получить путем фторирования фторида плутония(III) , оксида плутония(IV) или оксалата плутония(IV) при температуре около 700 °C: [4] [6]
- 2 ПФ
3 + 3 Ф
2 → 2 ПФ
6 - PuO
2 + 3 Ф
2 → ПуФ
6 + О
2 - Pu ( C2O4 ) 2 + 3F
2 → ПуФ
6 + 4 СО
2
Альтернативно, фторид плутония(IV) окисляется в атмосфере кислорода при температуре 800°C до гексафторида плутония и оксида плутония(IV) : [7]
- 3 ПФ
4 + О
2 → 2 ПФ
6 + PuO
2
В 1984 году синтез гексафторида плутония при температурах, близких к комнатной, был осуществлен с использованием диоксидифторида . [8] [9] Фтористого водорода недостаточно [10] : 42 , хотя он является мощным фторирующим агентом. Синтезы при комнатной температуре также возможны с использованием дифторида криптона [11] или облучения УФ-светом. [12]
Характеристики
Физические свойства
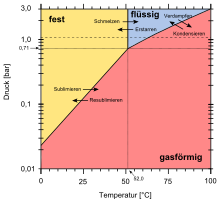
Гексафторид плутония — это красно-коричневое летучее твердое вещество, [1] [4] кристаллизующееся в орторомбической кристаллической системе с пространственной группой Pnma и параметрами решетки a = 995 пм , b = 902 пм и c = 526 пм . [13] Он сублимируется при температуре около 60 °C с теплотой 12,1 ккал/моль в газ октаэдрических молекул [2] с длинами связей плутоний-фтор 197,1 пм. [14] При высоком давлении газ конденсируется с тройной точкой при 51,58 °C и 710 гПа (530 Торр); теплота испарения составляет 7,4 ккал/моль. [13] При температурах ниже -180 °C гексафторид плутония бесцветен. [4]
Гексафторид плутония является парамагнитным веществом с молярной магнитной восприимчивостью 0,173 мм 3 /моль. [15]
Спектроскопические свойства
Гексафторид плутония допускает шесть различных колебательных мод: моды растяжения v 1 , v 2 и v 3 и вращательные моды v 4 , v 5 и v 6 . [16] [ 17 ] PuF
6 Спектр Рамана не может быть обнаружен, поскольку облучение при 564,1 нм вызывает фотохимическое разложение. [18] Облучение при 532 нм вызывает флуоресценцию при 1900 нм и 4800 нм; облучение при 1064 нм вызывает флуоресценцию около 2300 нм. [19] [20]
| Колебание | ν 1 | ν 2 | ν3 | ν 4 | ν 5 | ν 6 |
| Символ | А 1г | Например | Ф 1у | Ф 1у | Ф 2г | Ф 2у |
| Длина волны (см −1 ) | 628 | 523 | 615 | 203 | 211 | 171 |
| ИК-подсветка активна? | − | − | + | + | − | − |
| Рамановская активность? | + | + | − | − | + | − |
Химические свойства
Гексафторид плутония относительно сложен в обращении, он очень едкий, ядовитый и склонен к ауторадиолизу . [ 22] [23] [24]
Реакции с другими соединениями
PuF 6 стабилен в сухом воздухе, но бурно реагирует с водой, включая атмосферную влагу, образуя оксифторид плутония (VI) и плавиковую кислоту. [3] [25]
- ПуФ
6+ 2 ч.
2O → PuO
2Ф
2+ 4 ВЧ
Его можно хранить в течение длительного времени в кварцевой или пирексовой ампуле , при условии отсутствия следов влаги, тщательной дегазации стекла и удаления из соединения любых следов фтористого водорода. [26]
Важной реакцией с участием PuF 6 является восстановление до диоксида плутония . Окись углерода, образующаяся из пламени кислород-метан, может выполнять восстановление. [27]
Реакции разложения
Гексафторид плутония обычно распадается на тетрафторид плутония и газообразный фтор. Термическое разложение не происходит при комнатной температуре, [28] [29], но происходит очень быстро при 280 °C. [5] [26] При отсутствии какой-либо внешней причины разложения поток альфа-частиц от распада плутония будет генерировать авторадиолиз со скоростью 1,5%/день ( период полураспада 1,5 месяца) в твердой фазе. [5] [23] [30] Хранение в газовой фазе при давлениях 50–100 торр (70–130 мбар), по-видимому, минимизирует авторадиолиз, и длительная рекомбинация с освобожденным фтором действительно происходит. [31] [ ненадежный источник? ]
Аналогично, соединение является фоточувствительным , разлагаясь (возможно, на пентафторид плутония и фтор ) под действием лазерного облучения с длиной волны менее 520 нм. [32]
Воздействие лазерного излучения с длиной волны 564,1 нм или гамма-лучей также вызовет быстрое растворение. [18] [24]
Использует
Гексафторид плутония играет роль в обогащении плутония, в частности, для изоляции делящегося изотопа 239 Pu из облученного урана. Для использования в ядерном оружии присутствующий 241 Pu должен быть удален по двум причинам:
- В результате спонтанного деления образуется достаточное количество нейтронов, чтобы вызвать неконтролируемую реакцию.
- Он подвергается бета-распаду с образованием 241Am , что приводит к накоплению америция в течение длительного периода хранения, который необходимо удалять.
Разделение между плутонием и содержащимся америцием происходит посредством реакции с дифторидом диоксида кислорода . Выдержанный PuF 4 фторируется при комнатной температуре до газообразного PuF 6 , который отделяется и восстанавливается обратно до PuF 4 , тогда как любой присутствующий AmF 4 не подвергается такому же превращению. Таким образом, продукт содержит очень малое количество америция, который концентрируется в непрореагировавшем твердом веществе. [33]
Разделение гексафторидов урана и плутония также важно при переработке ядерных отходов . [34] [35] [36] Из расплавленной солевой смеси, содержащей оба элемента, уран может быть в значительной степени удален путем фторирования до UF6 , который стабилен при более высоких температурах, при этом лишь небольшое количество плутония выделяется в виде PuF6 . [ 10]
История
Вскоре после открытия и выделения плутония в 1940 году химики начали постулировать существование гексафторида плутония. Ранние эксперименты, которые пытались имитировать методы создания гексафторида урана , дали противоречивые результаты; и окончательное доказательство появилось только в 1942 году . [37] Вторая мировая война затем прервала публикацию дальнейших исследований. [22]
Первоначальные эксперименты, проведенные с чрезвычайно малыми количествами плутония, показали, что летучее соединение плутония будет образовываться в потоке фтористого газа только при температурах, превышающих 700 °C. Последующие эксперименты показали, что плутоний на медной пластине улетучивается в потоке фтора при температуре 500 °C, и что скорость реакции уменьшается с атомным номером в ряду уран > нептуний > плутоний. [38] Браун и Хилл, используя образцы плутония миллиграммового масштаба, завершили в 1942 году эксперимент по дистилляции с гексафторидом урана, предположив, что высшие фториды плутония должны быть нестабильными и разлагаться до тетрафторида плутония при комнатной температуре . Тем не менее, давление паров соединения, по-видимому, соответствовало давлению паров гексафторида урана. [39] Дэвидсон, Кац и Орлеманн показали в 1943 году, что плутоний в никелевом сосуде испаряется в атмосфере фтора, и что продукт реакции осаждается на поверхности платины . [40]
Фишер, Васлоу и Тевебо предположили, что высшие фториды демонстрируют положительную энтальпию образования , что их образование будет эндотермическим и, следовательно, стабилизируется только при высоких температурах. [41]
В 1944 году Алан Э. Флорин приготовил летучее соединение плутония, которое, как полагают, было неуловимым гексафторидом плутония, но продукт разложился до идентификации. Жидкое вещество собиралось на охлажденном стекле и превращалось в жидкость , но затем атомы фторида реагировали со стеклом. [42]
Сравнивая соединения урана и плутония, Брюэр, Бромли, Жиль и Лёфгрен вычислили термодинамические характеристики гексафторида плутония. [43]
В 1950 году усилия Флорина наконец привели к синтезу, [3] [44] а вскоре последовали улучшенные термодинамические данные и новый аппарат для его производства. [2] Примерно в то же время британские рабочие также разработали метод производства PuF 6 . [4] [7]
Ссылки
- ^ ab Lide, David R. (2009). Справочник по химии и физике (90-е изд.). Бока-Ратон, Флорида: CRC Press. стр. 4–81. ISBN 978-1-4200-9084-0.(webelements.com)
- ^ abc Флорин, Алан Э.; Танненбаум, Ирвинг Р.; Лемонс, Джо Ф. (1956). «Приготовление и свойства гексафторида плутония и идентификация оксифторида плутония (VI)». Журнал неорганической и ядерной химии . 2 ( 5– 6): 368– 379. doi :10.1016/0022-1902(56)80091-2. Первоначально опубликовано как
- Флорин, Алан Э. (15 мая 1953 г.). Термодинамические свойства гексафторида плутония: предварительный отчет (PDF) (Технический отчет). Научная лаборатория Лос-Аламоса . LAMS-1587.
- Танненбаум, И.Р.; Флорин, Алан Э. (15 мая 1953 г.). Усовершенствованная установка для производства гексафторида плутония (PDF) (Технический отчет). Лос-Аламосская научная лаборатория . ЛА-1580.
- ^ abc Флорин, Алан Э. (9 ноября 1950 г.). Гексафторид плутония: Второй отчет о получении и свойствах (PDF) (Технический отчет). Лос-Аламосская научная лаборатория . LAMS-1168.
- ^ abcde Мандлеберг, CJ; Рэй, Гонконг; Херст, Р.; Лонг, Г.; Дэвис, Д.; Фрэнсис, Кентукки (1956). «Гексафторид плутония». Журнал неорганической и ядерной химии . 2 ( 5–6 ): 358–367 . doi :10.1016/0022-1902(56)80090-0. Первоначально опубликовано как
- Мандлберг, К. Дж.; Рэй, Х. К.; Херст, Р.; Лонг, Г.; Дэвис, Д.; Фрэнсис, К. Э. (апрель 1953 г.). Гексафторид плутония: получение и некоторые физические свойства (технический отчет). Том I. Исследовательский центр атомной энергии . C/R-1172.
- Hurst, R.; Mandleberg, C. J.; Rae, H. K.; Davis, D.; Francis, K. E. (январь 1953 г.). Гексафторид плутония: получение и некоторые физические свойства (технический отчет). Том II. Исследовательский центр атомной энергии . C/R-1312.
- ^ abcd Вайншток, Бернард; Мальм, Джон Г. (июль 1956 г.). «Свойства гексафторида плутония». Журнал неорганической и ядерной химии . 2 ( 5– 6): 380– 394. doi :10.1016/0022-1902(56)80092-4.
- ^ Доусон, Дж. К.; Трасвелл, А. Э. (22 февраля 1951 г.). Приготовление трифторида и тетрафторида плутония с использованием фтористого водорода (технический отчет). Исследовательский центр атомной энергии . C/R-662.
- ^ ab Mandleberg, CJ; et al. (1952). (Технический отчет). Исследовательский центр атомной энергии . C/R-157.
{{cite tech report}}: Отсутствует или пусто|title=( помощь ) - ^ Malm, JG; Eller, PG; Asprey, LB (1984). «Низкотемпературный синтез гексафторида плутония с использованием диоксидифторида». Журнал Американского химического общества . 106 (9): 2726– 2727. doi :10.1021/ja00321a056.
- ^ Ерилов, ЧП; Титов В.В.; Серик, В.Ф.; Соколов, В. Б. (2002). «Низкотемпературный синтез гексафторида плутония». Атомная энергия . 92 (1): 57–63 . doi :10.1023/A:1015106730457. S2CID 96612181.
- ^ ab Оценка альтернатив Министерства энергетики США по удалению и утилизации фторидных солей в эксперименте с реакторами на расплавленной соли. Вашингтон, округ Колумбия: National Academies Press. 1997. doi : 10.17226/5538. ISBN 978-0-309-05684-7– через NAP.edu.
- ^ Эспри, Л. Б.; Эллер, П. Г.; Кинкед, Скотт А. (1986). «Формирование гексафторидов актинидов при комнатной температуре с дифторидом криптона». Неорганическая химия . 25 (5): 670– 672. doi :10.1021/ic00225a016. ISSN 0020-1669.
- ^ Trevorrow, LE; Gerding, TJ; Steindler, MJ (1969). «Ультрафиолетово-активированный синтез гексафторида плутония при комнатной температуре». Inorganic and Nuclear Chemistry Letters . 5 (10): 837– 839. doi :10.1016/0020-1650(69)80068-1.
- ^ ab Gmelins Handbuch der anorganischen Chemie [ Справочник Гмелина по неорганической химии ]. 71 ( Transurane [Трансуран]) (на немецком языке). Том. С. стр. 108–114 .
- ^ Кимура, Масао; Шомакер, Вернер; Смит, Дарвин В.; Вайншток, Бернард (май 1968). «Исследование гексафторидов вольфрама, осмия, иридия, урана, нептуния и плутония методом электронной дифракции». Журнал химической физики . 48 (9): 4001– 4012. Bibcode : 1968JChPh..48.4001K. doi : 10.1063/1.1669727. ISSN 0021-9606.
- ^ Gruen, DM; Malm, JG; Weinstock, B. (апрель 1956 г.). «Магнитная восприимчивость гексафторида плутония». Журнал химической физики . 24 (4): 905–906 . Bibcode : 1956JChPh..24..905G. doi : 10.1063/1.1742635. ISSN 0021-9606.
- ^ Steindler, Martin J.; Gunther, William H. (август 1964). «Спектр поглощения гексафторида плутония». Spectrochimica Acta . 20 (8): 1319– 1322. Bibcode : 1964AcSpe..20.1319S. doi : 10.1016/0371-1951(64)80159-4.
- ^ Walters, RT; Briesmeister, RA (январь 1984). «Спектр поглощения гексафторида плутония в спектральной области 3000–9000 Å». Spectrochimica Acta Часть A: Молекулярная спектроскопия . 40 (7): 587– 589. Bibcode :1984AcSpA..40..587W. doi :10.1016/0584-8539(84)80108-7.
- ^ ab Hawkins, N. J.; Mattraw, H. C.; Sabol, W. W. (24 мая 1954 г.). Инфракрасный спектр и термодинамические свойства PuF 6 (технический отчет). Лаборатория атомной энергетики Knolls . KAPL-1007.
- ^ Beitz, James V.; Williams, Clayton W.; Carnall, WT (март 1982). «Флуоресцентные исследования паров гексафторида нептуния и плутония». Журнал химической физики . 76 (5): 2756– 2757. Bibcode : 1982JChPh..76.2756B. doi : 10.1063/1.443223. ISSN 0021-9606.
- ^ Beitz, James V.; Williams, Clayton W.; Carnall, W. T. (19 мая 1983 г.). "11. Фотофизика и фотохимия газа гексафторида плутония". В Carnall, William T.; Choppin, Gregory R. (ред.). Химия плутония. Серия симпозиумов ACS. Том 216. Вашингтон, округ Колумбия: Американское химическое общество . стр. 155–172 . doi :10.1021/bk-1983-0216.ch011. ISBN 978-0-8412-0772-1.
- ^
- Weinstock, B.; Weaver, EE; Malm, JG (сентябрь 1959 г.). "Давление паров NpF6 и PuF6; термодинамические расчеты с UF6, NpF6 и PuF6". Журнал неорганической и ядерной химии . 11 (2): 104– 114. doi :10.1016/0022-1902(59)80054-3.
- Ким, К. К.; Малфорд, Р. Н. (июнь 1990 г.). «Вибрационные свойства молекул гексафторида актинида (U, Np, Pu, Am)». Журнал молекулярной структуры: THEOCHEM . 207 ( 3–4 ): 293–299 . doi :10.1016/0166-1280(90)85031-H.
- Hawkins, NJ; Mattraw, HC; Sabol, WW (ноябрь 1955 г.). «Инфракрасный спектр гексафторида плутония». Журнал химической физики . 23 (11): 2191– 2192. Bibcode : 1955JChPh..23.2191H. doi : 10.1063/1.1740699. ISSN 0021-9606.
- Malm, John G.; Weinstock, Bernard; Claassen, Howard H. (ноябрь 1955 г.). «Инфракрасные спектры NpF 6 и PuF 6». Журнал химической физики . 23 (11): 2192– 2193. Bibcode : 1955JChPh..23.2192M. doi : 10.1063/1.1740700. ISSN 0021-9606.
- ^ ab Steindler, Martin J. (1 августа 1963 г.). Лабораторные исследования в поддержку процессов летучести фторида в псевдоожиженном слое (технический отчет). Том II: Свойства гексафторида плутония. Аргоннская национальная лаборатория. doi : 10.2172/4170539. ANL-6753.
- ^ ab Bibler, Ned E. (23 августа 1979 г.). «α- и β-радиолиз паров гексафторида плутония». J. Phys. Chem. 83 (17): 2179– 2186. doi :10.1021/j100480a001.
- ^ ab Steindler, MJ; Steidl, DV; Fischer, J. (ноябрь 1964 г.). «Разложение гексафторида плутония гамма-излучением». Журнал неорганической и ядерной химии . 26 (11): 1869– 1878. doi :10.1016/0022-1902(64)80011-7.
- ^ Kessie, RW (1967). «Кинетика гидролиза гексафторида плутония и урана». Industrial & Engineering Chemistry Process Design and Development . 6 (1): 105– 111. doi :10.1021/i260021a018. ISSN 0196-4305.
- ^ ab Malm, John G.; Weinstock, Bernard; Weaver, E. Eugene (1958). «Получение и свойства NpF5; сравнение с PuF5». Журнал физической химии . 62 (12): 1506– 1508. doi :10.1021/j150570a009. ISSN 0022-3654.
- ^ Покидышев, AM; Царенко, IA; Серик, VF; Соколов, VB (октябрь 2003 г.). «Восстановление гексафторида плутония с использованием газообразных реагентов». Атомная энергия . 95 (4): 701– 708. doi :10.1023/B:ATEN.0000010988.94533.24. ISSN 1063-4258. S2CID 93145477.
- ^ Trevorrow, LE; Shinn, WA; Steunenberg, RK (март 1961). «Термическое разложение гексафторида плутония». Журнал физической химии . 65 (3): 398– 403. doi :10.1021/j100821a003. ISSN 0022-3654.
- ^ Фишер, Дж.; Треворроу, Л.; Шинн, В. (октябрь 1961 г.). «Кинетика и механизм термического разложения гексафторида плутония». Журнал физической химии . 65 (10): 1843– 1846. doi :10.1021/j100827a036. ISSN 0022-3654.
- ^
- Штейндлер 1963
- Вагнер, Р. П.; Шинн, В. А.; Фишер, Дж.; Стейндлер, Мартин Дж. (1 мая 1963 г.). Лабораторные исследования в поддержку процессов летучести фторида в псевдоожиженном слое (технический отчет). Том VII: Разложение газообразного гексафторида плутония альфа-излучением. Аргоннская национальная лаборатория. doi : 10.2172/4628896. ANL-7013.
- ^ Морзе, Л. Р. (2005), «Давление газа PuF 6 в старых цилиндрах» (личное сообщение Д. Л. Кларку), Лос-Аламос, Нью-Мексико.
- ^ US 4670239, Sherman W. Rabideau & George M. Campbell, "Photochemical Preparation of Plutonium Pentafluoride", опубликовано 2 июня 1987 г., присвоено Соединенным Штатам Америки, но см. также Lobikov, EA; Prusakov, VN; Serik, VF (август–сентябрь 1992 г.). "Plutonium Hexafluoride Decomposition under the Action of Laser Radiation". Journal of Fluorine Chemistry . 58 ( 2– 3): 277. doi :10.1016/S0022-1139(00)80734-4,в котором продукт распада идентифицируется как тетрафторид .
- ^ Миллс, ТР; Риз, Л.В. (1994). «Разделение плутония и америция низкотемпературным фторированием». Журнал сплавов и соединений . 213–214 : 360–362 . doi :10.1016/0925-8388(94)90931-8.
- ^
- US 3708568A, Gilliher, W.; Harris, R. & Ledoux, R., «Удаление плутония из смесей гексафторида плутония и гексафторида урана», опубликовано 02.01.1973, передано Комиссии по атомной энергии
- US 4172114A, Мицухиро Нисимура и др ., «Метод очистки гексафторида плутония», опубликовано 23 октября 1979 г., передано Японскому институту исследований атомной энергии
- ^ Moser, W.Scott; Navratil, James D. (1984). «Обзор основных пирохимических технологий плутония». Journal of the Less Common Metals . 100 : 171– 187. doi :10.1016/0022-5088(84)90062-6. OSTI 6168468.
- ^ Дробышевский, Ю. В.; Ежов В.К.; Лобиков Е.А.; Прусаков В.Н.; Серик, В.Ф.; Соколов В.Б. (2002). «Применение физических методов восстановления гексафторида плутония». Атомная энергия . 93 (1): 578–588 . doi :10.1023/A:1020840716387. S2CID 100100314.
- ^ Сиборг, Г. Т. (1942). (Технический отчет). Металлургическая лаборатория Чикагского университета . CN-125.
{{cite tech report}}: Отсутствует или пусто|title=( помощь ) - ^ Браун, Х. С.; Хилл, О. Ф.; Джаффей, А. Х. (1942). (Технический отчет). Металлургическая лаборатория Чикагского университета . CN-343.
{{cite tech report}}: Отсутствует или пусто|title=( помощь ) - ↑ Браун, Х. С.; Хилл, О. Ф. (12 ноября 1942 г.). (Технический отчет). Металлургическая лаборатория Чикагского университета . CN-363.
{{cite tech report}}: Отсутствует или пусто|title=( помощь ) - ^ Дэвидсон, Н. Р.; Кац, Дж. Дж.; Орлеманн, О. Ф. (11 октября 1943 г.). (Технический отчет). Металлургическая лаборатория Чикагского университета . CN-987.
{{cite tech report}}: Отсутствует или пусто|title=( помощь ) - ↑ Фишер, Р. У.; Васлоу, Ф.; Тевебо, А. Д. (10 августа 1944 г.). (Технический отчет). Колледж штата Айова . CN-1783.
{{cite tech report}}: Отсутствует или пусто|title=( помощь ) - ^ Флорин, Алан Э. (1 октября 1944 г.). (Технический отчет). Металлургическая лаборатория Чикагского университета . CN-2159.
{{cite tech report}}: Отсутствует или пусто|title=( помощь ) - ^
- Брюэр, Л.; Бромли, Л.; Жиль, П. В.; Лофгрен, Н. Л. (10 октября 1945 г.). (Технический отчет). Радиационная лаборатория Калифорнийского университета . CN-3300.
{{cite tech report}}: Отсутствует или пусто|title=( помощь ) - Брюэр, Л.; Бромли, Л.; Жиль, П. В.; Лофгрен, Н. Л. (1 декабря 1945 г.). (Технический отчет). Радиационная лаборатория Калифорнийского университета . CN-3378.
{{cite tech report}}: Отсутствует или пусто|title=( помощь ) - Брюэр, Л.; Бромли, Л.; Жиль, П. В.; Лофгрен, Н. Л. (20 марта 1950 г.). Высшие фториды плутония (технический отчет). Радиационная лаборатория Калифорнийского университета . UCRL-633.
- Брюэр, Л.; Бромли, Л.; Жиль, П. В.; Лофгрен, Н. Л. (10 октября 1945 г.). (Технический отчет). Радиационная лаборатория Калифорнийского университета . CN-3300.
- ^ Флорин, Алан Э. (16 октября 1950 г.). Гексафторид плутония, оксифторид плутония (VI): приготовление, идентификация и некоторые свойства (PDF) (технический отчет). Научная лаборатория Лос-Аламоса . LAMS-1118.