Фосфетан
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Фосфетан | |
| Идентификаторы | |
| |
Панель инструментов CompTox ( EPA ) |
|
| Характеристики | |
| С 3 Н 7 П | |
| Молярная масса | 74,063 г·моль −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Фосфетан [1] представляет собой 4-членный фосфорорганический гетероцикл . Исходная молекула фосфетана, имеющая формулу C3H7P , на один атом больше фосфиранов , на один меньше фосфолов и является аналогом азетидинов с тяжелым атомом. Первый известный синтез фосфетана был описан в 1957 году Косолаповым и Штруком [2] , но этот метод был неэффективным и трудно воспроизводимым, выходы редко превышали 1%. Гораздо более эффективный метод был описан в 1962 году Макбрайдом [3], чей метод позволил провести первые исследования физических и химических свойств фосфетанов. Фосфетаны — это хорошо изученный класс молекул, которые нашли широкое применение в качестве химических строительных блоков, реагентов для органического/неорганического синтеза и лигандов в координационной химии.
Синтез
С 1957 года было разработано много методов синтеза фосфетанов. Ниже приведены наиболее используемые из них.
Метод МакБрайда (Электрофильное присоединение к олефинам)
Метод, первоначально описанный МакБрайдом, был разработан для отдельных алкенов , а также диенов. Оба типа следуют одному и тому же общему механизму: образование катиона фосфения из дихлорфосфина и трихлорида алюминия, электрофильное присоединение алкена к фосфению, перегруппировка карбокатиона , внутримолекулярное нуклеофильное присоединение нового алкилфосфина к карбокатиону и окисление полученного фосфетания водой для получения оксида фосфетана . Ограничениями этого подхода являются непредсказуемая перегруппировка карбокатиона в более сложно разветвленных алканах, несовместимость карбокатионов со многими нуклеофильными функциональными группами и риск гашения катиона путями элиминирования . [3]
Моно-еновое присоединение
В случае электрофильного присоединения одним алкеном [3] [4] перегруппировка карбокатиона происходит через гидридные или алкильные сдвиги. Общая схема синтеза фосфетана из моноенов приведена ниже:

Присоединение диена
В случае электрофильного присоединения диена [ 5 ] [6] сначала происходит перегруппировка карбокатиона через катион-π циклизацию. Общая схема синтеза фосфетана из диенов приведена ниже:

Алкилирование и внутримолекулярная циклизация
Разработаны пути алкилирования и циклизации как для фосфинов, так и для фосфиноксидов.
Из фосфинов
Синтез фосфетанов из алкилирования P(III) и последующей циклизации обычно протекает через последовательное замещение фосфанида /фосфина 1,3- алкилдигалогенидов или сульфонатных эфиров (OTf, OTs, OMs и т. д.). [7] [8] [9] [10] Источником фосфанида обычно является литиевая соль, но его также можно получить путем депротонирования фосфинов in situ. Механизм S N 2 , связанный с этим преобразованием, имеет преимущество стереоспецифичности , но за счет толерантности к электрофильной или эпимеризуемой функциональной группе и кинетически медленной реакционной способности с вторичными/третичными уходящими группами. Общий механизм показан ниже:

Из оксидов фосфина
Похожие синтезы из соединений P(V) известны, но встречаются гораздо реже из-за их относительной неэффективности и непредсказуемости. [2] Этот препарат характеризуется образованием in situ реагента Гриньяра , за которым следует внутримолекулярное присоединение/циклизация к фосфиноксиду, все на н-пропиловой основе. Этот метод использовали Косолапов и Штрук в первом синтезе фосфетана. Общий механизм показан ниже:

Расширение циклопропанового кольца
Другой способ получения фосфетанов происходит из расширения кольца циклопропанов , в котором, по-видимому, фосфин напрямую вставляется в связь CC. [11] [12] Истинный механизм этого превращения похож на механизм синтеза МакБрайда и иногда классифицируется как таковой, с аналогичными преимуществами и недостатками. Хотя снятие напряжения циклопропанового кольца оказывает большую помощь в начальной связи CP, часто требуется исчерпывающее алкильное замещение для стабилизации образованного карбокатиона. Общий механизм показан ниже:

[2+2] циклоприсоединение
Последний метод, который, как было отмечено, позволяет получать фосфетаны, — это [2+2] -циклоприсоединение фосфаалкенов и олефинов. Этот метод нечасто обсуждается из-за его тенденции к получению фосфетанов , а скорее из-за его понимания реакционной способности гораздо более неуловимых фосфаалкенов. Трудный синтез этих фосфаалкенов серьезно ограничивает полезность метода в том, что касается синтеза фосфетанов, несмотря на его привлекательный стереоспецифический и модульный подход. Обычно это включает связанный с кислотой Льюиса фосфор и может происходить с богатыми электронами фосфаалкенами и бедными электронами олефинами [13] или наоборот. [14] Пример каждого из них и механизм приведены ниже:

Структура и связь
Экспериментальные и кристаллографические данные существуют для многих типов фосфетана, перечисленных ниже, однако вся геометрическая и электронная ( HOMO и LUMO ) информация ниже была определена теоретически с функционалом B3LYP [15] [16] [17] [18] и базисным набором DEF2-SVP [19] с использованием ORCA (5.0.3) [20] для родительской молекулы при каждом координационном числе, чтобы обеспечить общую и последовательную тенденцию в качестве введения в предмет. Геометрии и орбитальные графики были получены с использованием Авогадро (4.1). [21]
Двухкоординированные фосфетаны
Хотя редко, если вообще о них сообщалось в литературе, дикоординированные фосфетаны фосфениевых, фосфанидных и фосфорных радикальных архетипов теоретически возможны как переходные реактивные промежуточные соединения. Их оптимизированные физические и электронные геометрии представлены в основном как средство сравнения с более часто наблюдаемыми три-, тетра- и пентакоординированными фосфетанами.
Ион фосфения
Случай фосфения изоэлектронен циклическому карбену . Оптимизированная геометрия является довольно плоской по сравнению с другими двухкоординированными случаями, причем ее HOMO и LUMO являются экзоциклической неподеленной парой и пустой p-орбиталью соответственно.
- Оптимизированная геометрия
- ГОМО
- ЛЮМО
Фосфорный радикал
Оптимизированная геометрия и граничные молекулярные орбитали для радикала дикоординированного фосфора аналогичны случаю фосфения. Кольцо немного менее плоское, а HOMO теперь является однократно занятой p-орбиталью. Неподеленная пара — HOMO-1.
- Оптимизированная геометрия
- ГОМО
- ЛЮМО
Ион фосфанида
Случай фосфанида изоэлектронен циклическим эфирам . В этом ионе значительно больше складок внутри фосфетанового кольца, а также расширен угол CPC, но HOMO и HOMO-1 аналогичны радикальному случаю, теперь обе заняты дважды.
- Оптимизированная геометрия
- ГОМО
- ЛЮМО
Трехкоординированные фосфетаны
Трехкоординированные фосфетаны хорошо известны в литературе и являются примером классического тригонально-пирамидального фосфорного центра P(III). Конформационная изомерия представлена в этих трехкоординированных молекулах, хотя и с очень низким кинетическим барьером (~2,45 ккал/моль для данного примера), [22] , в которых водород может быть псевдоаксиальным (как показано) или псевдоэкваториальным. Псевдоаксиальный конформер является более стабильным из двух. Поскольку неподеленная пара больше, она располагается в псевдоэкваториальном положении, но это довольно быстро инвертируется из-за минимизации стерического столкновения, когда R становится больше H. Фосфетановое кольцо сморщенное, а не плоское, из-за асимметрии выше и ниже кольца относительно фосфора. Как и ожидалось, HOMO является нуклеофильной неподеленной парой, обычно связанной с фосфинами.
- Оптимизированная геометрия
- ГОМО
- ЛЮМО
Тетракоординированные фосфетаны
Тетракоординированные фосфетаны на сегодняшний день являются наиболее часто наблюдаемой геометрией вокруг фосфорного центра, обычно в виде повсеместного центра оксида фосфора P(V), но нередко в виде ионов фосфетания.
Ион фосфата
Фосфетаний изоэлектронен тетракоординированному углероду и принимает его тетраэдрическую геометрию, значительно уплощая кольцо за счет увеличения молекулярной симметрии. Отклонение от этого произойдет при любой замене одного из атомов водорода на более объемную группу, после чего кольцо сморщится, с более крупным заместителем, псевдоэкваториальным. Кислотность α -углеродных водородов значительно увеличивается из-за движущей силы нейтрализации заряда; это отражается в CH σ-антисвязывающих вкладах в LUMO.
- Оптимизированная геометрия
- ГОМО
- ЛЮМО
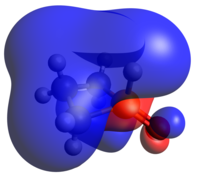
Оксид фосфетана
Другое классическое фосфорное соединение — тетраэдрический фосфиноксид P(V). Подобно трехкоординированным фосфетанам, фосфетанные оксиды также демонстрируют изомерию, на этот раз с гораздо большим кинетическим барьером. Когда оксид псевдоэкваториальный (как показано), обозначение — транс , в то время как когда оксид псевдоаксиальный, соединение — цис . Предпочтение одного над другим в значительной степени основано на замещении среднего углерода, а не на оксиде. [23] Как и можно ожидать от ковалентно связанного оксида, HOMO представляет собой неподеленную пару кислорода, а LUMO в значительной степени обусловлено взаимодействием PO π-антисвязывания.
- Оптимизированная геометрия
- ГОМО
- ЛЮМО
Пентакоординированные фосфетаны
Пентакоординированные фосфетаны, или фосфораны, представляют собой альтернативную геометрическую мантию, на которой может существовать фосфорный центр P(V). Важно отметить, что этот класс фосфоранов обычно не тригонально-бипирамидальный, а ближе к квадратно-пирамидальному. Результатом этого геометрического возмущения является возникновение σ-антисвязывания PH, которое заметно представлено в LUMO, что объясняет характерную кислотность Льюиса квадратно-пирамидальных фосфоранов.
- Оптимизированная геометрия
- ГОМО
- ЛЮМО
Гексакоординированные фосфетаны
Гексакоординированные, анионные фосфаты в основном известны в литературе как противоионы ( гексафторфосфат ), но теоретически возможны как реактивные промежуточные продукты для ассоциативных механизмов в фосфорных центрах. В этом соединении фосфор принимает ожидаемую октаэдрическую геометрию. Как и ожидалось для этого гексакоординированного фосфата, CH σ-связывающие орбитали включают HOMO, что объясняет ожидаемую гидрированность из-за благоприятной нейтрализации заряда. Подобно случаю дикоординированных, эти оптимизированные физические и электронные геометрии представлены в основном как средство сравнения с более часто наблюдаемыми три-, тетра- и пентакоординированными фосфетанами.
- Оптимизированная геометрия
- ГОМО
- ЛЮМО
Реактивность
Фошетаны демонстрируют широкий спектр реакционной способности и появляются в литературе во многих различных аспектах химической реакции . Существуют случаи, когда сами фосфетаны являются интересующим субстратом, случаи, когда фосфетаны наблюдаются как переходные промежуточные продукты во время химической реакции, случаи, когда фосфетаны используются в качестве активных реагентов в химических реакциях, и случаи, когда фосфетаны лигируются с металлом, который является активным реагентом в данном процессе. Все эти общие сценарии более подробно обсуждаются ниже.
Собственная реактивность
Большая часть реакционной способности, присущей фосфетановым субстратам или выполняемой непосредственно на них, является одой его кольцевой деформации, которая, как рассчитано, составляет ~17,9 ккал/моль. [22] Высвобождение части или всей этой энергии деформации приводит к двум характерным типам наблюдаемой реакционной способности: расширению кольца и раскрытию кольца. Реакционная способность в фосфорном центре, включая восстановление, окисление и образование фосфорана, а также алкилирование кольцевых углеродов, может быть выполнена без расщепления кольца в некоторых случаях, представляя собой конечные типы присущей реакционной способности. Эти четыре будут более подробно рассмотрены ниже.
Реакции раскрытия кольца
Реакции раскрытия фосфетанового кольца представляли синтетический интерес в прошлом как потенциальный метод создания полипропиленфосфиновых полимеров и материалов, но, несмотря на происходящие реакции раскрытия кольца, полимеризация такого материала наблюдалась лишь изредка в очень концентрированных растворах. [8] [24]

Основное наблюдение за раскрытием кольца заключается в том, что оно является побочным продуктом других предполагаемых реакций, таких как окисление фосфетания [25] [26] и функционализация α-углерода. [27]

Один преднамеренный и конструктивный метод раскрытия кольца был описан в литературе и включает фосфетанилид , который подвергается реакции Виттига с альдегидами с образованием γ-ненасыщенных фосфиноксидов. [28]

Реакции расширения кольца
Существуют методы расширения кольца для вставки атомов углерода, кислорода и азота в фосфетановые кольца для получения соответствующих фосфолов, но они имеют ограниченную синтетическую полезность из-за их непредсказуемой стерео- и региоселективности в отношении несимметричных фосфетанов. Вставка углерода (иногда известная как перегруппировка Аллена-Миллара-Триппета ) обычно включает добавление воды к фосфетанию, имеющему уходящую группу [25] или пи-систему [29] [25] (обычно еноны , но также и фенильные группы) альфа к фосфору, который высвобождается в результате миграции алкила после распада фосфетанового оксида.

Введение кислорода в связь PC оксида фосфетана осуществляется с помощью mCPBA и протекает по неизвестному в настоящее время механизму с необычно высокой региоселективностью для менее замещенного углерода. [30] [31]

Вставка атома азота происходит в результате фотолиза оксида азидофосфетана, предположительно, из перегруппировки типа Курциуса из полученного нитрена . Хотя это и предложенный механизм, существуют явные сомнения относительно промежуточного соединения N=P=O. [32] [33]

Реакционная способность по фосфору
Окислительно-восстановительные реакции между фосфетанами P(III) и оксидами фосфетана P(V) возможны и хорошо документированы при использовании мягких реагентов, таких как кислород или вода и гидриды кремния, для достижения окисления и восстановления соответственно.

Более интересным является синтез стабильных 5-координированных фосфетанов ( фосфоранов ) из традиционных фосфинов P(III) и фосфиноксидов P(V), в дополнение к ионам фосфетания P(V), с помощью пары общих методов. Что касается фосфиновых субстратов, синтез фосфорана обычно происходит посредством реакции с пероксидами / дисульфидами [34] [35] [36] или перфторированными π-системами, такими как перфторированный ацетон, [37] для которого механизм не решен, или перфторированный 1,3-бутадиен. [38]

Методы доступа к фосфоранам из оксидов P(V) и фосфетаний обычно осуществляются через ступенчатые пути дезоксигенации - нуклеофильного присоединения [39] или пути прямого присоединения [28] соответственно. Нуклеофилы обычно представляют собой галогениды или алкоксифункциональные группы, а в случае дезоксигенации-замещения два нуклеофила могут быть либо связанными (например, катехол ), либо нет.

α-углеродная функционализация
Последняя часть присущей фосфетанам реакционной способности, которую следует обсудить, — это функционализация альфа-углеродов фосфетанооксида, почти всегда посредством депротонирования литийорганическими реагентами, с последующим замещением S N 2 алкилгалогенида. [40] Использование хиральных аксилляров на фосфоре может сделать этот процесс стереоселективным. [41] [42]

Реактивные промежуточные продукты
Появление фосфетанов и их производных хорошо документировано в литературе по органической химии как реакционноспособных промежуточных продуктов для множества различных процессов. Эти процессы включают, но не ограничиваются, химией Виттига , Хорнера-Уодсворта-Эммонса , Кори-Фукса и Сейферта-Гилберта . Все эти процессы включают образование in-situ и разложение промежуточных продуктов оксафосфетана через пути типа метатезиса с образованием алкенов или алкинов из альдегидов и фосфорного реагента.
Реагенты и катализаторы
С начала 2010-х годов был достигнут значительный прогресс в разработке фосфетанов как полезных реагентов и катализаторов для дополнения катализаторов переходных металлов в органическом синтезе. Эти усилия в первую очередь были предприняты исследовательской группой доктора Александра Радосевича [43] [44] [45] [46] [47] [48] в Университете штата Пенсильвания , а затем Массачусетским технологическим институтом , но вклад лаборатории доктора Томаса Вернера [49] [50] в Институте катализа Лейбница также был значительным. Общей темой, лежащей в основе этих работ, является активное фосфетанное соединение, восстановительно действующее на субстрат, что приводит к образованию оксида фосфетана и желаемого продукта, за которым следует восстановление оксида фосфетана обратно в фосфетан мягким гидридом кремния, который замыкает каталитический цикл.

Нехарактерная бифильная природа этих фосфинов и других нетригональных пниктогенных соединений является результатом нарушения молекулярной симметрии [51] , в данном случае налагаемого кольцевым напряжением, присущим фоспетанам. Большинство этих превращений исследуются на основе стехиометрической реакционной способности фосфетана, иллюстрируя их полезность в качестве катализаторов или реагентов в случае несовместимости субстрата с гидридом. Ниже приведен общий каталитический цикл и сокращенный список реакций, которые можно катализировать с помощью этого метода.

Лиганды для комплексов переходных металлов
Комплексы переходных металлов с лигированными фосфетанами P(III) известны для вольфрама, [52] железа, [53] [54] [13] молибдена, [55] [8] платины, [24] рутения, [56] [57] родия, [58] [57] [59] палладия, [42] [56] [60] иридия, [42] и, возможно, больше, для получения ахиральных , рацемических и оптически чистых координационных комплексов. Несмотря на эти усилия, сложные детали об их природе как лигандов и воздействии на металлические центры, поскольку они отклоняются от традиционных фосфинов, относительно недостаточно изучены. Прямое сравнение классических комплексов бис-триалкилфосфиндихлорплатины(II) с соответствующим комплексом, содержащим фосфетан, возможно, указывает на ослабленный σ- транс-эффект и π-акцепторный характер фосфетанового лиганда, скорее всего, из-за вышеупомянутого искажения симметрии, подтверждаемого короткими связями Pt-P (2,208 и 2,210 ангстрем) и Pt-Cl (2,342 и 2,355 ангстрем). [24] Для того, чтобы сделать это утверждение категорическим, необходимо провести больше исследований.
Большая часть исследований и интереса к фосфетанам как лигандам заключается в их способности придавать энантиоселективность определенным каталитическим реакциям гидрирования , [61] восстановления, [60] и π-аллилирования [62] при использовании соответствующих хиральных фосфетанов. Как и в случае большинства асимметричных катализов, неблагоприятные стерические взаимодействия между хиральными лигандами, субстратом и другими реагентами приписываются наблюдаемой энантио- или диастереоселективности, хотя, по-видимому, использование более традиционных хиральных фосфинов оказалось более популярным, чем использование хиральных фосфетанов. Ниже приведены избранные примеры энантиоселективного катализа с использованием фосфетановых лигандов.

Ссылки
- ^ Маринетти, Анджела; Кармайкл, Дункан (2002-01-01). «Синтез и свойства фосфетанов». Chemical Reviews . 102 (1): 201– 230. doi :10.1021/cr990135r. ISSN 0009-2665. PMID 11782133.
- ^ ab Kosolapoff, Gennady M.; Struck, Robert F. (1957-01-01). "736. Константы диссоциации некоторых циклических фосфиновых кислот". Journal of the Chemical Society (Resumed) : 3739– 3740. doi :10.1039/JR9570003739. ISSN 0368-1769.
- ^ abc Jungermann, Eric; McBride, JJ; Clutter, R.; Mais, Ago (февраль 1962 г.). «Новая реакция фосфорилирования олефинов. I. Область применения реакции». Журнал органической химии . 27 (2): 606– 610. doi :10.1021/jo01049a063. ISSN 0022-3263.
- ^ Вилкас, Эрна; Вилкас, Мишель; Жонио, Дениз; Паскар-Билли, Клодин (1978-01-01). "1-Изопропил-4,6-диметил-6-фосфа(V)бицикло[3.1.1]гепт-3-ен 6-оксид: искаженный фосфетан, синтезированный из α-пинена и комплекса метилфосфонового дихлорида с хлоридом алюминия; рентгеновский кристалл и молекулярная структура". Журнал химического общества, Chemical Communications (3): 125– 126. doi :10.1039/C39780000125. ISSN 0022-4936.
- ^ Weissman, Steven A.; Baxter, SG; Arif, Atta M.; Cowley, Alan H. (1986-01-01). «Реакция галогенофосфениевого иона с циклоокта-1,5-диеном; прямой синтез и рентгеновская кристаллическая структура фосфетанового фрагмента». Журнал химического общества, Chemical Communications (14): 1081– 1082. doi :10.1039/C39860001081. ISSN 0022-4936.
- ^ Коули, Алан Х.; Стюарт, Константин А.; Уиттлси, Брюс Р.; Райт, Томас К. (1984-01-01). «Синтез гетероцикла фосфора с использованием ионов фосфения и 1,4-диенов». Tetrahedron Letters . 25 (8): 815– 816. doi :10.1016/S0040-4039(01)80034-4. ISSN 0040-4039.
- ^ Берглунд, Донна; Мик, Девон В. (январь 1968). «Координация положительно заряженным фосфорным лигандом». Журнал Американского химического общества . 90 (2): 518– 519. doi :10.1021/ja01004a071. ISSN 0002-7863.
- ^ abc Hockless, David CR; Kang, Yew Beng; McDonald, Mark A.; Pabel, Michael; Willis, Anthony C.; Wild, S. Bruce (1996-02-20). "Прямые синтезы 1-фенилфосфетана и 1-фенилфосфирана. Кристаллические и молекулярные структуры нейтральных и катионных комплексов-предшественников циклотримеризации". Organometallics . 15 (4): 1301– 1306. doi :10.1021/om9507336. ISSN 0276-7333.
- ^ Маринетти, Анджела; Крюгер, Вирджиния; Бузин, Франсуа-Ксавье (28 апреля 1997 г.). «Синтез хиральных фосфетанов». Буквы тетраэдра . 38 (17): 2947–2950 . doi :10.1016/S0040-4039(97)00508-X. ISSN 0040-4039.
- ^ Имамото, Цунео; Охаши, Ацуши; Мацукава, Сатору (2000). «Улучшенный синтез 1-адамантилфосфина и его использование в синтезе циклических фосфинов, содержащих 1-адамантильную группу». Гетероциклы . 52 (2): 905. doi : 10.3987/COM-99-S58 . ISSN 0385-5414.
- ^ Вайсман, Стивен А.; Бакстер, С.Г. (1988-01-01). «Внедрение электрофильного фосфора в циклопропаны; новый синтез фосфатанов». Tetrahedron Letters . 29 (11): 1219– 1222. doi :10.1016/S0040-4039(00)80260-9. ISSN 0040-4039.
- ^ Вайсман, Стивен А.; Бакстер, С.Г. (1987-01-01). «Циклическое присоединение ионов фосфения к норборнадиену и квадрициклану». Tetrahedron Letters . 28 (6): 603– 606. doi :10.1016/S0040-4039(00)95791-5. ISSN 0040-4039.
- ^ ab Вебер, Лотар; Шеффер, Маттиас Х.; Бекманн, Айке; Штаммлер, Ханс-Георг; Нойманн, Беате (1997-06-01). "Ацилфосфаны и фосфаалкены, замещенные переходными металлами. 32. 1 Превращение единицы FePC фосфаалкена в фрагмент FeP CNNC путем расширения цепи через вставку 1,3-диполя ( - NN(Ar)CH + ) сиднонов". Металлоорганические соединения . 16 (13): 2958– 2962. doi :10.1021/om9700876. ISSN 0276-7333.
- ^ Маринетти, Анджела; Матей, Франсуа (1990-01-01). "[2 + 2] Циклоприсоединения между электронно-бедными фосфа-алкеновыми комплексами и электронно-богатыми алкенами или алкинами, новый путь к фосфетановым и 1,2-дигидрофосфетовым кольцам". Журнал химического общества, Chemical Communications (2): 153– 154. doi :10.1039/C39900000153. ISSN 0022-4936.
- ^ Бекке, Аксель Д. (1993-04-01). «Термохимия с функционалом плотности. III. Роль точного обмена». Журнал химической физики . 98 (7): 5648– 5652. Bibcode : 1993JChPh..98.5648B. doi : 10.1063/1.464913 . ISSN 0021-9606. S2CID 52389061.
- ^ Ли, Ченгте; Янг, Вэйтао; Парр, Роберт Г. (1988-01-15). «Развитие формулы корреляции-энергии Колле-Сальветти в функционал электронной плотности». Physical Review B. 37 ( 2): 785– 789. Bibcode : 1988PhRvB..37..785L. doi : 10.1103/PhysRevB.37.785. PMID 9944570.
- ^ Воско, С. Х.; Вилк, Л.; Нусаир, М. (1980-08-01). «Точные спин-зависимые энергии корреляции электронной жидкости для вычислений локальной спиновой плотности: критический анализ». Canadian Journal of Physics . 58 (8): 1200– 1211. Bibcode :1980CaJPh..58.1200V. doi : 10.1139/p80-159 . ISSN 0008-4204. S2CID 122287164.
- ^ Stephens, PJ; Devlin, FJ; Chabalowski, CF; Frisch, MJ (ноябрь 1994 г.). «Ab Initio расчет спектров вибрационного поглощения и кругового дихроизма с использованием силовых полей функциональной плотности». Журнал физической химии . 98 (45): 11623– 11627. doi :10.1021/j100096a001. ISSN 0022-3654. S2CID 97035345.
- ^ Weigend, Florian; Ahlrichs, Reinhart (2005-08-30). "Сбалансированные базисные наборы расщепленной валентности, тройной дзета-валентности и четверной дзета-валентности качества для H в Rn: Разработка и оценка точности". Physical Chemistry Chemical Physics . 7 (18): 3297– 3305. Bibcode :2005PCCP....7.3297W. doi :10.1039/B508541A. ISSN 1463-9084. PMID 16240044.
- ^ Neese, Frank (январь 2012 г.). «Программная система ORCA». WIREs Computational Molecular Science . 2 (1): 73– 78. doi :10.1002/wcms.81. ISSN 1759-0876. S2CID 62137389.
- ^ Ханвелл, Маркус Д.; Кертис, Дональд Э.; Лони, Дэвид К.; Вандермеерш, Тим; Зурек, Ева; Хатчисон, Джеффри Р. (13 августа 2012 г.). «Avogadro: передовой семантический химический редактор, платформа визуализации и анализа». Журнал химинформатики . 4 (1): 17. doi : 10.1186/1758-2946-4-17 . ISSN 1758-2946. PMC 3542060. PMID 22889332 .
- ^ ab Bachrach, Steven M. (ноябрь 1989 г.). «Теоретические исследования фосфирана и фосфетана». Журнал физической химии . 93 (23): 7780– 7784. doi :10.1021/j100360a011. ISSN 0022-3654.
- ^ Campbell, JA; Caughlan, CN; Fitzgerald, A.; Campana, C.; Cremer, SE (1984-11-15). "Структура 1-трет-бутил-2,2,3,4,4-пентаметилфосфетан 1-оксида, C12H25OP". Acta Crystallographica Раздел C: Crystal Structure Communications . 40 (11): 1918– 1920. Bibcode : 1984AcCrC..40.1918C. doi : 10.1107/S0108270184010052. ISSN 0108-2701.
- ^ abc Tumas, William; Huang, Jean C.; Fanwick, Phillip E.; Kubiak, Clifford P. (август 1992 г.). «Синтез и реакционная способность циклических фосфетанов. Олигомеризация, кватернизация и комплексообразование с платиной (II)». Organometallics . 11 (8): 2944– 2947. doi :10.1021/om00044a042. ISSN 0276-7333.
- ^ abc Corfield, JR; Harger, MJP; Shutt, JR; Trippett, S. (1970-01-01). «Дальнейшие открытия и расширения колец фосфетанов». Журнал химического общества C: Organic (13): 1855– 1860. doi :10.1039/J39700001855. ISSN 0022-4952.
- ^ Ezzell, BR (июль 1970). «Щелочное расщепление оксидов фосфетана». Журнал органической химии . 35 (7): 2426– 2428. doi :10.1021/jo00832a079. ISSN 0022-3263.
- ^ Cremer, Sheldon E.; Cowles, John M.; Farr, Frank R.; Hwang, Hai Ok; Kremer, Paul W.; Peterson, Andrew C.; Gray, George A. (январь 1992 г.). «Подготовка, реакции и стереохимия 4-метил-4-фосфаттрацикло[3.3.0.02,8.03,6]октана 4-оксида и производных». Журнал органической химии . 57 (2): 511– 522. doi :10.1021/jo00028a022. ISSN 0022-3263.
- ^ Аб Брауэр, Дэвид Дж.; Чикку, Антонелла Дж.; Хесслер, Гисберт; Штельцер, Отмар (сентябрь 1992 г.). «Neue Synthesen und Reaktionen von Phosphetaniumsalzen mit planarem Gerüst». Химише Берихте . 125 (9): 1987–1997 . doi :10.1002/cber.19921250904. ISSN 0009-2940.
- ^ Хоуз, В.; Триппетт, С. (1969-01-01). «Некоторые реакции замещения фосфора в 2,2,3,4,4-пентаметилфосфетанах». Журнал химического общества C: Organic (11): 1465– 1468. doi :10.1039/J39690001465. ISSN 0022-4952.
- ^ Куин, Луис Д.; Кисалус, Джон К.; Меш, Кит А. (декабрь 1983 г.). «Внедрение кислорода в связи углерод-фосфор некоторых напряженных фосфорных гетероциклов». Журнал органической химии . 48 (24): 4466– 4472. doi :10.1021/jo00172a005. ISSN 0022-3263.
- ^ Шевчик, Ежи; И Эн-Юнь Яо; Куин, Луи Д. (сентябрь 1990 г.). «Синтез оксидов 1,2-оксаффолана путем внедрения кислорода в CP-связь оксидов фосфетана». Фосфор, сера, кремний и родственные им элементы . 54 ( 1–4 ): 135–141 . doi : 10.1080/10426509008042130. ISSN 1042-6507.
- ^ Wiseman, Jeffrey; Westheimer, FH (июнь 1974). «Фотолиз 1-азидо-2,2,3,4,4-пентаметилфосфетан 1-оксида. Мономерный метафосфонимидат». Журнал Американского химического общества . 96 (13): 4262– 4268. doi :10.1021/ja00820a033. ISSN 0002-7863.
- ^ Harger, Martin JP (1974-01-01). "Фотолиз оксидов 1-азидофосфетана: расширение кольца до 2-метокси-1,2-азафосфолидина 2-оксидов и раскрытие кольца до метилалк-илфосфонамидатов в метаноле". Журнал химического общества, Perkin Transactions 1 : 2604–2609 . doi :10.1039/P19740002604. ISSN 1364-5463.
- ^ Денни, Дональд Б.; Денни, Дороти З.; Уайт, Деннис В. (апрель 1971 г.). «Удивительно легкое псевдовращение фосфоранов с четырьмя кольцевыми членами». Журнал Американского химического общества . 93 (8): 2066– 2067. doi :10.1021/ja00737a047. ISSN 0002-7863.
- ^ Денни, DB; Денни, DZ; Холл, CD; Марси, KL (январь 1972). «Подготовка и химия некоторых циклических фосфоранов». Журнал Американского химического общества . 94 (1): 245– 249. doi :10.1021/ja00756a043. ISSN 0002-7863.
- ^ Burros, Byron C.; De'Ath, Norman J.; Denney, Donald B.; Denney, Dorothy Z.; Kipnis, Irving J. (ноябрь 1978 г.). «Подготовка и химия некоторых фосфоранов, содержащих связи фосфор-сера». Журнал Американского химического общества . 100 (23): 7300– 7304. doi :10.1021/ja00491a029. ISSN 0002-7863.
- ^ Oram, Robert K.; Trippett, Stuart (1973-01-01). «Реакции 1-замещенных 2,2,3,4,4-пентаметилфосфетанов с гексафторацетоном и спектры ядерного магнитного резонанса 19F полученных 1,3,2-диоксафосфоланов». Журнал химического общества, Perkin Transactions 1 : 1300– 1310. doi :10.1039/P19730001300. ISSN 1364-5463.
- ^ Денни, ДБ; Денни, ДЗ; Хсу, ЙФ Фосфор, 1974 , 4 , 217.
- ^ Антчак, Стивен; Триппетт, Стюарт (1978-01-01). «Синтез пятивалентных фосфоранов из фосфиноксидов». Журнал химического общества, Perkin Transactions 1 (11): 1326– 1330. doi :10.1039/P19780001326. ISSN 1364-5463.
- ^ Маринетти, Анджела; Рикар, Луи (1993-01-01). «Синтез и характеристика некоторых п-метилфосфетанов, нового класса электронно-богатых хиральных фосфинов». Tetrahedron . 49 (45): 10291– 10304. doi :10.1016/S0040-4020(01)80558-5. ISSN 0040-4020.
- ^ Маринетти, Анджела; Бузен, Франсуа-Ксавье; Рикар, Луи (1997-03-24). «Синтез и α-алкилирование 1-ментилфосфетансульфида». Tetrahedron . 53 (12): 4363– 4370. doi :10.1016/S0040-4020(97)00132-4. ISSN 0040-4020.
- ^ abc Marinetti, Angela; Ricard, Louis (октябрь 1994 г.). «Фосфетаны как хиральные лиганды для каталитических асимметричных реакций: гидросилилирование олефинов». Organometallics . 13 (10): 3956– 3962. doi :10.1021/om00022a035. ISSN 0276-7333.
- ^ Хонг, Сын Юн; Радосевич, Александр Т. (2022-05-25). «Хемоселективное первичное аминирование арилбороновых кислот с помощью P III /PV ═O-катализа: синтетический захват переходного промежуточного промежуточного соединения Нефа HNO». Журнал Американского химического общества . 144 (20): 8902– 8907. doi :10.1021/jacs.2c02922. ISSN 0002-7863. PMC 9133210. PMID 35549268 .
- ^ Ли, Ген; Канда, Юдзуру; Хонг, Сын Юн; Радосевич, Александр Т. (2022-05-11). «Возможность восстановительного кросс-сочетания C–N нитроалканов и бороновых кислот с помощью стерического дизайна катализаторов P(III)/P(V)═O». Журнал Американского химического общества . 144 (18): 8242– 8248. doi :10.1021/jacs.2c01487. ISSN 0002-7863. PMC 9119554. PMID 35499970 .
- ^ Липшульц, Джеффри М.; Радосевич, Александр Т. (2021-09-15). «Объединение синтеза амидов и активации с помощью P III /PV –Catalyzed Serial Condensation: Three-Component Assembly of 2-Amidopyridines». Журнал Американского химического общества . 143 (36): 14487– 14494. doi :10.1021/jacs.1c07608. ISSN 0002-7863. PMC 9088293. PMID 34478308 .
- ^ Ли, Ген; Миллер, Стивен П.; Радосевич, Александр Т. (2021-09-15). "P III /PV ═O-катализируемое межмолекулярное образование связи N–N: кросс-селективное восстановительное сочетание нитроаренов и анилинов". Журнал Американского химического общества . 143 (36): 14464– 14469. doi :10.1021/jacs.1c07272. ISSN 0002-7863. PMC 8454687. PMID 34473484 .
- ^ Ли, Ген; Цинь, Цзыян; Радосевич, Александр Т. (2020-09-23). «P(III)/P(V)-катализируемое метиламинирование арилбороновых кислот и эфиров: восстановительное сочетание C–N с нитрометаном в качестве суррогата метиламина». Журнал Американского химического общества . 142 (38): 16205– 16210. doi :10.1021/jacs.0c08035. ISSN 0002-7863. PMC 7531042. PMID 32886500 .
- ^ Nykaza, Trevor V.; Cooper, Julian C.; Li, Gen; Mahieu, Nolwenn; Ramirez, Antonio; Luzung, Michael R.; Radosevich, Alexander T. (2018-11-14). "Межмолекулярное восстановительное кросс-сочетание C–N нитроаренов и бороновых кислот с помощью катализа P III /PV ═O". Журнал Американского химического общества . 140 (45): 15200– 15205. doi :10.1021/jacs.8b10769. ISSN 0002-7863. PMC 6235741. PMID 30372615 .
- ^ Лонгвиц, Ларс; Вернер, Томас (2020-02-10). «Восстановление активированных алкенов с помощью окислительно-восстановительного циклического катализа P III /PV». Angewandte Chemie International Edition . 59 (7): 2760– 2763. doi :10.1002/anie.201912991. ISSN 1433-7851. PMC 7027467. PMID 31793147 .
- ^ Лонгвиц, Ларс; Шпанненберг, Анке; Вернер, Томас (2019-10-04). «Оксиды фосфетана как катализаторы окислительно-восстановительного цикла в каталитической реакции Виттига при комнатной температуре». ACS Catalysis . 9 (10): 9237– 9244. doi :10.1021/acscatal.9b02456. ISSN 2155-5435. S2CID 202880682.
- ^ Ли, Кёнхун; Блейк, Анастасия В.; Тануши, Акира; Маккарти, Шон М.; Ким, Дэниел; Лория, Сидней М.; Донахью, Кортни М.; Шпильфогель, Кайл Д.; Кит, Джейсон М.; Дейли, Скотт Р.; Радосевич, Александр Т. (2019-05-20). «Проверка бифильной гипотезы нетригональных соединений фосфора(III)». Angewandte Chemie International Edition . 58 (21): 6993– 6998. doi :10.1002/anie.201901779. ISSN 1433-7851. PMC 6513703. PMID 30901511 .
- ^ Rohde, Udo; Ruthe, Frank; Jones, Peter; Streubel, Rainer (18 января 1999 г.). «Формирование и структура первого комплекса 7-аза-1-фосфонорборнадиена». Angewandte Chemie International Edition . 38 ( 1– 2): 215– 217. doi :10.1002/(SICI)1521-3773(19990115)38:1/2<215::AID-ANIE215>3.0.CO;2-Y.
- ^ Бадер, Армин; Патхак, Девендра Д.; Уайлд, С. Брюс; Уиллис, Энтони К. (1992-01-01). "Связь Дальтона. Реакции координированных фосфинов и арсинов. Синтезы 1-фенилфосфетана и 1-фениларсетана с участием железа(II)". Журнал химического общества, Dalton Transactions (10): 1751– 1752. doi :10.1039/DT9920001751. ISSN 1364-5447.
- ^ Bader, Armin; Kang, Yew Beng; Pabel, Michael; Pathak, Devendra D.; Willis, Anthony C.; Wild, S. Bruce (март 1995 г.). "Реакции координированных фосфинов и арсинов. Синтезы с участием железа (II) и прямые синтезы трех-семичленных гетероциклов, содержащих фосфор и мышьяк. Кристаллические структуры комплексов железа (II) с 1-фенилфосфетаном и 1-фениларсетаном". Organometallics . 14 (3): 1434– 1441. doi :10.1021/om00003a051. ISSN 0276-7333.
- ^ Kang, Yew Beng; Pabel, Michael; Willis, Anthony C.; Wild, S. Bruce (1994-01-01). "Прямой синтез 1-фенилфосфетана и 1-фенилфосфирана. Кристаллические и молекулярные структуры комплексов-предшественников циклотримеризации fac-[Mo(CO)3(PhPCH2CH2CH2)3] и fac-[Mo(CO)3(PhPCH2CH2)3]". Журнал химического общества, Chemical Communications (4): 475– 476. doi :10.1039/C39940000475. ISSN 0022-4936.
- ^ аб Маринетти, Анджела; Жюс, Себастьян; Жене, Жан-Пьер; Рикар, Луи (01 января 2000 г.). «Дополнительные данные по синтезу и свойствам хиральных 1,2-бис(фосфетано)бензолов». Тетраэдр . 56 (1): 95–100 . doi :10.1016/S0040-4020(99)00777-2. ISSN 0040-4020.
- ^ ab Marinetti, A. (октябрь 1998 г.). "Несимметричные бидентатные лиганды, несущие хиральные фосфетановые единицы". Синтез . 1998 (10): 1539– 1543. doi :10.1055/s-1998-2169. S2CID 196780633.
- ^ Маринетти, Анджела; Жюс, Себастьен; Лабрю, Фрэнсис; Лемаршан, Од; Жене, Жан-Пьер; Рикар, Луи (2001). «Синтез и характеристика монофосфинов и аминофосфинов, несущих хиральные фосфетановые звенья». Синтез . 2001 (14): 2095–2104 . doi : 10.1055/s-2001-18064.
- ^ Маринетти, Анджела; Ле Менн, Клод; Рикар, Луи (ноябрь 1995 г.). «Моно- и биядерные комплексы родия хирального 1,1-дифосфина. Синтезы и кристаллические структуры». Металлоорганические соединения . 14 (11): 4983– 4985. doi :10.1021/om00011a006. ISSN 0276-7333.
- ^ аб Маринетти, Анджела; Жюс, Себастьен; Жене, Жан-Пьер; Рикар, Луи (1 апреля 2001 г.). «Хиральные 1,2-бис(фосфетано)этаны». Журнал металлоорганической химии . 624 (1): 162–166 . doi :10.1016/S0022-328X(00)00910-4. ISSN 0022-328X.
- ^ Маринетти, Анджела; Жюс, Себастьен; Жене, Жан-Пьер (1999-11-26). «Исследование асимметричного гидрирования, стимулируемого комплексами родия и фосфетана». Tetrahedron Letters . 40 (48): 8365– 8368. doi :10.1016/S0040-4039(99)01767-0. ISSN 0040-4039.
- ^ Маринетти, Анджела; Кругер, Вирджиния; Рикар, Луи (1997-02-15). «Новые хиральные фосфетаны: синтез и использование в катализируемом палладием аллильном алкилировании». Журнал металлоорганической химии . 529 (1): 465– 472. doi :10.1016/S0022-328X(96)06563-1. ISSN 0022-328X.