Фосфат
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Фосфат [1] | |||
| Другие имена Ортофосфат Тетраоксофосфат(V) Тетраоксидофосфат(V) | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| 3903772 | |||
| ЧЭБИ | |||
| ChemSpider | |||
| 1997 | |||
| МеШ | Фосфаты | ||
CID PubChem |
| ||
| УНИИ | |||
| |||
| Характеристики | |||
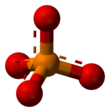
| ПО3− 4 | |||
| Молярная масса | 94,9714 г моль −1 | ||
| Сопряженная кислота | Моногидрофосфат | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
В химии фосфат — это анион , соль , функциональная группа или эфир , полученный из фосфорной кислоты . Чаще всего это ортофосфат , производное ортофосфорной кислоты, также известной как фосфорная кислота H 3 PO 4 .
Ион фосфата или ортофосфата [ PO
4]3−
получается из фосфорной кислоты путем удаления трех протонов H+
. Удаление одного протона дает ион дигидрофосфата [H
2ПО
4]−
в то время как удаление двух протонов дает ион фосфата водорода [HPO
4]2−
. Эти названия также используются для солей этих анионов, таких как дигидрофосфат аммония и тринатрийфосфат .
- [ПО
4]3−
Фосфат или ортофосфат
В органической химии фосфат или ортофосфат — это органофосфат , сложный эфир ортофосфорной кислоты формы PO
4RR′R″ , где один или несколько атомов водорода заменены органическими группами. Примером является триметилфосфат , (CH
3)
3ПО
4. Термин также относится к трехвалентной функциональной группе OP(O-)
3в таких эфирах. Фосфаты могут содержать серу вместо одного или нескольких атомов кислорода ( тиофосфаты и органотиофосфаты ).
Ортофосфаты особенно важны среди различных фосфатов из-за их ключевой роли в биохимии , биогеохимии и экологии , а также их экономической значимости для сельского хозяйства и промышленности. [2] Добавление и удаление фосфатных групп ( фосфорилирование и дефосфорилирование ) являются ключевыми этапами в клеточном метаболизме .
Ортофосфаты могут конденсироваться с образованием пирофосфатов .
Химические свойства
Фосфат-ион имеет молярную массу 94,97 г/моль и состоит из центрального атома фосфора, окруженного четырьмя атомами кислорода в тетраэдрическом расположении. Это сопряженное основание гидрофосфат-иона H(PO
4)2−
, который в свою очередь является сопряженным основанием дигидрофосфат-иона H
2(ПО)
4)−
, которая в свою очередь является сопряженным основанием ортофосфорной кислоты , H
3ПО
4.
Многие фосфаты растворимы в воде при стандартной температуре и давлении . Фосфаты натрия, калия, рубидия , цезия и аммония растворимы в воде. Большинство других фосфатов лишь немного растворимы или нерастворимы в воде. Как правило, гидро- и дигидрофосфаты немного более растворимы, чем соответствующие фосфаты.
Равновесия в растворе

В водном растворе ортофосфорная кислота и три ее производных аниона сосуществуют в соответствии с равновесиями диссоциации и рекомбинации, приведенными ниже [3]
| Равновесие | Константа диссоциации K a [4] | п К а |
|---|---|---|
| Н 3 ПО 4 ⇌ Н 2 ПО−4+ Н + | п К а1 = 2,14 | |
| Н2ПО−4 ⇌ HPO2−4+ Н + | п К а2 = 7,20 | |
| ХПО2−4 ⇌ ПО3−4+ Н + | п К а3 = 12,37 |
Значения приведены при температуре 25 °C и нулевой ионной силе.
Значения p K a представляют собой значения pH , при которых концентрация каждого вида равна концентрации его сопряженных оснований . При pH 1 или ниже фосфорная кислота практически недиссоциирована. При pH около 4,7 (середина между первыми двумя значениями p K a ) ион дигидрофосфата, [H
2ПО
4]−
, является практически единственным присутствующим видом. Около pH 9,8 (середина между вторым и третьим значениями p K a ) моногидрофосфатный ион, [HPO
4]2−
, является единственным присутствующим видом. При pH 13 или выше кислота полностью диссоциирует в виде фосфат-иона (PO
4)3−
.
Это означает, что соли моно- и дифосфат-ионов можно селективно кристаллизовать из водного раствора, устанавливая значение pH либо 4,7, либо 9,8.
В действительности, H
3ПО
4, Н
2(ПО)
4)−
и Н(РО
4)2−
ведут себя как отдельные слабые кислоты , поскольку последовательные p K a различаются более чем на 4.
Фосфат может образовывать множество полимерных ионов , таких как пирофосфат (P
2О
7)4−
, и трифосфат , (P
3О
10)5−
. Различные метафосфатные ионы (которые обычно представляют собой длинные линейные полимеры) имеют эмпирическую формулу (PO
3)−
и встречаются во многих соединениях.
Биохимия фосфатов
В биологических системах фосфор может находиться в виде свободных фосфатных анионов в растворе ( неорганический фосфат ) или быть связанным с органическими молекулами в виде различных органофосфатов .
Неорганический фосфат обычно обозначается Pi и при физиологическом ( гомеостатическом ) pH в основном состоит из смеси [HPO
4]2−
и [Н
2ПО
4]−
ионы. При нейтральном pH, как в цитозоле (pH = 7,0), концентрации ортофосфорной кислоты и ее трех анионов имеют соотношения
Таким образом, только [H
2ПО
4]−
и [HPO
4]2−
ионы присутствуют в цитозоле в значительных количествах (62% [H
2ПО
4]−
, 38% [HPO
4]2−
). Во внеклеточной жидкости (рН = 7,4) эта пропорция обратная (61% [HPO
4]2−
, 39% [Н
2ПО
4]−
).
Неорганический фосфат может также присутствовать в виде пирофосфатных анионов [P
2О
7]4−
, которые дают ортофосфат при гидролизе :
- [П
2О
7]4−
+ Н2О ⇌ 2 [HPO
4]2−
Органические фосфаты обычно встречаются в форме эфиров в виде нуклеотидов (например, AMP , ADP и ATP ), а также в ДНК и РНК . Свободные анионы ортофосфата могут высвобождаться путем гидролиза фосфоангидридных связей в АТФ или АДФ. Эти реакции фосфорилирования и дефосфорилирования являются непосредственным хранилищем и источником энергии для многих метаболических процессов. АТФ и АДФ часто называют высокоэнергетическими фосфатами , как и фосфагены в мышечной ткани. Аналогичные реакции существуют для других нуклеозиддифосфатов и трифосфатов .
Кости и зубы
Важным явлением фосфатов в биологических системах является структурный материал костей и зубов. Эти структуры состоят из кристаллического фосфата кальция в форме гидроксиапатита . Твердая плотная эмаль зубов млекопитающих может содержать фторапатит , гидроксифосфат кальция, в котором некоторые гидроксильные группы заменены ионами фтора .
Использование в медицинских и биологических исследованиях
Фосфаты — это лечебные соли фосфора. Некоторые фосфаты, которые помогают лечить многие инфекции мочевыводящих путей , используются для повышения кислотности мочи. Чтобы избежать образования кальциевых камней в мочевыводящих путях, используются некоторые фосфаты. [5] Для пациентов, которые не могут получать достаточно фосфора в своем ежедневном рационе, фосфаты используются в качестве пищевых добавок, как правило, из-за определенных расстройств или заболеваний. [5] Инъекционные фосфаты могут применяться только квалифицированными медицинскими работниками. [5]
Метаболизм растений
Растения усваивают фосфор несколькими путями: арбускулярно-микоризным путем и путем прямого поглощения.
Неблагоприятные последствия для здоровья
This article needs additional citations for verification. (July 2022) |
Гиперфосфатемия , или высокий уровень фосфатов в крови, связана с повышенной смертностью среди населения в целом. Наиболее распространенной причиной гиперфосфатемии у людей, собак и кошек является почечная недостаточность. В случаях гиперфосфатемии рекомендуется ограничить потребление продуктов, богатых фосфатом, таких как некоторые виды мяса и молочных продуктов, а также продуктов с высоким соотношением фосфата к белку, таких как газированные напитки, фастфуд, обработанные пищевые продукты, приправы и другие продукты, содержащие добавки фосфатной соли. [6]
Фосфаты вызывают кальцификацию сосудов , и было обнаружено, что высокая концентрация фосфатов в крови является предиктором сердечно-сосудистых событий . [7]
Производство
Геологическое явление


Фосфаты являются естественной формой элемента фосфора , который содержится во многих фосфатных минералах . В минералогии и геологии фосфат относится к горной породе или руде, содержащей фосфатные ионы. Неорганические фосфаты добываются для получения фосфора для использования в сельском хозяйстве и промышленности. [2]
Крупнейшим мировым производителем и экспортером фосфатов является Марокко . В Северной Америке крупнейшие месторождения находятся в регионе Боун-Вэлли в центральной Флориде , регионе Сода-Спрингс на юго-востоке Айдахо и на побережье Северной Каролины . Меньшие месторождения находятся в Монтане , Теннесси , Джорджии и Южной Каролине . Небольшое островное государство Науру и его соседний остров Банаба , которые раньше имели огромные месторождения фосфатов самого высокого качества, подвергались чрезмерной добыче. Фосфорит также можно найти в Египте, Израиле, Палестине, Западной Сахаре, на острове Навасса , в Тунисе, Того и Иордании — странах, где есть крупные отрасли по добыче фосфатов.
Фосфоритовые рудники в основном находятся в:
- Северная Америка : США, особенно Флорида, с меньшими месторождениями в Северной Каролине , Айдахо и Теннесси.
- Африка : Марокко , Алжир , Египет , Нигер , Сенегал , Того , Тунис , Мавритания
- Ближний Восток : Саудовская Аравия , Иордания , Израиль , Сирия , Иран и Ирак , в городе Акашат , недалеко от границы с Иорданией.
- Центральная Азия : Казахстан
- Океания : Австралия , Макатея , Науру и остров Банаба .
В 2007 году при нынешних темпах потребления запасы фосфора, по оценкам, иссякнут через 345 лет. [8] Однако некоторые ученые считали, что « пик фосфора » наступит через 30 лет, а Дэна Корделл из Института устойчивого будущего заявила, что «при нынешних темпах запасы будут истощены в течение следующих 50–100 лет». [9] Запасы относятся к количеству, которое, как предполагается, можно извлечь по текущим рыночным ценам. В 2012 году USGS оценила мировые запасы в 71 миллиард тонн, в то время как в 2011 году во всем мире было добыто 0,19 миллиарда тонн. [10] Фосфор составляет 0,1% по массе средней породы [11] (в то время как, для перспективы, его типичная концентрация в растительности составляет от 0,03% до 0,2%), [12] и, следовательно, в земной коре весом 3× 1019 тонн находятся квадриллионы тонн фосфора , [13] хотя и в преимущественно более низкой концентрации, чем месторождения, учитываемые как запасы, которые инвентаризированы и извлекаются дешевле. Если предположить, что фосфатные минералы в фосфатной породе в основном представляют собой гидроксиапатит и фторапатит, фосфатные минералы содержат примерно 18,5% фосфора по весу. Если фосфатная порода содержит около 20% этих минералов, то средняя фосфатная порода содержит примерно 3,7% фосфора по весу.
Некоторые месторождения фосфатных пород, такие как Малберри во Флориде, [14] примечательны включением в них значительных количеств радиоактивных изотопов урана. Это вызывает беспокойство, поскольку радиоактивность может высвобождаться в поверхностные воды [15] при применении полученного фосфатного удобрения .
В декабре 2012 года компания Cominco Resources объявила об обновленных ресурсах своего проекта Hinda в Конго-Браззавиль, соответствующих кодексу JORC , в размере 531 миллиона тонн, что делает его крупнейшим измеренным и предполагаемым месторождением фосфата в мире. [16]
Около 2018 года в Норвегии были обнаружены залежи фосфатов, почти равные по объему всем остальным странам Земли вместе взятым. [17] [18]
В июле 2022 года Китай объявил квоты на экспорт фосфатов. [19]
Крупнейшими импортерами в миллионах метрических тонн фосфата являются Бразилия 3,2, Индия 2,9 и США 1,6. [20]
Добыча полезных ископаемых

На три основные страны-производителя фосфатов (Китай, Марокко и США) приходится около 70% мирового производства.
| Страна | Производство (млн кг) | Доля мирового производства (%) | Запасы (млн кг) |
|---|---|---|---|
| Алжир | 1300 | 0,54 | 2,200,000 |
| Австралия | 2,700 | 1.17 | 1,100,000 |
| Бразилия | 4,700 | 3.00 | 1,600,000 |
| Китай | 95,000 | 44.83 | 3,200,000 |
| Египет | 5000 | 2.47 | 2,800,000 |
| Финляндия | 995 | - | 1,000,000 |
| Индия | 1,480 | 0,49 | 46,000 |
| Ирак | 200 | 0,09 | 430,000 |
| Израиль | 2,810 | 1.48 | 57,000 |
| Иордания | 9,220 | 3.36 | 800,000 |
| Казахстан | 1500 | 0,72 | 260,000 |
| Мексика | 558 | 0,76 | 30,000 |
| Марокко и Западная Сахара | 35,500 | 13.45 | 50,000,000 |
| Перу | 4000 | 1.79 | 210,000 |
| Россия | 13,100 | 5.60 | 600,000 |
| Саудовская Аравия | 6500 | 1.48 | 1,400,000 |
| Сенегал | 3,420 | 0,45 | 50,000 |
| ЮАР | 2,100 | 0,99 | 1,400,000 |
| Сирия | 2000 | 0,34 | 1,800,000 |
| Того | 800 | 0,45 | 30,000 |
| Тунис | 4,110 | 1.79 | 100,000 |
| Узбекистан | 900 | - | 100,000 |
| Соединенные Штаты | 23,300 | 12.37 | 1,000,000 |
| Вьетнам | 4,650 | 1.21 | 30,000 |
| Другие страны | 1,140 | 1.17 | 840,000 |
| Общий | 227,000 | 100 | 71,000,000 |
Экология


С экологической точки зрения, из-за своей важной роли в биологических системах, фосфат является весьма востребованным ресурсом. После использования он часто становится ограничивающим питательным веществом в окружающей среде , и его доступность может определять скорость роста организмов. Это, как правило, верно для пресноводной среды, тогда как азот чаще является ограничивающим питательным веществом в морской (морской) среде. Добавление высоких уровней фосфата в окружающую среду и микросреду, в которой он обычно редок, может иметь значительные экологические последствия. Например, может произойти цветение популяций некоторых организмов за счет других и крах популяций, лишенных таких ресурсов, как кислород (см. эвтрофикация ). В контексте загрязнения фосфаты являются одним из компонентов общего количества растворенных твердых веществ , основного показателя качества воды, но не весь фосфор находится в молекулярной форме, которую водоросли могут расщеплять и потреблять. [22]
Осадки гидроксиапатита кальция и кальцита можно обнаружить вокруг бактерий в верхнем слое аллювиальной почвы. [23] Поскольку глинистые минералы способствуют биоминерализации, присутствие бактерий и глинистых минералов привело к образованию осадков гидроксиапатита кальция и кальцита. [23]
Фосфатные месторождения могут содержать значительное количество встречающихся в природе тяжелых металлов. Горнодобывающие работы по переработке фосфатной породы могут оставлять отвалы , содержащие повышенные уровни кадмия , свинца , никеля , меди , хрома и урана . Если не управлять ими осторожно, эти отходы могут выщелачивать тяжелые металлы в грунтовые воды или близлежащие эстуарии. Поглощение этих веществ растениями и морской жизнью может привести к концентрации токсичных тяжелых металлов в пищевых продуктах. [24]
Смотрите также
- Диаммонийфосфат - ( NH4 ) 2HPO4
- Динатрийфосфат – Na2HPO4
- Удобрение
- Гипофосфит – Н
2(ПО)
2)− - Метафосфат – (PO
3)
н - Мононатрийфосфат – NaH2PO4
- Фосфорорганические соединения
- Бассейн Улед-Абдун
- Фосфат – OP(OR) 3 , такой как трифенилфосфат
- Фосфатное конверсионное покрытие
- Фосфатная сода , газированный напиток
- Фосфинат – OP(OR)R 2
- Фосфин – PR 3
- Оксид фосфина – OPR 3
- Фосфинит – P(OR)R 2
- Фосфит – P(OR) 3
- Фосфогипс
- Фосфонат – OP(OR) 2 R
- Фосфонит – P(OR) 2 R
- Фосфорилирование
- Полифосфат – (HPO
3)
н - Пирофосфат – (P
2О
7)4− - Триполифосфат натрия – Na 5 P 3 O 10
Ссылки
- ^ "Фосфаты – PubChem Public Chemical Database". Проект PubChem . США: Национальный центр биотехнологической информации.
- ^ ab "Phosphate Primer". Florida Industrial and Phosphate Research Institute . Florida Polytechnic University. Архивировано из оригинала 29 августа 2017 года . Получено 30 марта 2018 года .
- ^ Кэмпбелл, Нил А .; Рис, Джейн Б. (2005). Биология (седьмое изд.). Сан-Франциско, Калифорния: Benjamin Cummings . стр. 65. ISBN 0-8053-7171-0.
- ^ Киптон Дж. Пауэлл, Пол Л. Браун, Роберт Х. Бирн, Тамаш Гайда, Гленн Хефтер, Стаффан Шёберг, Ханс Ваннер (2005): «Химическое распределение экологически значимых тяжёлых металлов с неорганическими лигандами. Часть 1: Hg2+
, Cl − , ОН − , СО2−
3, ТАК2−
4, и ПО3−
4Водные системы". Чистая и прикладная химия , том 77, выпуск 4, страницы 739–800. doi :10.1351/pac200577040739 - ^ abc "Описание и торговые марки фосфатной добавки (пероральный путь, парентеральный путь) - Mayo Clinic". www.mayoclinic.org . Получено 20.11.2020 .
- ^ Группа диетологов по лечению заболеваний почек, Снижение содержания фосфата в рационе , Oxford University Hospitals NHS Foundation Trust, обзор 2022 г.
- ^ Ритц, Эберхард; Хан, Кай; Кеттелер, Маркус; Кульманн, Мартин К.; Манн, Йоханнес (январь 2012 г.). «Фосфатные добавки в продуктах питания — риск для здоровья». Deutsches Ärzteblatt International . 109 (4): 49–55. doi : 10.3238/arztebl.2012.0049. ISSN 1866-0452. ПМЦ 3278747 . ПМИД 22334826.
- ↑ Рейли, Майкл (26 мая 2007 г.). «Как долго это продлится?». New Scientist . 194 (2605): 38–9. Bibcode : 2007NewSc.194...38R. doi : 10.1016/S0262-4079(07)61508-5.
- ^ Лео Льюис (2008-06-23). «Ученые предупреждают о нехватке жизненно важного фосфора, поскольку биотопливо повышает спрос». The Times . Архивировано из оригинала 5 сентября 2008 г.
- ^ Геологическая служба США Фосфатная порода
- ^ Геологическая служба США «Образцы фосфорной почвы» (PDF) .
- ^ Флор Энтони. "Изобилие стихий". Seafriends.org.nz . Получено 10.01.2013 .
- ^ Американский геофизический союз , осеннее заседание 2007 г., тезисы № V33A-1161. Масса и состав континентальной коры
- ^ Фосфатная промышленность Центральной Флориды: Заявление о воздействии на окружающую среду. Том 2. США. Агентство по охране окружающей среды. 1979.
- ^ C. Michael Hogan (2010). "Загрязнение воды". В Mark McGinley и C. Cleveland (Washington, DC.: National Council for Science and the Environment ) (ed.). Encyclopedia of Earth . Архивировано из оригинала 2010-09-16.
- ^ "Обновленное объявление о ресурсах Хинды: теперь крупнейшее в мире месторождение фосфата (12.04.2012)". Cominco Resources . Архивировано из оригинала 2016-10-05 . Получено 2013-05-03 .
- ^ Бушуев, Михаил (26 января 2021 г.). «ЕС возлагает надежды на норвежское сырье» . Получено 2 июля 2023 г.
- ^ ««Отличные новости»: ЕС приветствует открытие крупного месторождения фосфатной руды в Норвегии». 29 июня 2023 г.
- ^ "Китай вводит квоты на фосфаты, чтобы ограничить экспорт удобрений - аналитики". Reuters . 15 июля 2022 г.
- ^ «Основные страны по импорту фосфорных удобрений».
- ^ "ФОСФАТНАЯ ПОРОДА, USGS" (PDF) .
- ^ Hochanadel, Dave (10 декабря 2010 г.). «Ограниченное количество общего фосфора на самом деле питает водоросли, согласно исследованию». Lake Scientist . Получено 10 июня 2012 г. [
Б]иодоступный фосфор — фосфор, который может быть использован растениями и бактериями — составляет лишь часть от общего количества, по словам Майкла Бретта, профессора инженерии Вашингтонского университета...
- ^ ab Schmittner KE, Giresse P (1999). "Микроэкологический контроль биоминерализации: поверхностные процессы осаждения апатита и кальцита в четвертичных почвах, Руссильон, Франция". Sedimentology . 46 (3): 463–76. Bibcode :1999Sedim..46..463S. doi :10.1046/j.1365-3091.1999.00224.x. S2CID 140680495.
- ^ Gnandi, K.; Tchangbedjil, G.; Killil, K.; Babal, G.; Abbel, E. (март 2006 г.). «Влияние хвостов фосфатных рудников на биоаккумуляцию тяжелых металлов в морских рыбах и ракообразных из прибрежной зоны Того». Шахтные воды и окружающая среда . 25 (1): 56–62. Bibcode : 2006MWE....25...56G. doi : 10.1007/s10230-006-0108-4. S2CID 129497587.
Внешние ссылки
- Браузер данных о минералах США предоставляет графические данные, охватывающие потребление, производство, импорт, экспорт и цены на фосфаты и 86 других минералов.
- Фосфат: монография аналита – Ассоциация клинической биохимии и лабораторной медицины





![[H2PO4]− Дигидрофосфат](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/2-dihydrogenphosphate-3D-balls.png/209px-2-dihydrogenphosphate-3D-balls.png)
![[HPO4]2− Фосфат водорода](http://upload.wikimedia.org/wikipedia/commons/thumb/8/87/1-hydrogenphosphate-3D-balls.png/169px-1-hydrogenphosphate-3D-balls.png)
![[PO 4]3− Фосфат или ортофосфат](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b0/0-phosphate-3D-balls.png/165px-0-phosphate-3D-balls.png)
![{\displaystyle K_{a1}={\frac {[{\ce {H+}}][{\ce {H2PO4-}}]}{[{\ce {H3PO4}}]}}\около 7,5\times 10 ^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eed347325ee75e9e7cec75402ae9a0d68c5aca9a)
![{\displaystyle K_{a2}={\frac {[{\ce {H+}}][{\ce {HPO4^2-}}]}{[{\ce {H2PO4-}}]}}\approx 6.2\times 10^{-8}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3795cf914ff31fa4feb59c417cc8ae8da71ef519)
![{\displaystyle K_{a3}={\frac {[{\ce {H+}}][{\ce {PO4^3-}}]}{[{\ce {HPO4^2-}}]}}\ примерно 2,14\times 10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90d1ae9985ce6207490cf9e7a6ab1f6d001a8a24)
![{\displaystyle {\begin{aligned}{\frac {[{\ce {H2PO4-}}]}{[{\ce {H3PO4}}]}}&\approx 7,5\times 10^{4}\\[4pt]{\frac {[{\ce {HPO4^2-}}]}{[{\ce {H2PO4-}}]}}&\approx 0,62\\[4pt]{\frac {[{\ce {PO4^3-}}]}{[{\ce {HPO4^2-}}]}}&\approx 2,14\times 10^{-6}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7bfb55f5ed7d0ba3805ba68970255099eca8291)

