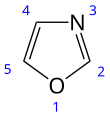
Оксазол
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК 1,3-Оксазол [1] | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| 103851 | |||
| ЧЭБИ | |||
| ChEMBL |
| ||
| ChemSpider | |||
| Информационная карта ECHA | 100.005.474 | ||
| Номер ЕС |
| ||
| 485850 | |||
| МеШ | Д010080 | ||
CID PubChem |
| ||
| УНИИ | |||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С3Н3НО | |||
| Молярная масса | 69,06 г/моль | ||
| Плотность | 1.050 г/см 3 | ||
| Точка кипения | 69,5 °C (157,1 °F; 342,6 К) | ||
| Кислотность ( pK a ) | 0,8 (сопряженной кислоты) [2] | ||
| Опасности | |||
| Маркировка СГС : [3] | |||
  | |||
| Опасность | |||
| Н225 , Н318 | |||
| Р210 , Р233 , Р240 , Р241 , Р242 , Р243 , Р264+Р265 , Р280 , Р303+Р361+Р353 , Р305+Р354+Р338 , Р317 , Р370+Р378 , Р403+Р235 , Р501 | |||
| Страница дополнительных данных | |||
| Оксазол (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Оксазол является исходным соединением для обширного класса гетероциклических ароматических органических соединений . Это азолы с кислородом и азотом, разделенными одним углеродом. [4] Оксазолы являются ароматическими соединениями , но в меньшей степени, чем тиазолы. Оксазол является слабым основанием; его сопряженная кислота имеет p K a 0,8 по сравнению с 7 для имидазола .
Подготовка
Классический синтетический путь — синтез Робинсона–Габриэля путем дегидратации 2-ациламинокетонов:

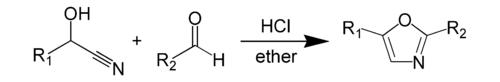
Широко используется также синтез оксазола по Фишеру из циангидринов и альдегидов :
Известны и другие методы, включая реакцию α- галогенкетонов и формамида , а также реакцию Ван Лейзена с альдегидами и TosMIC .
Биосинтез
В биомолекулах оксазолы образуются в результате циклизации и окисления сериновых или треониновых нерибосомальных пептидов : [5]

Где X = Н, СН
3для серина и треонина соответственно, B = основание.
(1) Ферментативная циклизация. (2) Элиминация. (3) [O] = ферментативное окисление.
Оксазолы не так распространены в биомолекулах , как родственные им тиазолы , в которых кислород заменен атомом серы.
Реакции
При pK a 0,8 для сопряженной кислоты (соли оксазолия) оксазолы гораздо менее основные, чем имидазолы (pK a = 7). Депротонирование оксазолов происходит при C2, а литиевая соль существует в равновесии с енолят-изонитрилом с открытым кольцом , который может быть захвачен силилированием . [4] Формилирование с диметилформамидом дает 2-формилоксазол.
Электрофильное ароматическое замещение происходит в положении С5, но для этого требуются электронодонорные группы .
Нуклеофильное ароматическое замещение происходит с уходящими группами при С2.
Реакции Дильса-Альдера с участием оксазола (в виде диенов) и электрофильных алкенов были хорошо разработаны как путь к пиридинам . Таким образом, алкоксизамещенные оксазолы служат предшественниками пиридоксильной системы, как это обнаружено в витамине B6 . Первоначальное циклоприсоединение дает бициклическое промежуточное соединение с кислоточувствительным оксо-мостиковым соединением.

В перегруппировке Корнфорта 4-ацилоксазолов происходит термическая реакция перегруппировки, в которой органический ацильный остаток и заместитель C5 изменяют свое положение.
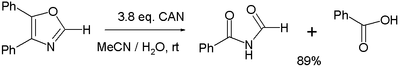
- Различные реакции окисления . В одном исследовании [7] сообщается об окислении 4,5-дифенилоксазола с 3 эквивалентами CAN до соответствующего имида и бензойной кислоты :

- В сбалансированной полуреакции на каждый эквивалент оксазолина расходуется три эквивалента воды, в результате чего образуется 4 протона и 4 электрона (последние получены из Ce IV ).
Смотрите также
- Изоксазол , аналог с атомом азота в положении 2.
- Тиазол , аналог с заменой кислорода на серу.
- Бензоксазол , где оксазол конденсирован с бензольным кольцом.
- Оксазолин , в котором восстановлена одна двойная связь.
- Оксазолидин , в котором восстановлены обе двойные связи.
- Оксазолон , аналог с карбонильной группой
Дополнительное чтение
- Полностью автоматизированный непрерывный поточный синтез 4,5-дизамещенных оксазолов Маркус Бауманн, Ян Р. Баксендейл, Стивен В. Лей , Кристофер Д. Смит и Джеффри К. Транмер Org. Lett.; 2006 ; 8(23) стр. 5231 - 5234. doi :10.1021/ol061975c
Ссылки
- ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013. Королевское химическое общество . стр. 140. doi :10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ Золтевич, JA и Деди, LW Кватернизация гетероароматических соединений. Количественные аспекты. Adv. Heterocycl. Chem. 22, 71-121 (1978).
- ^ "Оксазол". pubchem.ncbi.nlm.nih.gov .
- ^ ab TL Gilchrist (1997). Гетероциклическая химия (3-е изд.). Longman. ISBN 0-582-01421-2.
- ^ Рой, Ранабир Синха; Геринг, Эми М.; Милн, Джилл К.; Белшоу, Питер Дж.; Уолш, Кристофер Т.; Рой, Ранабир Синха; Геринг, Эми М.; Милн, Джилл К.; Белшоу, Питер Дж.; Уолш, Кристофер Т. (1999). «Тиазольные и оксазольные пептиды: биосинтез и молекулярная техника». Natural Product Reports . 16 (2): 249–263. doi :10.1039/A806930A. PMID 10331285.
- ^ Жерар Муан; Ханс-Петер Хоманн; Роланд Курт; Иоахим Пауст; Вольфганг Ханляйн; Хорст Полинг; Бернд-Юрген Вейманн; Бруно Кеслер (2011). «Витамины, 6. Витамины группы В». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.o27_o09. ISBN 978-3-527-30673-2.
- ^ "Церико-аммонийный нитрат способствовал окислению оксазолов", Дэвид А. Эванс , Павел Нагорный и Ришэн Сюй. Org. Lett .; 2006 ; 8(24) стр. 5669 - 5671; (Письмо) doi :10.1021/ol0624530