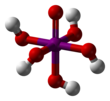
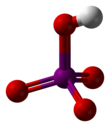
Периодическая кислота
Ортопериодная кислота | |||
Метапериодная кислота | |||
 Ортопериодная кислота | |||
| Имена | |||
|---|---|---|---|
Другие имена
| |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ChemSpider | |||
| Информационная карта ECHA | 100.030.839 | ||
| Номер ЕС |
| ||
CID PubChem |
| ||
| УНИИ | |||
| Номер ООН | UN3085 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| HIO 4 (метапериодический) H 5 IO 6 (ортопериодический) | |||
| Молярная масса | 190,91 г/моль ( HIO 4 ) 227,941 г/моль ( H 5 IO 6 ) | ||
| Появление | Бесцветные кристаллы. | ||
| Температура плавления | 128,5 °C (263,3 °F; 401,6 К) [1] | ||
| Растворимость | растворим в воде, спиртах | ||
| Сопряженное основание | Периодат | ||
| Опасности [2] | |||
| Маркировка СГС : | |||
    | |||
| Опасность | |||
| Н271 , Н314 , Н372 , Н400 | |||
| П210 , П260 , П273 , П303+П361+П353 , П305+П351+П338 | |||
| NFPA 704 (огненный алмаз) | |||
| Паспорт безопасности (SDS) | Внешний ПБС | ||
| Родственные соединения | |||
Другие анионы |
| ||
Другие катионы | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Периодическая кислота ( / ˌ p ɜːr aɪ ˈ ɒ d ɪ k / per-eye- OD -ik ) является высшей оксокислотой йода , в которой йод существует в степени окисления +7. Она может существовать в двух формах: ортопериодной кислоты с химической формулой H 5 IO 6 и метапериодной кислоты с формулой HIO 4 .
Периодическая кислота была открыта Генрихом Густавом Магнусом и К. Ф. Аммермюллером в 1833 году. [3]
Синтез
Современное промышленное производство включает окисление раствора иодата натрия в щелочных условиях, либо электрохимически на аноде PbO2 , либо путем обработки хлором : [4 ]
- ИО−3+ 6 HO − - 2 e − → IO5−6+ 3 H 2 O ( противоионы опущены для ясности) E ° = -1,6 В [5]
- ИО−3+ 6 HO − + Cl 2 → IO5−6+ 2 Cl − + 3 H 2 O
Стандартное лабораторное приготовление включает обработку смеси периодата бария с азотной кислотой . При концентрировании смеси нитрат бария , который менее растворим, отделяется от периодной кислоты: [6]
- Ba 3 H 4 (IO 6 ) 2 + 6 HNO 3 → 3 Ba(NO 3 ) 2 + 2H 5 IO 6
Характеристики
Ортопериодная кислота имеет ряд констант кислотной диссоциации . [7] [8] Значение p K a метапериодной кислоты не определено.
- Н 5 ИО 6 ⇌ Н 4 ИО−6+ Н + , п К а = 3,29
- H 4 IO−6⇌ H3IO2−6+ Н + , п К а = 8,31
- H 3 IO2−6⇌ H2IO3−6+ Н + , п К а = 11,60
Поскольку существуют две формы периодной кислоты, то образуются два типа солей периодата. Например, метапериодат натрия , NaIO 4 , может быть синтезирован из HIO 4 , тогда как ортопериодат натрия , Na 5 IO 6 , может быть синтезирован из H 5 IO 6 .
Структура
Ортопериодная кислота образует моноклинные кристаллы ( пространственная группа P2 1 / n ), состоящие из слегка деформированного октаэдра IO 6 , связанного через мостиковые атомы водорода. Пять расстояний связей I–O находятся в диапазоне 1,87–1,91 Å, а одна связь I–O составляет 1,78 Å. [9] [10] Структура метапериодной кислоты также включает октаэдры IO 6 , однако они связаны через цис -общие ребра с мостиковыми атомами кислорода, образуя одномерные бесконечные цепи. [11]
Реакции
Ортопериодную кислоту можно дегидратировать, получив метапериодную кислоту, нагревая ее до 100 °C при пониженном давлении.
- H5IO6 ⇌ HIO4 + 2H2O
Дальнейшее нагревание до примерно 150 °C дает пентаоксид йода ( I 2 O 5 ), а не ожидаемый ангидрид дииодгептоксида ( I 2 O 7 ). Метапериодную кислоту также можно получить из различных ортопериодатов путем обработки разбавленной азотной кислотой . [12]
Как и все периодаты, периодная кислота может быть использована для расщепления различных 1,2-дифункциональных соединений. Наиболее заметно, что периодная кислота расщепляет вицинальные диолы на два альдегидных или кетонных фрагмента ( реакция Малапрада ).

Это может быть полезно при определении структуры углеводов , поскольку периодная кислота может использоваться для открытия сахаридных колец. Этот процесс часто используется для маркировки сахаридов флуоресцентными молекулами или другими метками, такими как биотин . Поскольку для этого процесса требуются вицинальные диолы, окисление периодатом часто используется для селективной маркировки 3′-концов РНК ( рибоза имеет вицинальные диолы) вместо ДНК , поскольку дезоксирибоза не имеет вицинальных диолов.
Периодная кислота также используется в качестве окислителя средней силы, как показано в реакции Баблера окисления вторичных аллиловых спиртов , которые окисляются до енонов стехиометрическими количествами ортопериодной кислоты с катализатором PCC . [13]
Другие оксикислоты
Периодная кислота является частью ряда оксикислот , в которых йод может принимать степени окисления −1, +1, +3, +5 или +7. Также известен ряд нейтральных оксидов йода .
| Степень окисления йода | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Имя | Иодистый водород | Иодистая кислота | Йодистая кислота | Йодистая кислота | Периодическая кислота |
| Формула | ПРИВЕТ | ХИО | ХИО 2 | ХИО 3 | HIO 4 или H 5 IO 6 |
Смотрите также
Соединения со схожей структурой:
- Хлорная кислота , бромная кислота , родственные ей пергалогеновые кислоты
- Теллуровая кислота и перксеновая кислота , изоэлектронные оксокислоты теллура и ксенона
Соединения со схожей химией:
Ссылки
- ^ Aylett, основанный AF Holleman; продолженный Egon Wiberg; переведенный Mary Eagleson, William Brewer; пересмотренный Bernhard J. (2001). Inorganic chemistry (1st English ed., [ed.] Nils Wiberg. ed.). San Diego, Calif. : Berlin: Academic Press, W. de Gruyter. p. 453. ISBN 0123526515.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ "Periodsaeure zur Synthese" . Сигма Олдрич. 8 октября 2021 г. Проверено 21 ноября 2021 г.
- ^ Аммермюллер, Ф.; Магнус, Г. (1833). «Ueber eine neue Verbindung des Jods mit Sauerstoff, die Ueberjodsäure». Annalen der Physik und Chemie (на немецком языке). 104 (7): 514–525 . Бибкод : 1833АнП...104..514А. дои : 10.1002/andp.18331040709.
- ^ Гринвуд, NN; Эрншоу, A (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. стр. 872. doi :10.1016/C2009-0-30414-6. ISBN 978-0-7506-3365-9.
- ^ Парсонс, Роджер (1959). Справочник по электрохимическим константам. Butterworths Scientific Publications Ltd. стр. 71.
- ^ М. Шмайссер (1963). «Периодная кислота». В G. Brauer (ред.). Справочник по препаративной неорганической химии, 2-е изд . Т. 2страницы=322. NY,NY: Academic Press.
- ^ Aylett, основанный AF Holleman; продолженный Egon Wiberg; переведенный Mary Eagleson, William Brewer; пересмотренный Bernhard J. (2001). Inorganic chemistry (1st English ed., [ed.] Nils Wiberg. ed.). San Diego, Calif. : Berlin: Academic Press, W. de Gruyter. p. 454. ISBN 0123526515.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Burgot, Jean-Louis (2012-03-30). Ионные равновесия в аналитической химии . Нью-Йорк: Springer. стр. 358. ISBN 978-1441983824.
- ^ Feikema, YD (10 июня 1966 г.). «Кристаллические структуры двух оксикислот йода. I. Исследование ортопериодной кислоты H 5 IO 6 методом нейтронной дифракции». Acta Crystallographica . 20 (6): 765– 769. doi :10.1107/S0365110X66001828.
- ^ Fábry, J.; Podlahová, J.; Loub, J.; Langer, V. (1982). «Структура аддукта 1:1 ортопериодной кислоты и мочевины». Acta Crystallographica Раздел B: Структурная кристаллография и кристаллохимия . 38 (3): 1048– 1050. doi :10.1107/S0567740882004932.
- ^ Крафт, Торстен; Янсен, Мартин (1 сентября 1997 г.). «Определение кристаллической структуры метапериодной кислоты, HIO4 , с помощью комбинированной рентгеновской и нейтронной дифракции». Angewandte Chemie International Edition на английском языке . 36 (16): 1753– 1754. doi :10.1002/anie.199717531.
- ^ Райли (1963). Брауэр, Георг (ред.). Справочник по препаративной неорганической химии. Том 1. Перевод Scripta Technica, Inc. Редактор перевода Рид Ф. (2-е изд.). Нью-Йорк, Нью-Йорк: Academic Press. С. 323–324 . ISBN 012126601X.
- ^ Киллоран, Патрик М.; Россингтон, Стивен Б.; Уилкинсон, Джеймс А.; Хэдфилд, Джон А. (2016). «Расширение области окисления Баблера–Даубена: 1,3-окислительная транспозиция вторичных аллильных спиртов». Tetrahedron Letters . 57 (35): 3954– 3957. doi :10.1016/j.tetlet.2016.07.076.