Ортоэстер

В органической химии ортоэфир представляет собой функциональную группу , содержащую три алкоксигруппы, присоединенные к одному атому углерода, т.е. с общей формулой RC(OR') 3 . Ортоэфиры можно рассматривать как продукты исчерпывающего алкилирования нестабильных ортокарбоновых кислот , и именно от них произошло название «ортоэфир». Примером является этилортоацетат , CH 3 C(OCH 2 CH 3 ) 3 , более правильно известный как 1,1,1-триэтоксиэтан. [1]
Синтез
Ортоэфиры могут быть получены с помощью реакции Пиннера , в которой нитрилы реагируют со спиртами в присутствии одного эквивалента хлористого водорода. Реакция протекает с образованием гидрохлорида имидоэфира :
- RCN + R′OH + HCl → [RC(OR ′ )= NH2 ] + Cl−
При выдерживании в присутствии избытка спирта этот промежуточный продукт превращается в ортоэфир:
- [RC(OR ′ )=NH 2 ] + Cl − + 2 R ′ OH → RC(OR ′ ) 3 + NH 4 Cl
Для реакции требуются безводные условия [1] и, в идеале, неполярный растворитель. [2] : 6
Хлорангидриды кислот также могут управлять реакцией из соответствующего амида, например: [3] : 154
- HCONH 2 + BzCl → HC(OBz)NH 2 Cl
- HC(OBz)NH2Cl + ROH → HC(OR) 3 + NH4Cl + BzOH.
Хотя это и менее распространенный метод, ортоэфиры были впервые получены путем реакции 1,1,1-трихлоралканов с алкоголятом натрия: [1]
- RCCl 3 + 3 NaOR ′ → RC(OR ′ ) 3 + 3 NaCl
Соединения с соседним атомом водорода на R, как правило, подвергаются элиминированию вместо этого. [2] : 12 Традиционные эфиры могут быть преобразованы в α,α-дихлорэфиры с помощью пентахлорида фосфора . Полученные галогенированные соединения подвергаются синтезу эфира, как трихлоралканы. [3] : 162
Карбоновые кислоты естественным образом образуют тритиоортоэфир при нагревании с меркаптаном соответствующей стехиометрии. [4] Полученное соединение подвергается переэтерификации в традиционный ортоэфир в присутствии хлорида цинка . [3] : 156 Также возможна традиционная переэтерификация из более дешевого ортоэфира. [3]
Реакции
Гидролиз
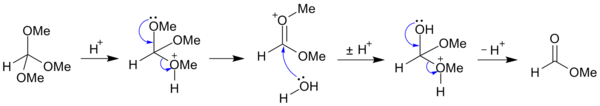
Ортоэфиры легко гидролизуются в слабых водных растворах кислот с образованием сложных эфиров :
- RC ( OR ′ ) 3 + H2O → RCO2R ′ + 2R′OH
Например, триметилортоформиат CH(OCH 3 ) 3 может быть гидролизован (в кислых условиях) до метилформиата и метанола ; [5] и может быть далее гидролизован (в щелочных условиях) до солей муравьиной кислоты и метанола. [6]
Перегруппировка Джонсона – Кляйзена
Перегруппировка Джонсона -Кляйзена представляет собой реакцию аллилового спирта с ортоэфиром, содержащим депротонируемый альфа-углерод (например, триэтилортоацетат ), с образованием γ,δ-ненасыщенного эфира . [7]
Синтез альдегида Бодру-Чичибабина
В синтезе альдегида Бодру-Чичибабина ортоэфир реагирует с реактивом Гриньяра с образованием альдегида ; это пример реакции формилирования .
Примеры

Гигромицин В — антибиотик , один из нескольких природных ортоэфиров.

Примерами ортоэфиров являются реагенты триметилортоформиат и триэтилортоацетат . Другим примером является бициклическая защитная группа OBO (4-метил-2,6,7-триокса - бицикло [ 2.2.2] октан -1-ил), которая образуется при воздействии (3-метилоксетан-3-ил)метанола на активированные карбоновые кислоты в присутствии кислот Льюиса. Группа является устойчивой к основанию и может быть расщеплена в два этапа в мягких условиях, слабокислотный гидролиз дает эфир трис(гидроксиметил)этана, который затем расщепляется с использованием, например, водного раствора карбоната. [8]
Тройная симметрия изомера циклогексангексола сцилло -инозитола (сциллитола) дает тройные мостиковые ортоформиатные эфиры сциллитола с адамантан -подобным скелетом и сциллитола бис-ортоформиат с двумя конденсированными адамантан-подобными скелетами. [9]
Смотрите также
- Ацеталь , C(OR) 2 R 2
- Ортокарбонат , C(OR) 4 .
Ссылки
- ^ abc EH Cordes (1969). "Ортоэстеры". В Saul Patai (ред.). Карбоновые кислоты и эфиры . Химия функциональных групп PATAI. стр. 623–667 . doi :10.1002/9780470771099.ch13. ISBN 9780470771099.
- ^ ab DeWolfe, Robert H. (1970). Производные карбоновых ортокислот . Органическая химия. Т. 14. Нью-Йорк, Нью-Йорк: Academic Press. LCCN 70-84226.
- ^ abcd ДеВольф, Роберт Х. (март 1974). «Синтез карбоксильных или карбоновых ортоэфиров». Синтез (3): 153– 172. doi :10.1055/s-1974-23268.
- ^ Хубен, Дж. «Über die Condensation von Mercaptanen mit Ameisensäure zu Orthotrithio-ameisensäureestern» [О конденсации меркаптанов с муравьиной кислотой в тритиоорто-эфиры муравьиной кислоты]. Berichte der Deutschen Chemischen Gesellschaft (на немецком языке). 45 : 2942–2946 . doi :10.1002/cber.19120450319 – через Интернет-архив .
- ^ Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Oxford University Press. стр. 345. ISBN 978-0-19-850346-0.
- ↑ Заявка на патент США 20070049501, Saini; Rajesh K.; и Savery; Karen, 1 марта 2007 г.
- ^ Джонсон, Уильям Саммер.; Вертеманн, Люциус.; Бартлетт, Уильям Р.; Броксом, Тимоти Дж.; Ли, Цунг-Ти.; Фолкнер, Д. Джон.; Петерсен, Майкл Р. (февраль 1970 г.). «Простая стереоселективная версия перегруппировки Кляйзена, приводящая к транс-тризамещенным олефиновым связям. Синтез сквалена». Журнал Американского химического общества . 92 (3): 741– 743. doi :10.1021/ja00706a074.
- ^ Kocieński, Philip J. (2005). Защитные группы (3-е изд.). Штутгарт: Thieme. ISBN 978-3-13-135603-1.
- ^ Хё Вон Ли и Ёсито Киши (1985): «Синтез моно- и несимметричных бис-ортоэфиров сцилло -инозитола». Журнал органической химии , том 50, выпуск 22, страницы 4402–4404 doi :10.1021/jo00222a046