Нейротрансмиттерный пролекарство
Пролекарство нейротрансмиттера , или предшественник нейротрансмиттера , — это препарат , который действует как пролекарство нейротрансмиттера . В медицине были разработаны и используются различные пролекарства нейротрансмиттеров . [1] [2] Они могут быть полезны, когда сам нейротрансмиттер не подходит для использования в качестве фармацевтического препарата из-за неблагоприятных фармакокинетических или физико-химических свойств, например, высокой восприимчивости к метаболизму , короткого периода полувыведения или отсутствия проницаемости гематоэнцефалического барьера . [1] [2] [3] Помимо использования в медицине, пролекарства нейротрансмиттеров в некоторых случаях также использовались в качестве рекреационных наркотиков . [4] [5]
Моноаминные пролекарства
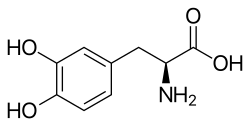
Моноаминовые нейромедиаторы-предшественники включают предшественников и пролекарства катехоламинов L -фенилаланин , L -тирозин , L -ДОФА (леводопа), L -ДОПС (дроксидопа) и дипивефрин ( O , O' -дипивалилепинефрин) [1] [3] , а также предшественники и пролекарства серотонина и мелатонина L -триптофан и L -5-гидрокситриптофан (5-HTP; окситриптан). [6] [7] [8] Также были разработаны другие пролекарства дофамина, включая этилводопа , фослеводопа , мелеводопа , XP-21279 , DopAmide , DA-Phen , O , O' -диацетилдофамин , O , O' -дипивалоилдофамин , докарпамин , глюдопа и глюдофамин. [9] [10] [11] [12] [13] Допамантин ( N -адамантанилдофамин) — еще одна возможная попытка создания пролекарства дофамина. [14] [15] Также были разработаны другие пролекарства серотонина, такие как селективный к почкам L -глутамил-5-гидрокси- L -триптофан (glu-5-HTP). [16] [17] [18]
5-HTP также является пролекарством N - метилированного триптамина , психоделических следовых аминов , таких как N -метилсеротонин (NMS; норбуфотенин) и буфотенин (5-гидрокси- N , N -диметилтриптамин; 5-HO-DMT). [19] [20] [21] [22] [23] То же самое относится и к L -триптофану, который преобразуется в триптамин, а также в N -метилтриптамин (NMT) и N , N -диметилтриптамин ( N , N -DMT). [20] [24] [25] [26] [27] В зависимости от этих преобразований, как триптофан, так и 5-HTP вызывают реакцию подергивания головы (HTR), поведенческий прокси-фактор психоделических эффектов, при достаточно высоких дозах у животных. [20] [28] [29] [21] [30] [19] O -ацетилбуфотенин и O -пивалилбуфотенин считаются центрально активными пролекарствами периферически селективного буфотенина. [31] [32] [33]
Хотя они не являются эндогенными нейротрансмиттерными пролекарствами, также были разработаны «ложные» или «замещающие» нейротрансмиттерные пролекарства, такие как α-метилтриптофан и α-метил-5-гидрокситриптофан (которые являются пролекарствами α-метилсеротонина , замещающего нейротрансмиттера серотонина). [34] Аналогично, ибопамин и фоспамин являются пролекарствами эпинина ( N -метилдопамин; дезоксиэпинефрин). [35]
Пролекарства ГАМК
Пролекарства γ-аминомасляной кислоты (ГАМК) включают прогабид и толгабид . [2] [36] Пикамилон был заявлен как пролекарство ГАМК, но на самом деле не было продемонстрировано, что он превращается в ГАМК. [37] [38] Пивагабин когда-то считался пролекарством ГАМК, но это оказалось не так. [39]
Известно, что 4-амино-1-бутанол превращается в ГАМК под действием альдегидредуктазы ( АЛР) и альдегиддегидрогеназы (АЛДГ). [40] 4-амино-1-бутанол превращается в ГАМК так же, как 1,4-бутандиол (4-гидрокси-1-бутанол; 1,4-БД) превращается в γ-гидроксимасляную кислоту (ГОМК) (при этом 1,4-БД является хорошо известным пролекарством ГОМК). [40] [41] Метаболический промежуточный продукт γ-аминомасляный альдегид (ГАБАЛ) также превращается в ГАМК. [42] [43]
Пролекарства ГОМК
Известен ряд пролекарств γ-гидроксимасляной кислоты (GHB). [4] К ним относятся 1,4-бутандиол (1,4-BD) и γ-бутиролактон (GBL), а также метаболический промежуточный продукт γ-гидроксимасляный альдегид (GHBAL). [4] [5] [41] [44]
Пролекарства ацетилхолина
Известны и исследованы предшественники и пролекарства ацетилхолина , такие как холин , фосфатидилхолин ( лецитин ), цитиколин (ЦДФ-холин) и холина альфосцерат (α-ГФХ). [45]
Ссылки
- ^ abc Vytla D, Combs-Bachmann RE, Hussey AM, McCarron ST, McCarthy DS, Chambers JJ (май 2012 г.). «Пролекарственные подходы к снижению гипервозбуждения в ЦНС». Adv Drug Deliv Rev. 64 ( 7): 666–685. doi :10.1016/j.addr.2011.11.007. PMID 22138074.
- ^ abc Jana S, Mandlekar S, Marathe P (2010). «Проектирование пролекарств для улучшения фармакокинетических свойств и свойств доставки лекарств: проблемы для ученых-открывателей». Curr Med Chem . 17 (32): 3874–3908. doi :10.2174/092986710793205426. PMID 20858214.
- ^ ab Huttunen KM, Raunio H, Rautio J (сентябрь 2011 г.). «Пролекарства — от счастливой случайности к рациональному дизайну». Pharmacol Rev. 63 ( 3): 750–771. doi :10.1124/pr.110.003459. PMID 21737530.
- ^ abc Ponce, Julio de Carvalho (2024). «Использование пролекарств в качестве наркотиков, вызывающих злоупотребление». WIREs Forensic Science . 6 (3). doi : 10.1002/wfs2.1514 . ISSN 2573-9468.
- ^ ab Trombley TA, Capstick RA, Lindsley CW (декабрь 2020 г.). «Классика DARK в химической нейронауке: гамма-гидроксибутират (GHB)». ACS Chem Neurosci . 11 (23): 3850–3859. doi :10.1021/acschemneuro.9b00336. PMID 31287661.
- ^ Maffei ME (декабрь 2020 г.). «5-Гидрокситриптофан (5-HTP): естественное происхождение, анализ, биосинтез, биотехнология, физиология и токсикология». Int J Mol Sci . 22 (1): 181. doi : 10.3390/ijms22010181 . PMC 7796270. PMID 33375373 .
- ^ Dörwald, FZ (2012). Lead Optimization for Medicinal Chemists: Pharmacokinetic Properties of Functional Groups and Organic Compounds. Wiley. стр. 159. ISBN 978-3-527-33226-7. Получено 9 сентября 2024 г. .
- ^ Turner EH, Loftis JM, Blackwell AD (март 2006 г.). «Серотонин a la carte: добавки с предшественником серотонина 5-гидрокситриптофаном». Pharmacol Ther . 109 (3): 325–338. doi :10.1016/j.pharmthera.2005.06.004. PMID 16023217.
- ^ Gupta HV, Lyons KE, Pahwa R (сентябрь 2019 г.). «Старые лекарства, новые системы доставки при болезни Паркинсона». Drugs Aging . 36 (9): 807–821. doi :10.1007/s40266-019-00682-9. PMID 31161581.
- ^ Lees A, Tolosa E, Stocchi F, Ferreira JJ, Rascol O, Antonini A, Poewe W (январь 2023 г.). «Оптимизация терапии леводопой, когда и как? Перспективы важности доставки и потенциала раннего комбинированного подхода». Expert Rev Neurother . 23 (1): 15–24. doi :10.1080/14737175.2023.2176220. hdl : 10451/56313 . PMID 36729395.
- ↑ Каччиаторе I, Чиулла М, Маринелли Л, Эусепи П, Ди Стефано А (апрель 2018 г.). «Достижения в разработке пролекарств для лечения болезни Паркинсона». Экспертное мнение о лекарствах . 13 (4): 295–305. дои : 10.1080/17460441.2018.1429400. ПМИД 29361853.
- ^ Хаддад Ф., Савалха М., Хаваджа Й., Наджар А., Караман Р. (декабрь 2017 г.). «Пролекарства дофамина и леводопы для лечения болезни Паркинсона». Molecules . 23 (1): 40. doi : 10.3390/molecules23010040 . PMC 5943940 . PMID 29295587.
- ^ Dhaneshwar SS, Sharma M, Patel V, Desai U, Bhojak J (2011). «Стратегии пролекарств для антигипертензивных средств». Curr Top Med Chem . 11 (18): 2299–317. doi :10.2174/156802611797183285. PMID 21671866.
- ^ Lamoureux G, Artavia G (2010). "Использование структуры адамантана в медицинской химии". Current Medicinal Chemistry . 17 (26): 2967–2978. doi :10.2174/092986710792065027. PMID 20858176.
Допамантин 4, препарат против болезни Паркинсона, прошедший клинические испытания, также основан на способности адамантана изменять распределение препарата [10]. Конъюгация адамантильной группы в качестве "липофильного носителя" позволяет плохо всасывающимся препаратам легче проникать через ГЭБ и увеличивать концентрацию в мозговой ткани.
- ^ Вернье VG, Дюпон EI (1974). "Глава 3. Противопаркинсонические препараты". Annual Reports in Medicinal Chemistry . Vol. 9. Elsevier. pp. 19–26. doi :10.1016/s0065-7743(08)61424-4. ISBN 978-0-12-040509-1.
Кармантадин (VII, Sch 15427) структурно связан с амантадином33. Он разделяет некоторые из его фармакологических действий, был эффективен в головокружительном тесте34 и находится на ранних стадиях клинических испытаний. Допамантин (VIII) объединил элементы как амантадина, так и дофамина в своей структуре, разделяет некоторые фармакологические эффекты амантадина и находится на ранних стадиях клинических испытаний35.
- ^ Thorré, Katrien; Sarre, S.; Twahirwa, E.; Meeusen, R.; Ebinger, G.; Haemers, A.; Michotte, Y. (1996). «Влияние l-триптофана, l-5-гидрокситриптофана и пролекарств l-триптофана на внеклеточные уровни 5-HT и 5-HIAA в гиппокампе крысы с использованием микродиализа». European Journal of Pharmaceutical Sciences . 4 (4): 247–256. doi :10.1016/0928-0987(95)00056-9.
- ^ Li Kam Wa TC, Freestone S, Samson RR, Johnston NR, Lee MR (июль 1993 г.). «Сравнение эффектов двух предполагаемых почечных пролекарств 5-гидрокситриптамина у нормального человека». Br J Clin Pharmacol . 36 (1): 19–23. doi :10.1111/j.1365-2125.1993.tb05886.x. PMC 1364549. PMID 7690583 .
- ^ Li Kam Wa TC, Freestone S, Samson RR, Johnston NR, Lee MR (сентябрь 1994 г.). «Антинатриуретическое действие гамма-L-глутамил-5-гидрокси-L-триптофана зависит от его декарбоксилирования до 5-гидрокситриптамина у нормального человека». Br J Clin Pharmacol . 38 (3): 265–269. doi :10.1111/j.1365-2125.1994.tb04351.x. PMC 1364799. PMID 7826829 .
- ^ аб Козленков, Алексей; Гонсалес-Маэсо, Хавьер (2013). «Модели животных и галлюциногенные препараты». Нейронаука галлюцинаций . Нью-Йорк, штат Нью-Йорк: Springer New York. стр. 253–277. дои : 10.1007/978-1-4614-4121-2_14. ISBN 978-1-4614-4120-5.
- ^ abc Halberstadt AL, Geyer MA (2018). «Влияние галлюциногенов на безусловное поведение». Curr Top Behav Neurosci . Текущие темы в поведенческих нейронауках. 36 : 159–199. doi :10.1007/7854_2016_466. ISBN 978-3-662-55878-2. PMC 5787039 . PMID 28224459.
- ^ ab Schmid CL, Bohn LM (октябрь 2010 г.). «Серотонин, но не N-метилтриптамины, активирует рецептор серотонина 2A через сигнальный комплекс β-аррестин2/Src/Akt in vivo». J Neurosci . 30 (40): 13513–24. doi :10.1523/JNEUROSCI.1665-10.2010. PMC 3001293 . PMID 20926677.
- ^ Сапиенца, Якопо (13 октября 2023 г.). «Ключевая роль внутриклеточных рецепторов 5-HT2A: поворотный момент в психоделических исследованиях?». Psychoactives . 2 (4): 287–293. doi : 10.3390/psychoactives2040018 . ISSN 2813-1851.
- ^ Vargas MV, Dunlap LE, Dong C, Carter SJ, Tombari RJ, Jami SA, Cameron LP, Patel SD, Hennessey JJ, Saeger HN, McCorvy JD, Gray JA, Tian L, Olson DE (февраль 2023 г.). «Психоделики способствуют нейропластичности посредством активации внутриклеточных рецепторов 5-HT2A». Science . 379 (6633): 700–706. doi :10.1126/science.adf0435. PMC 10108900 . PMID 36795823.
- ^ Carbonaro TM, Gatch MB (сентябрь 2016 г.). "Нейрофармакология N,N-диметилтриптамина". Brain Res Bull . 126 (Pt 1): 74–88. doi :10.1016/j.brainresbull.2016.04.016. PMC 5048497 . PMID 27126737.
Эндогенный DMT синтезируется из незаменимой аминокислоты триптофана, которая декарбоксилируется до триптамина. Затем триптамин трансметилируется ферментом индолэтиламин-N-метилтрансферазой (INMT) (используя S-аденозилметионин в качестве субстрата), который катализирует добавление метильных групп, что приводит к образованию N-метилтриптамина (NMT) и DMT. NMT также может выступать в качестве субстрата для INMT-зависимого биосинтеза DMT (Barker et al., 1981).
- ^ Barker SA (2018). "N, N-диметилтриптамин (ДМТ), эндогенный галлюциноген: прошлые, настоящие и будущие исследования для определения его роли и функции". Front Neurosci . 12 : 536. doi : 10.3389/fnins.2018.00536 . PMC 6088236 . PMID 30127713.
После открытия индол-N-метилтрансферазы (INMT; Axelrod, 1961) в мозге крысы исследователи вскоре начали изучать, может ли преобразование триптофана (2, рисунок 2) в триптамин (ТА; 3, рисунок 2) преобразовываться в ДМТ в мозге и других тканях нескольких видов млекопитающих. Многочисленные исследования впоследствии продемонстрировали биосинтез DMT в препаратах тканей млекопитающих in vitro и in vivo (Saavedra и Axelrod, 1972; Saavedra et al., 1973). В 1972 году Хуан Сааведра и Юлиус Аксельрод сообщили, что интрацистернально введенный TA был преобразован в N-метилтриптамин (NMT; 4, Рисунок 2) и DMT у крыс, что стало первой демонстрацией образования DMT мозговой тканью in vivo.
- ^ Cameron LP, Olson DE (октябрь 2018 г.). «Темная классика в химической нейронауке: N, N-диметилтриптамин (DMT)» (PDF) . ACS Chem Neurosci . 9 (10): 2344–2357. doi :10.1021/acschemneuro.8b00101. PMID 30036036.
Подобно серотонину и мелатонину, DMT является продуктом метаболизма триптофана.25 После декарбоксилирования триптофана триптамин метилируется N-метилтрансферазой (т. е. INMT) с S-аденозилметионином, служащим донором метильной группы. Второе ферментативное метилирование производит DMT (рисунок 3A).26 [...] Фермент индолэтиламин N-метилтрансфераза (INMT) катализирует метилирование различных биогенных аминов и отвечает за превращение триптамина в DMT у млекопитающих.140
- ^ Колосимо, Фрэнки А.; Борселлино, Филипп; Крайдер, Риз И.; Маркес, Рауль Э.; Вида, Томас А. (26 февраля 2024 г.). «Клинический потенциал диметилтриптамина: прорывы на другую сторону психического заболевания, нейродегенерации и сознания». Психоактивные вещества . 3 (1). MDPI AG: 93–122. doi : 10.3390/psychoactives3010007 . ISSN 2813-1851.
Метаболизм ДМТ в организме начинается с его синтеза. Эндогенный ДМТ образуется из триптофана после того, как декарбоксилирование превращает его в триптамин [22,25]. Затем триптамин подвергается трансметилированию, опосредованному индолэтиламин-N-метилтрансферазой (INMT) с S-аденозилметионином (SAM) в качестве субстрата, превращаясь в N-метилтриптамин (NMT) и в конечном итоге производя N,N-DMT [26]. Интересно, что INMT широко распространен по всему телу, преимущественно в легких, щитовидной железе и надпочечниках, с плотным присутствием в переднем роге спинного мозга. В пределах церебрального домена такие области, как крючок, продолговатый мозг, миндалевидное тело, фронтальная кора, лобно-теменная доля и височная доля, демонстрируют активность INMT, в основном локализованную в соме [26]. Транскрипты INMT обнаружены в определенных областях мозга, включая кору головного мозга, эпифиз и сосудистое сплетение, как у крыс, так и у людей. Хотя мозг крысы способен синтезировать и высвобождать DMT в концентрациях, схожих с установленными моноаминовыми нейротрансмиттерами, такими как серотонин [27], возможность того, что DMT является подлинным нейротрансмиттером, все еще остается спекулятивной. Этот вопрос был спорным в течение десятилетий [28] и требует демонстрации зависимого от активности высвобождения (т. е. стимулированного Ca2+) DMT в синаптической щели, чтобы быть полностью установленным в человеческом мозге.
- ^ Шмид, Каллен Л.; Бон, Лора М. (2018). «βArrestins: Ligand-Directed Regulators of 5-HT2A Receptor Trafficking and Signaling Events». Рецепторы 5-HT2A в центральной нервной системе . Cham: Springer International Publishing. стр. 31–55. doi :10.1007/978-3-319-70474-6_2. ISBN 978-3-319-70472-2.
- ^ Джастер А.М., де ла Фуэнте Ревенга М., Гонсалес-Маэсо Дж. (июль 2022 г.). «Молекулярные мишени психоделической пластичности». Дж. Нейрохем . 162 (1): 80–88. дои : 10.1111/jnc.15536. ПМК 9068831 . ПМИД 34741320.
- ^ Canal CE, Morgan D (2012). «Реакция подергивания головы у грызунов, вызванная галлюциногеном 2,5-диметокси-4-йодоамфетамином: всесторонняя история, переоценка механизмов и ее полезность в качестве модели». Drug Test Anal . 4 (7–8): 556–576. doi :10.1002/dta.1333. PMC 3722587. PMID 22517680 .
- ^ Glennon RA, Rosecrans JA (1982). «Индолалкиламиновые и феналкиламиновые галлюциногены: краткий обзор». Neurosci Biobehav Rev. 6 ( 4): 489–497. doi :10.1016/0149-7634(82)90030-6. PMID 6757811.
- ^ Николс Д.Е., Гленнон Р.А. (1984). «Медицинская химия и связь структуры и активности галлюциногенов» (PDF) . Галлюциногены: нейрохимические, поведенческие и клинические перспективы. стр. 95–142.
- ^ Glennon RA, Rosecrans JA (1981). «Размышления о механизме действия галлюциногенных индолалкиламинов». Neurosci Biobehav Rev. 5 ( 2): 197–207. doi :10.1016/0149-7634(81)90002-6. PMID 7022271.
- ^ Sourkes TL (1991). «Альфа-метилтриптофан как терапевтический агент». Prog Neuropsychopharmacol Biol Psychiatry . 15 (6): 935–938. doi :10.1016/0278-5846(91)90020-2. PMID 1763198.
- ^ Supuran, CT; Angeli, A.; Tanini, D. (2024). Достижения в области пролекарств: дизайн и терапевтическое применение. Elsevier. стр. 296. ISBN 978-0-443-15634-2. Получено 13 ноября 2024 г.
- ^ Aboul-Enein MN, El-Azzouny AA, Saleh OA, Maklad YA (июнь 2012 г.). «О химических структурах с мощным противоэпилептическим/противосудорожным профилем». Mini Rev Med Chem . 12 (7): 671–700. doi :10.2174/138955712800626665. PMID 22512548.
- ^ Goldberg JS (август 2010 г.). «Выбранные эфиры гамма-аминомасляной кислоты (ГАМК) могут оказывать анальгезирующее действие при некоторых состояниях центральной боли». Perspect Medicin Chem . 4 : 23–31. doi :10.4137/pmc.s5490. PMC 2918363. PMID 20703328 .
- ^ Santillo MF, Sprando RL (апрель 2023 г.). «Пикамилон, аналог γ-аминомасляной кислоты (ГАМК) и продаваемый ноотроп, неактивен против 50 биологических целей». Basic Clin Pharmacol Toxicol . 132 (4): 355–358. doi :10.1111/bcpt.13836. PMID 36668678.
- ^ Bianchi M, Quadro G, Mourier G, Galzigna L (1983). «Фармакокинетика и in vitro эффекты производного 4-аминомасляной кислоты с противосудорожным действием». Фармакология . 27 (4): 237–240. doi :10.1159/000137876. PMID 6634934.
- ^ ab Storer, R. James; Ferrante, Antonio (10 октября 1997 г.). "Радиохимический анализ диаминооксидазы". Протоколы полиаминов . Методы в молекулярной биологии. Т. 79. Нью-Джерси: Humana Press. стр. 91–96. doi :10.1385/0-89603-448-8:91. ISBN 978-0-89603-448-8. PMID 9463822.
В биологических смесях γ-аминомасляный альдегид может быть альтернативно окислен альдегиддегидрогеназами (EC 1.2.1.3) до γ-аминомасляной кислоты (ГАМК) (11—13). Образование 4-амино-1-бутанола также возможно путем восстановления альдегиддегидрогеназой и/или алкогольдегидрогеназой (13,14), что предотвращает циклизацию. Другие судьбы путресцина в биологических смесях включают ацетилирование в ацетилпутресцин N-ацетилтрансферазой и затем окисление моноаминоксидазой (EC 1.4.3.4) (11,17). [...] Рис. 1 Судьбы путресцина в биологических смесях
- ^ ab Felmlee MA, Morse BL, Morris ME (январь 2021 г.). "γ-Гидроксимасляная кислота: фармакокинетика, фармакодинамика и токсикология". AAPS J . 23 (1): 22. doi :10.1208/s12248-020-00543-z. PMC 8098080 . PMID 33417072.
- ^ Рашми, Део; Занан, Рахул; Джон, Шиба; Хандагале, Киран; Надаф, Альтафхузейн (2018). «γ-аминомасляная кислота (ГАМК): биосинтез, роль, коммерческое производство и применение». Исследования в области химии натуральных продуктов. Том. 57. Эльзевир. стр. 413–452. дои : 10.1016/b978-0-444-64057-4.00013-2. ISBN 978-0-444-64057-4.
Также сообщалось об альтернативных путях синтеза ГАМК из путресцина и других полиаминов [207–211]. Здесь γ-аминомасляный альдегид, промежуточный продукт реакции деградации полиамина через комбинированную активность диаминоксидазы (DAO, EC 1.4.3.6) и 4-аминомасляный альдегиддегидрогеназы (ABALDH), приводит к синтезу ГАМК [205,212,213]. В ответ на абиотические стрессы также сообщается, что ГАМК синтезируется из пролина через промежуточное образование D1-пирролина [47,205,214], а также посредством неферментативной реакции [214]. Однако синтез ГАМК из полиаминовых путей незначителен в мозге [215], хотя они играют важную роль в развитии мозга [216] и сетчатки [217]. Но ГАМК может образовываться из путресцина в мозге млекопитающих [218].
- ^ Benedetti MS, Dostert P (1994). «Вклад аминоксидаз в метаболизм ксенобиотиков». Drug Metab Rev. 26 ( 3): 507–535. doi :10.3109/03602539408998316. PMID 7924902.
МАО также катализирует дезаминирование естественного компонента мозга, моноацетилпутресцина, производя γ-ацетиламиномасляный альдегид, который, в свою очередь, участвует в образовании ГАМК мозга [13].
- ^ Tay E, Lo WK, Murnion B (2022). «Текущие взгляды на влияние злоупотребления гамма-гидроксибутиратом (GHB)». Subst Abuse Rehabil . 13 : 13–23. doi : 10.2147/SAR.S315720 . PMC 8843350. PMID 35173515 .
- ^ Parnetti L, Mignini F, Thomassoni D, Traini E, Amenta F (июнь 2007 г.). «Холинергические предшественники в лечении когнитивных нарушений сосудистого происхождения: неэффективные подходы или необходимость повторной оценки?». J Neurol Sci . 257 (1–2): 264–269. doi :10.1016/j.jns.2007.01.043. PMID 17331541.