Миофибробласт
| Миофибробласт | |
|---|---|
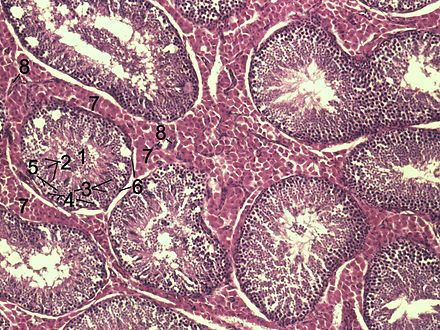 Гистологический срез паренхимы яичек хряка . 1. Просвет семенного канальца , 2. Сперматиды , 3. Сперматоциты , 4. Сперматогонии , 5. Клетки Сертоли , 6. Миофибробласты , 7. Клетки Лейдига , 8. Капилляры. | |
| Подробности | |
| Идентификаторы | |
| латинский | миофибробластус |
| МеШ | Д058628 |
| ТН | H2.00.03.0.01013 |
| Анатомические термины микроанатомии [править на Wikidata] | |
Миофибробласт — это фенотип клетки , который впервые был описан как находящийся в состоянии между фибробластом и гладкомышечной клеткой.
Структура
Миофибробласты представляют собой сократительные веретенообразные клетки, которые можно идентифицировать по экспрессии ими α-гладкомышечного актина в их цитоплазматических стрессовых волокнах . [1]
В желудочно-кишечном и мочеполовом трактах миофибробласты находятся субэпителиально на слизистых поверхностях. Здесь они не только выполняют функцию регулятора формы крипт и ворсинок, но и действуют как стволовые клетки ниши в кишечных криптах и как части атипичных антигенпрезентирующих клеток. Они выполняют как опорную, так и паракринную функцию в большинстве мест.
Расположение
Миофибробласты были впервые обнаружены в грануляционной ткани во время заживления ран кожи. [2] Обычно эти клетки находятся в грануляционной ткани, рубцовой ткани (фиброзе) и строме опухолей. Они также выстилают желудочно-кишечный тракт, где регулируют форму крипт и ворсинок.
Маркеры
Миофибробласты обычно окрашиваются на промежуточный филамент виментин , который является общим мезенхимальным маркером, α-гладкомышечный актин (человеческий ген = ACTA2 ), и на палладин , который является цитоскелетным актиновым каркасным белком . Они положительны на другие маркеры гладких мышц, такие как промежуточный филаментный тип десмина в некоторых тканях, но могут быть отрицательными на десмин в других тканях. Подобная гетерогенная позитивность может существовать почти для каждого маркера гладких мышц, за исключением, вероятно, нескольких, которые положительны только в сократительных гладких мышцах, таких как метавинкулин и смузеллин .
Миофибробласты повышают экспрессию фибронектина , коллагенов и гиалуроновой кислоты во время и после их дифференциации из фибробластов. Среди них изоформа EDA фибронектина (EDA-FN) и коллаген типа I ( COL1A1 / COL1A2 ) являются типичными маркерами миофибробласт-зависимого синтеза профиброзного внеклеточного матрикса.
Некоторые миофибробласты (особенно если они имеют звездчатую форму) также могут быть положительными по GFAP .
Разработка
Существует множество возможных путей развития миофибробластов:
- Частичная дифференцировка гладкой мускулатуры фибробластической клетки
- Активация звездчатых клеток (например, клеток Ито печени или звездчатых клеток поджелудочной железы ).
- Утрата сократительного фенотипа (или приобретение «синтетического фенотипа») гладкомышечной клетки.
- Прямая миофибробластическая дифференцировка прогениторной клетки, находящейся в стромальной ткани.
- Возвращение и привлечение циркулирующего мезенхимального предшественника, который может напрямую дифференцироваться, как описано выше, или косвенно дифференцироваться через другие типы клеток в качестве промежуточных продуктов.
- Эпителиально-мезенхимальная трансдифференцировка ( ЭМП ) эпителиальной клетки .
Возможно, наиболее изученным путем формирования миофибробластов является зависимая от TGF-beta1 дифференциация из клеток фибробластов . Активация рецептора TGF-beta 1 и рецептора TGF-beta 2 приводит к индукции канонического пути SMAD2 / SMAD3 . [3] Вместе с коактивацией неканонического пути EGFR эти события приводят к повышению регуляции гена ACTA2 и последующей продукции белка альфа-актина гладких мышц. Было описано несколько регуляторов пути дифференциации миофибробластов, включая активацию гиалуронана и корецептора CD44 EGFR. [4]

Функция
Во многих органах, таких как печень, легкие и почки, они в первую очередь участвуют в фиброзе. В раневой ткани они участвуют в укреплении раны путем внеклеточного отложения коллагеновых волокон, а затем в сокращении раны путем внутриклеточного сокращения и сопутствующего выравнивания коллагеновых волокон путем опосредованного интегрином натяжения на коллагеновые пучки. Перициты и почечные мезангиальные клетки являются некоторыми примерами модифицированных миофибробластоподобных клеток.
Миофибробласты могут мешать распространению электрических сигналов [5], контролирующих сердечный ритм, [6] что приводит к аритмии как у пациентов, перенесших сердечный приступ, так и у плодов. Урсодиол является многообещающим препаратом для лечения этого состояния. [7]
Заживление ран
Миофибробласты могут сокращаться, используя комплекс актина-миозина гладкомышечного типа, богатый формой актина, называемой альфа-гладкомышечным актином. Затем эти клетки способны ускорять заживление раны, сокращая ее края.
Ранние исследования заживления ран показали, что грануляционная ткань, взятая из раны, может сокращаться in vitro (или в ванне для органов) аналогично гладким мышцам при воздействии веществ, вызывающих сокращение гладких мышц, таких как адреналин или ангиотензин .
Совсем недавно было показано, что фибробласты могут трансформироваться в миофибробласты с помощью фотобиомодуляции .
После полного заживления эти клетки погибают в результате апоптоза , и предполагается, что при некоторых фиброзных заболеваниях (например, циррозе печени , фиброзе почек, ретроперитонеальном фиброзе) этот механизм не работает, что приводит к сохранению миофибробластов и, как следствие, расширению внеклеточного матрикса (фиброзу) с сокращением.
Аналогично, в ранах, которые не заживают и превращаются в келоиды или гипертрофические рубцы , миофибробласты могут сохраняться, а не исчезать путем апоптоза. [8]
Смотрите также
Ссылки
- ^ Тай, Ифань; Вудс, Эмма Л.; Далли, Джорданна; Конг, Делинг; Стедман, Роберт; Мозели, Райан; Мидгли, Адам К. (август 2021 г.). «Миофибробласты: функция, формирование и область применения молекулярной терапии фиброза кожи». Биомолекулы . 11 ( 8): 1095. doi : 10.3390/biom11081095 . PMC 8391320. PMID 34439762.
- ^ Majno, G.; Gabbiani, G.; Hirschel, BJ; Ryan, GB; Statkov, PR (1971-08-06). «Сокращение грануляционной ткани in vitro: сходство с гладкой». Science . 173 (3996): 548–Muscle550. Bibcode :1971Sci...173..548M. doi :10.1126/science.173.3996.548. ISSN 0036-8075. PMID 4327529. S2CID 36685378.
- ^ Evans RA, Tian YC, Steadman R, Phillips AO (январь 2003 г.). «Терминальная дифференцировка фибробластов и миофибробластов, опосредованная TGF-beta1 — роль белков Smad». Experimental Cell Research . 282 (2): 90– 100. doi :10.1016/S0014-4827(02)00015-0. PMID 12531695.
- ^ Midgley AC, Rogers M, Hallett MB, Clayton A, Bowen T, Phillips AO, Steadman R (май 2013 г.). «Трансформация стимулированного фактором роста β1 (TGF-β1) фибробласта в дифференцировку миофибробластов опосредована гиалуроновой кислотой (HA)-облегченным эпидермальным рецептором фактора роста (EGFR) и совместной локализацией CD44 в липидных плотах». Журнал биологической химии . 288 (21): 14824–38 . doi : 10.1074/jbc.M113.451336 . PMC 3663506. PMID 23589287 .
- ^ Quinn TA, Camelliti P, Rog-Zielinska EA, Siedlecka U, Poggioli T, O'Toole ET, Knöpfel T, Kohl P (декабрь 2016 г.). «Электротоническое сопряжение возбудимых и невозбудимых клеток сердца, выявленное с помощью оптогенетики». Труды Национальной академии наук Соединенных Штатов Америки . 113 (51): 14852– 14857. Bibcode : 2016PNAS..11314852Q. doi : 10.1073/pnas.1611184114 . PMC 5187735. PMID 27930302 .
- ^ Gourdie RG, Dimmeler S, Kohl P (сентябрь 2016 г.). «Новые терапевтические стратегии, нацеленные на фибробласты и фиброз при сердечных заболеваниях». Nature Reviews. Drug Discovery . 15 (9): 620–38 . doi :10.1038/nrd.2016.89. PMC 5152911. PMID 27339799 .
- ^ Новости BBC
- ^ Frangogiannis NG (2017). «Внеклеточный матрикс при повреждении миокарда, восстановлении и ремоделировании». J Clin Invest . 127 (5): 1600– 1612. doi :10.1172/JCI87491. PMC 5409799. PMID 28459429 .

