Сульфат ртути(I)
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Сульфат ртути(I) | |
| Другие имена Сульфат ртути | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| Информационная карта ECHA | 100.029.084 |
| Номер ЕС |
|
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| Характеристики | |
| Hg2SO4 | |
| Молярная масса | 497,24 г/моль |
| Появление | беловато-желтые кристаллы |
| Плотность | 7,56 г/см 3 |
| 0,051 г/100 мл (25 °С) 0,09 г/100 мл (100 °С) | |
Произведение растворимости ( K sp ) | 6,5 × 10−7 [ 1 ] |
| Растворимость | растворим в разбавленной азотной кислоте , нерастворим в воде , растворим в горячей серной кислоте . |
| −123,0·10 −6 см 3 /моль | |
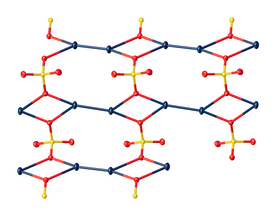
| Структура | |
| моноклинный | |
| Термохимия | |
Теплоемкость ( С ) | 132 Дж·моль −1 ·К −1 [2] |
Стандартная молярная энтропия ( S ⦵ 298 ) | 200,7 Дж·моль −1 ·К −1 |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | -743,1 кДж·моль −1 |
| Родственные соединения | |
Другие анионы | Фторид ртути (I) Хлорид ртути (I) Бромид ртути (I) Йодид ртути (I) |
Другие катионы | Сульфат ртути(II) Сульфат кадмия Сульфат таллия(I) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Сульфат ртути (I) , обычно называемый сульфатом ртути ( Великобритания ) или сульфатом ртути ( США ), является химическим соединением Hg 2 SO 4 . [3] Сульфат ртути (I) — это металлическое соединение, представляющее собой белый, бледно-желтый или бежевый порошок. [4] Это металлическая соль серной кислоты, образованная путем замены обоих атомов водорода ртутью (I). Он очень токсичен; он может быть смертельным при вдыхании, проглатывании или впитывании кожей.
Структура

В кристалле сульфат ртути состоит из центра Hg 2 2+ с расстоянием Hg-Hg около 2,50 Å. Анионы SO 4 2− образуют как длинные, так и короткие связи Hg-O в диапазоне от 2,23 до 2,93 Å. [5]
Если рассматривать более короткие связи Hg-O, то угол связи Hg – Hg – O составляет 165°±1°. [6] [7]
Подготовка
Одним из способов приготовления сульфата ртути(I) является смешивание кислого раствора нитрата ртути(I) с 1-6 раствором серной кислоты :, [8] [9]
- Hg2 ( NO3 ) 2 + H2SO4 → Hg2SO4 + 2HNO3
Его также можно получить путем реакции избытка ртути с концентрированной серной кислотой : [8]
- 2Hg + 2H2SO4 → Hg2SO4 + 2H2O + SO2
Использование в электрохимических ячейках
Сульфат ртути (I) часто используется в электрохимических ячейках . [10] [11] [12] Впервые он был введен в электрохимические ячейки Латимером Кларком в 1872 году, [13] Затем он был альтернативно [ требуется разъяснение ] использован в ячейках Уэстона, изготовленных Джорджем Августом Хьюлеттом в 1911 году. [13] Было обнаружено, что он является хорошим электродом при высоких температурах выше 100 °C вместе с сульфатом серебра. [14]
Установлено, что сульфат ртути(I) разлагается при высоких температурах. Процесс разложения эндотермический и происходит между 335 °C и 500 °C.
Сульфат ртути(I) обладает уникальными свойствами, которые делают возможными стандартные ячейки. Он имеет довольно низкую растворимость (около одного грамма на литр); диффузия из катодной системы не является чрезмерной; и его достаточно, чтобы дать большой потенциал на ртутном электроде. [15]
Ссылки
- ^ Джон Рамбл (18 июня 2018 г.). CRC Handbook of Chemistry and Physics (99-е изд.). CRC Press. стр. 5–189 . ISBN 978-1-138-56163-2.
- ^ Лид, Дэвид Р. (1998), Справочник по химии и физике (87-е изд.), Бока-Ратон, Флорида: CRC Press, стр. 5–19 , ISBN 0-8493-0594-2
- ↑ «Промежуточная неорганическая химия» Дж. У. Меллора, опубликовано Longmans, Green and Company, Лондон, 1941, стр. 388.
- ^ "Сульфат ртути | 7783-36-0".
- ^ Маттиас Вайль; Михаэль Пухбергер; Энрике Дж. Баран ( 2004 ). «Подготовка и характеристика димеркури(I)монофторфосфата(V), Hg2PO3F : кристаллическая структура, термическое поведение, колебательные спектры и твердотельные 31 P и 19 F ЯМР-спектры». Inorg. Chem . 43 (26): 8330– 8335. doi :10.1021/ic048741e. PMID 15606179.
- ^ Дорм, Э. (1969). «Структурные исследования соединений ртути (I). VI. Кристаллическая структура сульфата и селената ртути (I)». Acta Chemica Scandinavica . 23 : 1607– 15. doi : 10.3891/acta.chem.scand.23-1607 .
- ^ Вайль, Маттиас (2014). «Кристаллическая структура Hg2SO4– переопределение». Acta Crystallographica Section E. 70 ( 9): i44. doi :10.1107/S1600536814011155. PMC 4186147. PMID 25309168 .
- ^ ab результат Google Books, просмотрено 11 декабря 2010 г.
- ^ Сульфат ртути, сульфат кадмия и кадмиевый элемент. Хьюлетт ГА Физический обзор. 1907. стр. 19.
- ^ «Влияние микроструктуры на свойства хранения заряда химически синтезированного диоксида марганца» Матье Тупена, Тьери Брусса и Даниэля Беланже. Chem. Mater. 2002, 14, 3945–3952
- ^ "Исследования электродвижущей силы ячейки, Cd x Hg y | CdSO 4 ,(m) I Hg 2 SO 4 , Hg, в среде диоксан-вода" Сомеша Чакрабарти и Сукумара Адитьи. Журнал химических и инженерных данных , том 17, № 1, 1972 г.
- ^ «Характеристика сульфата лития как солевого мостика с несимметричной валентностью для минимизации потенциалов жидкостного перехода в смесях водных и органических растворителей» Кристианы Л. Фаверио, Патриции Р. Муссини и Торквато Муссини. Anal. Chem. 1998, 70, 2589–2595
- ^ ab "Джордж Августус Хьюлетт: от жидких кристаллов до стандартной ячейки" Джона Т. Стока. Bull. Hist. Chem. Том 25, Номер 2, 2000, стр. 91-98
- ^ Литцке, МХ; Стоутон, РВ (ноябрь 1953 г.). «Поведение серебряно-сульфатных и ртутно-сульфатных электродов при высоких температурах 1». Журнал Американского химического общества . 75 (21): 5226– 5227. doi :10.1021/ja01117a024.(требуется подписка)
- ^ «Сульфаты ртути и стандартные ячейки». Эллиотт, Р. Б. и Хьюлетт, ГА. Журнал физической химии 36.7 (1932): 2083–2086.


