Реакция Джонсона-Кори-Чайковского
| Реакция Джонсона-Кори-Чайковского | |
|---|---|
| Назван в честь | А. Уильям Джонсон Элиас Джеймс Кори Майкл Чайковский |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Портал органической химии | corey-chaykovsky-реакция |
Реакция Джонсона –Кори–Чайковского (иногда называемая реакцией Кори–Чайковского или CCR ) — химическая реакция, используемая в органической химии для синтеза эпоксидов , азиридинов и циклопропанов . Она была открыта в 1961 году А. Уильямом Джонсоном и значительно развита Э. Дж. Кори и Майклом Чайковским. Реакция включает присоединение илида серы к кетону , альдегиду , имину или енону для получения соответствующего 3-членного кольца. Реакция является диастереоселективной, благоприятствующей транс -замещению в продукте независимо от исходной стереохимии . Синтез эпоксидов с помощью этого метода служит важной ретросинтетической альтернативой традиционным реакциям эпоксидирования олефинов .

Реакция чаще всего используется для эпоксидирования через перенос метиленовой группы , и с этой целью использовалась в нескольких известных полных синтезах (см. Синтез эпоксидов ниже). Ниже дополнительно подробно описаны история, механизм, область применения и энантиоселективные варианты реакции. Было опубликовано несколько обзоров. [1] [2] [3] [4] [5] [6]
История
Первоначальная публикация Джонсона касалась реакции 9-диметилсульфония флуоренилида с замещенными производными бензальдегида . Попытка реакции типа Виттига не удалась, и вместо нее был получен оксид бензалфлуорена, отмечая, что «реакция между серным илидом и бензальдегидами не дала бензалфлуоренов, как это сделали фосфорный илид и илид мышьяка». [7]

Последующая разработка (диметилоксосульфанийил)метанида, (CH 3 ) 2 SOCH 2 и (диметилсульфанийил)метанида, (CH 3 ) 2 SCH 2 (известных как реагенты Кори–Чайковского ) Кори и Чайковским в качестве эффективных реагентов переноса метиленовой группы установила реакцию как часть органического канона. [8]

Механизм
Механизм реакции Джонсона-Кори-Чайковского состоит из нуклеофильного присоединения илида к карбонильной или иминной группе. Отрицательный заряд переносится на гетероатом , и поскольку сульфониевый катион является хорошей уходящей группой, он выталкивается, образуя кольцо. В родственной реакции Виттига образование гораздо более сильной двойной связи фосфор - кислород предотвращает образование оксирана , и вместо этого происходит олефинирование через 4-членный циклический промежуточный продукт. [4] [9]

Наблюдаемая транс- диастереоселективность является результатом обратимости начального добавления, что позволяет достичь равновесия с предпочтительным анти- бетаином по сравнению с син- бетаином. Начальное добавление илида приводит к бетаину с соседними зарядами; расчеты теории функционала плотности показали, что лимитирующим шагом является вращение центральной связи в конформер, необходимый для атаки с обратной стороны на сульфоний. [1]

Степень обратимости на начальном этапе (и, следовательно, диастереоселективность) зависит от четырех факторов, причем большая обратимость соответствует большей селективности: [1]
- Стабильность субстрата с более высокой стабильностью, приводящей к большей обратимости, за счет предпочтения исходного материала по сравнению с бетаином.
- Стабильность илида с более высокой стабильностью аналогично приводит к большей обратимости.
- Стерические затруднения в бетаине, большие затруднения приводят к большей обратимости, препятствуя образованию промежуточного продукта и замедляя ограничивающее скорость вращение центральной связи.
- Сольватация зарядов в бетаине противоионами, такими как литий, с большей сольватацией, что обеспечивает более легкое вращение в промежуточном бетаине, снижая степень обратимости.
Объем
Применение реакции Джонсона-Кори-Чайковского в органическом синтезе разнообразно. Реакция стала охватывать реакции многих типов серных илидов с электрофилами далеко за пределами оригинальных публикаций. Она использовалась в ряде громких полных синтезов, как подробно описано ниже, и, как правило, признается мощным преобразующим инструментом в органическом репертуаре.
Типы илидов

Многие типы илидов могут быть получены с различными функциональными группами как на анионном углеродном центре, так и на сере. Схема замещения может влиять на простоту приготовления реагентов (обычно из галогенида сульфония, например, триметилсульфонийиодида ) и общую скорость реакции различными способами. Общий формат реагента показан справа. [1]
Использование сульфоксония позволяет более легко приготовить реагент с использованием более слабых оснований по сравнению с сульфониевыми илидами. (Разница в том, что сульфоксоний содержит дважды связанный кислород, тогда как сульфоний не содержит.) Первые реагируют медленнее из-за их повышенной стабильности. Кроме того, диалкилсульфоксидные побочные продукты сульфоксониевых реагентов намного предпочтительнее значительно более токсичных, летучих и пахучих диалкилсульфидных побочных продуктов сульфониевых реагентов. [1]
Подавляющее большинство реагентов монозамещены у илидного углерода (либо R 1 , либо R 2 как водород). Дизамещенные реагенты встречаются гораздо реже, но были описаны: [1]
- Если углерод илида замещен электроноакцепторной группой (EWG), реагент называется стабилизированным илидом . Они, подобно сульфоксониевым реагентам, реагируют гораздо медленнее и обычно их легче приготовить. Они ограничены в своей полезности, поскольку реакция может стать чрезмерно вялой: примеры с участием амидов широко распространены, гораздо меньше примеров с участием эфиров и практически нет примеров с участием других EWG. Для них обычно более подходящей является родственная реакция Дарзенса .
- Если углерод илида замещен арильной или аллильной группой, реагент называется полустабилизированным илидом . Они были разработаны в значительной степени, уступая только классическим метиленовым реагентам (R 1 =R 2 =H). Модель замещения в арильных реагентах может сильно влиять на селективность реакции в соответствии с критериями выше.
- Если углерод илида замещен алкильной группой, реагент называется нестабилизированным илидом . Размер алкильных групп является основным фактором селективности этих реагентов.
R-группы на сере, хотя обычно это метильные группы , использовались для синтеза реагентов, которые могут выполнять энантиоселективные варианты реакции (см. Варианты ниже). Размер групп также может влиять на диастереоселективность в алициклических субстратах. [1]
Синтез эпоксидов
Реакции серных илидов с кетонами и альдегидами с образованием эпоксидов являются наиболее распространенным применением реакции Джонсона-Кори-Чайковского. Примеры, включающие сложные субстраты и «экзотические» илиды, были описаны ниже. [10] [11]

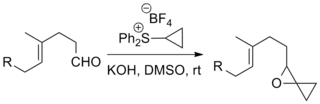
Реакция использовалась в ряде известных полных синтезов, включая полный синтез таксола Данишефского , в результате которого получается химиотерапевтический препарат таксол , и полный синтез стрихнина Кюне, в результате которого получается пестицид стрихнин . [12] [13]


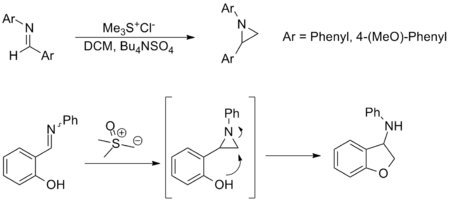
Синтез азиридинов
Синтез азиридинов из иминов является еще одним важным применением реакции Джонсона-Кори-Чайковского и обеспечивает альтернативу переносу амина из оксазиридинов . Хотя реакция применяется менее широко, она имеет схожий субстратный охват и функциональную групповую толерантность к карбонильному эквиваленту. Приведенные ниже примеры являются репрезентативными; в последнем случае азиридин образуется in situ и раскрывается посредством нуклеофильной атаки с образованием соответствующего амина . [3] [10]
Синтез циклопропанов
Для присоединения серных илидов к енонам более высокая 1,4-селективность обычно достигается с сульфоксониевыми реагентами, чем с сульфониевыми реагентами. Одно объяснение, основанное на теории HSAB, гласит, что это происходит потому, что сульфоксониевые реагенты имеют менее концентрированный отрицательный заряд на атоме углерода (мягче), поэтому он предпочитает 1,4-атаку на более мягкий нуклеофильный сайт. Другое объяснение, подкрепленное исследованиями теории функционала плотности (DFT), предполагает, что необратимая 1,4-атака, приводящая к циклопропану, энергетически выгодна по сравнению с обратимой 1,2-атакой, которая привела бы к эпоксиду. [14] В расширенных сопряженных системах 1,6-присоединение имеет тенденцию преобладать над 1,4-присоединением. [3] [10] Было показано, что многие электроноакцепторные группы способствуют циклопропанированию, включая кетоны , сложные эфиры , амиды (пример ниже включает амид Вайнреба ), сульфоны , нитрогруппы , фосфонаты , изоцианиды и даже некоторые электронодефицитные гетероциклы. [15]

Другие реакции
Помимо реакций, первоначально описанных Джонсоном, Кори и Чайковским, илиды серы использовались для ряда родственных реакций гомологизации , которые, как правило, объединяются под одним названием.
- С эпоксидами и азиридинами реакция служит для расширения кольца с получением соответствующего оксетана или азетидина . Длительное время реакции, необходимое для этих реакций, не позволяет им протекать как существенные побочные реакции при синтезе эпоксидов и азиридинов. [10]

- Сообщалось о нескольких реакциях циклоприсоединения , в которых илид служит « нуклеофильным эквивалентом карбеноида ». [10]
![[4+1] циклоприсоединение с реагентом Кори–Чайковского](http://upload.wikimedia.org/wikipedia/commons/thumb/c/cc/CCR41.png/320px-CCR41.png)
- Сообщалось о живой полимеризации с использованием триалкилборанов в качестве катализатора и (диметилоксосульфанийил)метанида в качестве мономера для синтеза различных сложных полимеров. [16]

Энантиоселективные вариации
Разработка энантиоселективного ( т.е. дающего энантиомерный избыток , который обозначается как «ee») варианта реакции Джонсона–Кори–Чайковского остается активной областью академических исследований. Использование хиральных сульфидов в стехиометрическом режиме оказалось более успешным, чем соответствующие каталитические варианты, но область применения субстрата все еще ограничена во всех случаях. Каталитические варианты были разработаны почти исключительно для энантиоселективных целей; типичные органосульфидные реагенты не являются чрезмерно дорогими, и рацемические реакции могут быть проведены с эквимолярными количествами илида без значительного увеличения затрат. Хиральные сульфиды, с другой стороны, более дороги в приготовлении, что стимулирует развитие каталитических энантиоселективных методов. [2]
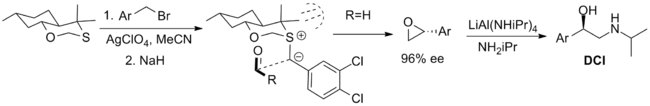
Стехиометрические реагенты
Наиболее успешные реагенты, используемые в стехиометрическом режиме, показаны ниже. Первый — это бициклический оксатиан, который использовался в синтезе β-адренергического соединения дихлоризопротеренола (DCI), но ограничен доступностью только одного энантиомера реагента. Синтез аксиального диастереомера рационализируется с помощью 1,3- аномерного эффекта , который снижает нуклеофильность экваториальной неподеленной пары . Конформация илида ограничена трансаннулярным напряжением , а подход альдегида ограничен одной стороной илида стерическими взаимодействиями с метильными заместителями. [5] [2]
Другим основным реагентом является реагент, полученный из камфоры, разработанный Вариндером Аггарвалом из Бристольского университета . Оба энантиомера легко синтезируются, хотя выходы ниже, чем у оксатианового реагента. Конформация илида определяется взаимодействием с мостиковыми водородами, а приближение альдегида блокируется камфорным фрагментом . В реакции используется фосфазеновое основание для содействия образованию илида. [5] [2]
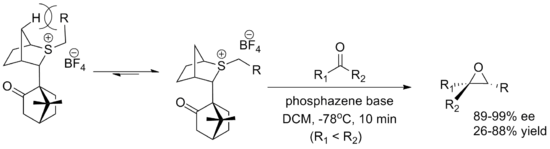
Каталитические реагенты
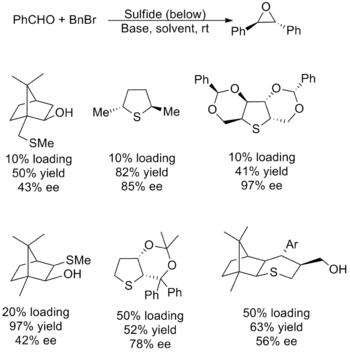
Каталитические реагенты были менее успешными, большинство вариаций страдали от низкого выхода, плохой энантиоселективности или и того, и другого. Существуют также проблемы с областью действия субстрата, большинство из которых имеют ограничения с переносом метиленовой группы и алифатическими альдегидами . Проблема возникает из-за необходимости в нуклеофильном сульфиде, который эффективно генерирует илид, который также может действовать как хорошая уходящая группа для образования эпоксида. Поскольку факторы, лежащие в основе этих желаемых продуктов, противоречат друг другу, настройка свойств катализатора оказалась сложной. Ниже показаны несколько наиболее успешных катализаторов вместе с выходами и энантиомерным избытком для их использования в синтезе оксида (E)-стилбена . [5] [2]
Аггарвал разработал альтернативный метод, использующий тот же сульфид, что и выше, и новое алкилирование с участием карбеноида родия , образованного in situ . Метод также имеет ограниченный субстратный охват, неэффективный для любых электрофилов, имеющих основные заместители, из-за конкурентного потребления карбеноида. [2]

Смотрите также
Ссылки
- ^ abcdefg Аггарвал, В.К.; Ричардсон, Дж. (2003). «Сложность катализа: истоки энантио- и диастереоконтроля в реакциях эпоксидирования, опосредованных илидом серы». Chemical Communications (21): 2644– 2651. doi : 10.1039/b304625g. PMID 14649793.
- ^ abcdef Aggarwal, VK ; Winn, CL (2004). «Каталитическое, асимметричное эпоксидирование карбонильных соединений с участием илида серы: область применения, селективность и применение в синтезе». Accounts of Chemical Research . 37 (8): 611– 620. doi :10.1021/ar030045f. PMID 15311960.
- ^ abc Гололобов, Ю.Г.; Несмеянов, А.Н.; Лысенко, В.П.; Болдескул, И.Е. (1987). "Двадцать пять лет этилиду диметилсульфоксония (реагенту Кори)". Тетраэдр . 43 (12): 2609– 2651. doi :10.1016/s0040-4020(01)86869-1.
- ^ ab Li, A.-H.; Dai, L.-X.; Aggarwal, VK (1997). "Асимметричные реакции илида: эпоксидирование, циклопропанирование, азиридинирование, олефинирование и перегруппировка". Chemical Reviews . 97 (6): 2341– 2372. doi :10.1021/cr960411r. PMID 11848902.
- ^ abcd Aggarwal, Varinder K. ; Ford, J. Gair; Fonguerna, Sílvia; Adams, Harry; Jones, Ray VH; Fieldhouse, Robin (1998-08-08). "Каталитическое асимметричное эпоксидирование альдегидов. Оптимизация, механизм и открытие стереоэлектронного контроля, включающего комбинацию аномерных и Cieplak эффектов в эпоксидировании илидов серы с хиральными 1,3-оксатианами". Журнал Американского химического общества . 120 (33): 8328– 8339. doi :10.1021/ja9812150.
- ^ McGarrigle, EM; Myers, EL; Illa, O.; Shaw, MA; Riches, SL; Aggarwal, VK (2007). «Халькогениды как органокатализаторы». Chemical Reviews . 107 (12): 5841– 5883. doi :10.1021/cr068402y. PMID 18072810.
- ^ Джонсон, AW; ЛаКаунт, RB (1961). «Химия илидов. VI. Диметилсульфонийфторенилид — синтез эпоксидов». J. Am. Chem. Soc. 83 (2): 417– 423. doi :10.1021/ja01463a040.
- ^ Corey, EJ ; Chaykovsky, M. (1965). «Диметилоксосульфоний метилид ((CH 3 ) 2 SOCH 2 ) и диметилсульфоний метилид ((CH 3 ) 2 SCH 2 ). Образование и применение в органическом синтезе». J. Am. Chem. Soc . 87 (6): 1353– 1364. doi :10.1021/ja01084a034.
- ^ Кавасима, Т.; Оказаки, Р. (1996). «Синтез и реакции промежуточных продуктов реакций Виттига, Петерсона и родственных им реакций». Synlett (7): 600–608 . doi :10.1055/s-1996-5540.
- ^ abcde Li, Jack Jie (2005). Named Reactions in Heterocyclic Chemistry. Хобокен, Нью-Джерси: John Wiley & Sons, Inc. стр. 2–14 . ISBN 9780471704140.
- ^ Манди, Брэдфорд, П.; Эллерд, Майкл Д.; Фавалоро, Фрэнк Г. младший (2005). Назвать реакции и реагенты в органической химии (2-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons, Inc. стр. 174–175 , 743. ISBN 9780471739869.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Danishefsky, SJ; Masters, JJ; Young, WB; Link, JT; Snyder, LB; Magee, TV; Jung, DK; Isaacs, RCA; Bornmann, WG; Alaimo, CA; Coburn, CA; Di Grandi, MJ (1996). "Полный синтез баккатина III и таксола". Журнал Американского химического общества . 118 (12): 2843– 2859. doi :10.1021/ja952692a.
- ^ Кюне, М. Э.; Сюй, Ф. (1993). «Полный синтез алкалоидов стрихнана и аспидосперматана. 3. Полный синтез (.+-.)-стрихнина». Журнал органической химии . 58 (26): 7490– 7497. doi :10.1021/jo00078a030.
- ^ Сян, Юй; Фань, Син; Цай, Пэй-Джун; Юй, Чжи-Сян (2019-01-23). «Понимание региоселективности реакций Кори–Чайковского диметилсульфоксоний метилида (ДМСОМ) и диметилсульфоний метилида (ДМСМ) по отношению к енонам: исследование DFT». Европейский журнал органической химии . 2019 ( 2– 3): 582– 590. doi :10.1002/ejoc.201801216. ISSN 1434-193X.
- ^ Бейтнер, Грегори Л.; Джордж, Дэвид Т. (2023-01-20). «Возможности применения и совершенствования циклопропанирования Кори–Чайковского». Organic Process Research & Development . 27 (1): 10– 41. doi :10.1021/acs.oprd.2c00315. ISSN 1083-6160.
- ^ Luo, J.; Shea, KJ (2010). «Полигомологация. Живая полимеризация C1». Accounts of Chemical Research . 43 (11): 1420– 1433. doi :10.1021/ar100062a. PMID 20825177.
Внешние ссылки
- Анимация механизма