Оксазиридин
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Оксазиридин | |
| Систематическое название ИЮПАК 1-Окса-2-азациклопропан | |
| Другие имена Оксаазиридин [1] Оксазациклопропан | |
| Идентификаторы | |
| |
3D модель ( JSmol ) |
|
| ChemSpider | |
CID PubChem |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| Характеристики | |
| С Н 3 Н О | |
| Молярная масса | 45,041 г·моль −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |

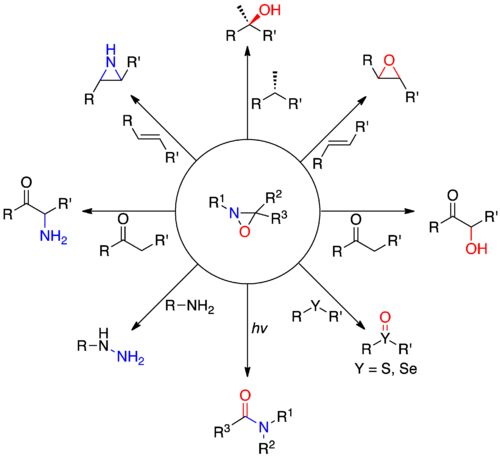
Оксазиридин — это органическая молекула , которая имеет трехчленный гетероцикл , содержащий кислород, азот и углерод. В своем самом большом применении оксазиридины являются промежуточными продуктами в промышленном производстве гидразина . Производные оксазиридина также используются в качестве специализированных реагентов в органической химии для различных окислений, включая альфа-гидроксилирование енолятов, эпоксидирование и азиридинирование олефинов и другие реакции переноса гетероатома. Оксазиридины также служат предшественниками нитронов и участвуют в [3+2]-циклоприсоединениях с различными гетерокумуленами с образованием замещенных пятичленных гетероциклов. Хиральные производные оксазиридина осуществляют асимметричный перенос кислорода на прохиральные еноляты, а также другие субстраты. Некоторые оксазиридины также обладают свойством высокого барьера для инверсии азота, что допускает возможность хиральности в азотном центре.
История
Производные оксазиридина были впервые описаны в середине 1950-х годов Эммонсом [ 2] , а затем Криммом [3] и Хорнером и Юргенсом. [4] В то время как кислород и азот обычно действуют как нуклеофилы из-за их высокой электроотрицательности , оксазиридины допускают электрофильный перенос обоих гетероатомов. Эта необычная реакционная способность обусловлена наличием сильно напряженного трехчленного кольца и относительно слабой связи NO. Нуклеофилы имеют тенденцию атаковать азот азиридина, когда заместитель азота мал (R 1 = H), и атом кислорода, когда заместитель азота имеет большую стерическую массу . Необычная электроника оксазиридиновой системы может быть использована для проведения ряда реакций переноса кислорода и азота, включая, помимо прочего: α-гидроксилирование енолятов , эпоксидирование алкенов, селективное окисление сульфидов и селенидов , аминирование N -нуклеофилов и N - ациламидирование .
Пероксидный процесс промышленного производства гидразина путем окисления аммиака перекисью водорода в присутствии кетонов был разработан в начале 1970-х годов. [5] [6]
Хиральные камфорсульфонилоксазиридины оказались полезными в синтезах сложных продуктов, таких как таксол, который продается как химиотерапевтическое средство. Как полный синтез таксола Холтона, так и полный синтез таксола Вендера характеризуются асимметричным α-гидроксилированием с камфорсульфонилоксазиридином.
Синтез
NH, N-алкил, N-арилоксазиридины
Двумя основными подходами к синтезу NH, N-алкил и N-арилоксазиридинов являются окисление иминов надкислотами ( A ) и аминирование карбонилов (B).

Кроме того, окисление хиральных иминов и окисление иминов хиральными надкислотами может дать энантиочистые оксазиридины. Некоторые оксазиридины обладают уникальным свойством конфигурационно стабильных атомов азота при комнатной температуре из-за барьера инверсии от 100 до 130 кДж/моль. Сообщается об энантиочистых оксазиридинах, где стереохимия полностью обусловлена конфигурационно стабильным азотом. [7]
Н-сульфонилоксазиридины
В конце 1970-х и начале 1980-х годов Франклин А. Дэвис синтезировал первые N -сульфонилоксазиридины, которые действуют исключительно как реагенты переноса кислорода и являются наиболее широко используемым классом оксазиридинов на сегодняшний день. [8] Первоначально синтезированные с использованием mCPBA и катализатора межфазного переноса хлорида бензилтриметиламмония, в настоящее время наиболее распространен улучшенный синтез с использованием оксона в качестве окислителя. [9]
Сегодня используются многие N-сульфонилоксазиридины, каждый из которых имеет немного отличающиеся свойства и реактивность. Эти реагенты обобщены в таблице ниже. [10] [11] [12] [13] [14] [15] [16] [17] [18]

Перфторированные оксазиридины
С сильно оттягивающими электроны перфторалкильными заместителями оксазиридины проявляют реакционную способность, более схожую с реакционную способность диоксиранов , чем типичных оксазиридинов. [19] Примечательно, что перфторалкилоксазиридины гидроксилируют определенные связи CH с высокой селективностью. Перфторированные оксазиридины могут быть синтезированы путем воздействия на перфторированный имин перфторметилфторкарбонилпероксида и фторида металла, который действует как поглотитель HF. [19]

Реакции
Производство гидразина
Оксазиридины являются промежуточными продуктами в процессе перекиси для производства гидразина . Многие миллионы килограммов гидразина производятся ежегодно этим методом, который включает стадию, на которой аммиак окисляется в присутствии метилэтилкетона с получением оксазиридина: [20]
- Me(Et)C=O + NH 3 + H 2 O 2 → Me(Et)CONH + H 2 O
На последующих этапах оксазиридин превращается в гидразон, который является непосредственным путем к гидразину:
- Me(Et)CONH + NH 3 → Me(Et)C=NNH 2 + H 2 O
Перенос кислорода
α-Гидроксилирование енолятов
α-Гидроксикетоны, или ацилоины , являются важными синтетическими мотивами, присутствующими во многих природных продуктах. α-Гидроксикетоны были синтезированы многими способами, включая восстановление α-дикетонов, замену гидроксила на уходящую группу и прямое окисление енолята. Оксодипероксимолибден(пиридин)-(гексаметилфосфорный триамид) (MoOPH) и N -сульфонилоксазиридины являются наиболее распространенными электрофильными источниками кислорода, реализованными в этом процессе. Одним из преимуществ использования N -сульфонилоксазиридинов является то, что более высокая хиральная индукция почти неизменно наблюдается по сравнению с MoOPH и другими окислителями. [21] Высокий выход (77–91%) и dr (95:5 – 99:1) сообщаются для α-гидроксилирования с хиральным вспомогательным веществом Эванса с N- сульфонилоксазиридином в качестве электрофила. [21] Хиральная индукция была продемонстрирована со многими другими хиральными кетонами и кетонами с хиральными вспомогательными веществами , включая SAMP и RAMP. [10]

Сообщалось о многочисленных работах по асимметричному гидроксилированию прохиральных енолятов с производными камфорсульфонилоксазиридина, в результате чего достигается умеренный или высокий энантиомерный избыток . [13] Общепринятое предлагаемое переходное состояние, которое оправдывает этот стереохимический результат, включает открытое переходное состояние, в котором стерическая масса R 1 определяет грань подхода. [10]

Селективность некоторых гидроксилирований может быть радикально улучшена в некоторых случаях путем добавления координирующих групп альфа к оксазиридиновому кольцу, как оксазиридины 3b и 3c в таблице выше. [16] В этих случаях предполагается, что реакция протекает через закрытое переходное состояние, где оксианион металла стабилизируется хелатированием из сульфатных и координирующих групп на скелете камфоры. [10]

α-Гидроксилирование с оксазиридинами широко применялось в общем синтезе. Это ключевой шаг как в общем синтезе таксола Холтона, так и в общем синтезе таксола Вендера . Кроме того, Форсайт реализовал трансформацию в своем синтезе системы C3-C14 (замещенный 1,7-диоксаспиро[5.5]ундец-3-ен) окадаевой кислоты . [22]

Эпоксидирование алкенов
Эпоксидирование алкенов является распространенной реакцией, поскольку эпоксиды могут быть дериватизированы несколькими полезными способами. Классически лабораторное эпоксидирование проводится с помощью mCPBA или других надкислот. Было обнаружено, что оксазиридины полезны для образования высокочувствительных к кислотам эпоксидов. [7] (−)-Хаэтоминин был синтезирован посредством эпоксидирования оксазиридина в качестве поздней стадии трансформации, как показано ниже. [23]

Другим преобразованием высокой синтетической полезности является асимметричное эпоксидирование . Существует ряд асимметричных эпоксидирований: эпоксидирование Шарплесса , эпоксидирование Якобсена-Кацуки и эпоксидирование Джулиа-Колонны . Эти методы требуют определенной функциональности для достижения селективности. Эпоксидирование Шарплесса специфично для аллиловых спиртов, эпоксидирование Якобсена требует цис -дизамещенных арилалкенов, а эпоксидирование Джулиа требует α-β ненасыщенных кетонов . Хиральные оксазиридины действуют стереоспецифично на многие нефункционализированные алкены. [7] Возможно даже осуществить стереоспецифическое эпоксидирование каталитически в хиральном звене оксазиридина. Могут потребоваться дальнейшие исследования этих реакций, прежде чем уровни энантиометичекого избытка станут практичными для крупномасштабного синтеза. Lusinichi et al. исследовали асимметричное эпоксидирование с хиральной солью оксазиридиния, используя оксон в качестве стехиометрического окислителя, как показано ниже. [24]

Гидроксилирование неактивированных углеводородов
Известно, что перфторированные оксазиридины гидроксилируют неактивированные углеводороды с замечательной регио- и диастереоспецифичностью. [19] Это очень желанная трансформация, и подобная реакционная способность и специфичность редко встречаются, особенно учитывая неметаллическую природу окислителя. Перфторированные оксазиридины демонстрируют высокую селективность по отношению к третичным водородам. Гидроксилирование первичных углеродов и дигидроксилирование соединения с двумя окисляемыми участками никогда не наблюдались. Сохранение стереохимии очень высокое, часто от 95 до 98%. (Сохранение стереохимии может быть дополнительно усилено добавлением фторидной соли). [25]

Перенос азота
Оксазиридины с незамещенным или ацилированным азотом способны переносить атом азота, хотя этой реакционной способности уделяется значительно меньше внимания. [26]
АминированиеН-нуклеофилы
Аминирование нуклеофилов с N -незамещенными оксазиридинами весьма универсально в широте возможных нуклеофилов и соответствующих продуктов. Гидразины могут быть получены из аминирования вторичных или третичных аминов, гидроксиламин и тиогидроксамины могут быть образованы из соответствующих спиртов и тиолов , сульфимиды могут быть образованы из тиоэфиров , а α-аминокетоны могут быть образованы атакой соответствующих енолятов. [27]

Н-ациламидирование
Перенос ацилированных аминов сложнее, чем незамещенных аминов, хотя, в отличие от переноса аминов оксазиридинами, не существует альтернативных методов, которые напрямую переносят ацилированные амины. [27] Перенос ацилированных аминов в основном осуществлялся с использованием аминов и гидразинов в качестве нуклеофилов. Было успешно осуществлено очень мало переносов ацилированных азотов на углеродные нуклеофилы, хотя некоторые из них существуют в литературе. [27]

Перестановки
Было обнаружено, что оксазиридины подвергаются реакциям перегруппировки через радикальный механизм при облучении УФ-светом или в присутствии одного электронного переносящего реагента, такого как Cu I. Спироциклические оксазиридины подвергаются кольцевым расширениям до соответствующего лактама. [ 28 ] Мигрирующий заместитель определяется стереоэлектронным эффектом , где группа транс к неподеленной паре на азоте всегда будет преобладающим продуктом миграции. [29] В свете этого эффекта можно воспользоваться хиральным азотом из-за высокого барьера инверсии, чтобы направить перегруппировку. Это явление демонстрируется наблюдаемой селективностью в перегруппировках ниже. В перегруппировке слева наблюдается исключительно термодинамически неблагоприятный продукт, в то время как в реакции справа продукт, полученный из менее стабильного радикального промежуточного соединения, является предпочтительным. [28]

Обэ использует эту перегруппировку как ключевой шаг в своем синтезе (+)- йохимбина [28], натурального лекарства, классифицированного Национальным институтом здравоохранения как потенциально эффективное в лечении эректильной дисфункции и сексуальных проблем, вызванных селективными ингибиторами обратного захвата серотонина [30] .

Также примечательно, что оксазиридины будут термически перегруппировываться в нитроны . Цис-транс селективность полученного нитрона плохая, однако выходы хорошие или отличные. Считается, что некоторые оксазиридины рацемизируются с течением времени через промежуточный нитрон. [7]

Циклоприсоединения с гетерокумуленами
Оксазиридины подвергаются реакциям циклоприсоединения с гетерокумуленами , что приводит к образованию ряда уникальных пятичленных гетероциклов, как показано на рисунке ниже. Эта реакционная способность обусловлена напряженным трехчленным кольцом и слабой связью NO. [7]

Ссылки
- ^ "CID 15817734 - PubChem Public Chemical Database". Проект PubChem . США: Национальный центр биотехнологической информации.
- ^ Эммонс, У. Д. (1956). «Синтез оксазиранов». J. Am. Chem. Soc. 78 (23): 6208–6209. doi :10.1021/ja01604a072.
- ^ Кримм, Генрих (1958). «Убер-изонитрон». Chemische Berichte (на немецком языке). 91 (5): 1057–1068. дои : 10.1002/cber.19580910532. ISSN 0009-2940.
- ^ Хорнер, Л.; Юргенс, Э. (1957). «Notiz Über Darstellung und Eigenschaften Einiger Isonitron (Oxazirane)». Химише Берихте . 90 (10): 2184. doi :10.1002/cber.19570901010.
- ^ США 3972878, Ширманн, Жан-Пьер; Комбру, Жан и Делаваренн, Серж Ивон, «Метод получения азинов и гидразонов», выпущенный 3 августа 1976 г., переданный Produits Chimiques Ugine Kuhlmann . US 3978049, Ширманн, Жан-Пьер; Телье, Пьер и Матэ, Анри и др., «Способ получения гидразиновых соединений», выпущено 31 августа 1976 г., передано Produits Chimiques Ugine Kuhlmann .
- ^ US 4724133, Ширманн, Жан-Пьер; Комбру, Жан и Делаваренн, Серж И., «Приготовление концентрированного водного раствора гидразингидрата», выдан 09.02.1988, передан Atochem .
- ^ abcde Дэвис, ФА; Шеппард, AC (1989). «Применение оксазиридинов в органическом синтезе». Тетраэдр . 45 (18): 5703. doi :10.1016/s0040-4020(01)89102-x.
- ^ Дэвис, ФА; Стрингер, О.Д. (1982). «Химия оксазиридинов. 2. Улучшенный синтез 2-сульфонилоксазиридинов». Журнал органической химии . 47 (9): 1774. doi :10.1021/jo00348a039.
- ^ Davis, FA; Chattopadhyay, S.; Towson, JC; Lal, S.; Reddy, T. (1988). "Химия оксазиридинов. 9. Синтез 2-сульфонил- и 2-сульфамилоксазиридинов с использованием пероксимоносульфата калия (оксона)". Журнал органической химии . 53 (9): 2087. doi :10.1021/jo00244a043.
- ^ abcd Дэвис, ФА; Чен, BC (1992). «Асимметричное гидроксилирование енолятов с N-сульфонилоксазиридинами». Chem. Rev. 92 (5): 919. doi :10.1021/cr00013a008.
- ^ Дэвис, ФА; Дженкинс, Р. Х.; Авад, С. Б.; Стрингер, О. Д.; Уотсон, В. Х.; Галлой, Дж. (1982). «Химия оксазиридинов. 3. Асимметричное окисление сероорганических соединений с использованием хиральных 2-сульфонилоксазиридинов». Журнал Американского химического общества . 104 (20): 5412. doi :10.1021/ja00384a028.
- ^ Davis, FA; Reddy, RT; McCauley, JP; Przeslawski, RM; Harakal, ME; Carroll, PJ (1991). "Химия оксазиридинов. 15. Асимметричное окисление с использованием 3-замещенных 1,2-бензизотиазол 1,1-диоксид оксидов". Журнал органической химии . 56 (2): 809. doi :10.1021/jo00002a056.
- ^ Аб Таусон, JC; Вейсмиллер, MC; Лал, СГ; Шеппард, AC; Дэвис, Ф.А. (1990). «(+)-(2R,8aS)-10-(КАМФОРИЛСУЛЬФОНИЛ)ОКСАЗИРИДИН». Орг. Синтез. 69 : 158. дои : 10.15227/orgsyn.069.0158.
- ^ Davis, FA; Towson, JC; Weismiller, MC; Lal, S.; Carroll, PJ (1988). "Химия оксазиридинов. 11. (Камфорилсульфонил)оксазиридин: синтез и свойства". Журнал Американского химического общества . 110 (25): 8477. doi :10.1021/ja00233a025.
- ^ Бах, RD; Кодденс, BA; Макдуалл, JJW; Шлегель, HB; Дэвис, FA (1990). «Механизм переноса кислорода от оксазиридина к сульфиду и сульфоксиду: теоретическое исследование». Журнал органической химии . 55 (10): 3325. doi :10.1021/jo00297a062.
- ^ ab Davis, FA; Kumar, A.; Chen, BC (1991). "Химия оксазиридинов. 16. Короткий, высокоэнантиоселективный синтез сегментов AB-кольца .gamma.-родомиционона и .alpha.-цитромицинона с использованием (+)-[(8,8-диметоксикамфорил)сульфонил]оксазиридина". Журнал органической химии . 56 (3): 1143. doi :10.1021/jo00003a042.
- ^ Davis, FA; Weismiller, MC; Lal, GS; Chen, BC; Przeslawski, RM (1989). "(Камфорилсульфонил)имин дианион в синтезе новых оптически чистых производных (камфорилсульфонил)оксазиридина". Tetrahedron Letters . 30 (13): 1613. doi :10.1016/s0040-4039(00)99534-0.
- ^ Чен, Британская Колумбия; Вейсмиллер, MC; Дэвис, ФА; Бошелли, Д.; Эмпфилд, младший; Смит, AB (1991). «Энантиоселективный синтез (+)-кельманианона». Тетраэдр . 47 (2): 173–82. дои : 10.1016/S0040-4020(01)80914-5.
- ^ abc Петров ВА, Реснати, Г (1996). "Полифторированные оксазиридины: синтез и реакционная способность". Chemical Reviews . 96 (5): 1809–1824. doi :10.1021/cr941146h. PMID 11848812.
- ^ Жан-Пьер Ширманн, Поль Бурдодук «Гидразин» в Энциклопедии промышленной химии Ульмана, Wiley-VCH, Weinheim, 2002. doi : 10.1002/14356007.a13_177.
- ^ ab Эванс, DA; Моррисси, MM; Доров, RL (1985). "Асимметричное оксигенирование хиральных имидных енолятов. Общий подход к синтезу энантиомерно чистых .альфа.-гидроксикарбоновых кислот синтонов". Журнал Американского химического общества . 107 (14): 4346. doi :10.1021/ja00300a054.
- ^ Dounay, Amy B.; Forsyth, Craig J. (1999). "Сокращенный синтез системы C3−C14 (замещенный 1,7-диоксаспиро[5.5]ундец-3-ен) окадаиновой кислоты". Org. Lett. 1 (3): 451–3. doi :10.1021/ol9906615. PMID 10822585.
- ^ Мальджезини, Беатрис; Форте, Барбара; Борги, Даниэла; Картьери, Франческа; Дженнари, Чезаре; Папео, Джанлука (2009). «Простой полный синтез (-)-хетоминина». хим. Евро. Дж. 15 (32): 7922–7929. doi : 10.1002/chem.200900793. ПМИД 19562787.
- ^ Bohé, Luis; Hanquet, Gilles; Lusinchi, Marie; Lusinchi, Xavier (1993). "Стереоспецифический синтез новой хиральной соли оксазиридиния". Tetrahedron Letters . 34 (45): 7271. doi :10.1016/S0040-4039(00)79306-3.
- ^ Арноне, Альберто; Фолетто, Стефания; Метранголо, Пьеранджело; Преньолато, Массимо; Реснати, Джузеппе (1999). «Высокоэнантиоспецифичная оксифункционализация неактивированных углеводородных участков перфтор-цис-2-н-бутил-3-н-пропилоксазиридином». Орг. Летт. 1 (2): 281. doi : 10.1021/ol990594e.
- ^ Шмитц, Э.; Оме, Р. (1964). «Изомер оксим с дрейрингструктурой». хим. Бер. 97 (9): 2521. doi :10.1002/cber.19640970916.
- ^ abc Андреа, С.; Шмитц, Э. (1991). "ChemInform Abstract: Electrophilic Aminations with Oxaziridines". ChemInform . 22 (46): 327. doi :10.1002/chin.199146339.
- ^ abc Aubé, Jeffrey (1997). «Оксизиридиновые перегруппировки в асимметричном синтезе». Chemical Society Reviews . 26 (4): 269–277. doi :10.1039/CS9972600269.
- ^ Латтес, Арман; Оливерос, Эстер; Ривьер, Моник; Белжек, Чеслав; Мостович, Данута; Абрамский, Войцех; Пиччини-Леопарди, Карла; Жермен, Габриэль; Ван Меерше, Морис (1982). "Фотохимическая и термическая перегруппировка оксазиридинов. Экспериментальные доказательства в поддержку теории стереоэлектронного контроля". Журнал Американского химического общества . 104 (14): 3929. doi :10.1021/ja00378a024.
- ^ "Йохимбе: добавки MedlinePlus". nlm.nih.gov . 19 ноября 2010 г. Получено 13 декабря 2010 г.