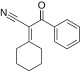
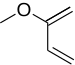
Реакция Дильса-Альдера с обратным электронным спросом

Реакция Дильса-Альдера с обратным электронным спросом , или DA INV или IEDDA [1] — это органическая химическая реакция, в которой образуются две новые химические связи и шестичленное кольцо. Она связана с реакцией Дильса-Альдера , но в отличие от реакции Дильса-Альдера (или DA), DA INV представляет собой циклоприсоединение между богатым электронами диенофилом и бедным электронами диеном . [2] В ходе реакции DA INV разрываются три пи-связи и образуются две сигма-связи и одна новая пи-связь . Прототип реакции DA INV показан справа.
Реакции DA INV часто включают гетероатомы и могут использоваться для образования гетероциклических соединений . Это делает реакцию DA INV особенно полезной в синтезах природных продуктов, где целевые соединения часто содержат гетероциклы. Недавно реакция DA INV была использована для синтеза системы транспортировки лекарств , которая нацелена на рак простаты . [3]
История
Реакция Дильса-Альдера была впервые описана в 1928 году Отто Дильсом и Куртом Альдером ; в 1950 году они были удостоены Нобелевской премии по химии за свою работу. С тех пор использование реакции Дильса-Альдера стало широко распространенным. Напротив, DA INV не имеет четкой даты начала и не имеет сравнительной известности стандартной реакции Дильса-Альдера. DA INV не имеет четкой даты открытия из-за трудностей, с которыми химики сталкивались при дифференциации нормальных и обратных реакций Дильса-Альдера с электронным спросом до появления современных вычислительных методов. [4] Большая часть работы в этой области приписывается Дейлу Богеру , хотя другие авторы опубликовали многочисленные статьи по этой теме. [2] [5]
Механизм
Формальный механизм

Механизм реакции DA INV является спорным. Хотя он принят как формальное [4+2] циклоприсоединение , не совсем понятно, является ли реакция действительно согласованной . Принятая точка зрения заключается в том, что большинство реакций DA INV происходят через асинхронный механизм. Реакция протекает через одно переходное состояние, но не все связи образуются или разрываются одновременно, как это было бы в случае согласованного механизма . [2]
Формальный механизм DA INV для реакции акролеина и метилвинилового эфира показан на рисунке справа. Хотя он не совсем точен, он дает полезную модель для реакции. В ходе реакции разрываются три пи-связи (отмечены красным) и образуются три новые связи (отмечены синим): две сигма-связи и одна новая пи-связь . [6]
Переходное состояние
Как и стандартные реакции DA, реакции DA INV протекают через переходное состояние одной лодки , несмотря на то, что они не согласованы. Переходное состояние одной лодки является упрощением, но расчеты DFT предполагают

что разница во времени разрыва и образования связей минимальна, и что, несмотря на потенциальную асинхронность, реакция согласована, при этом соответствующие связи либо частично разрываются, либо частично образуются в какой-то момент реакции. [7] Почти синхронность DA INV означает, что ее можно рассматривать аналогично стандартной реакции Дильса-Альдера. [2]
Реакцию можно смоделировать с использованием закрытого, похожего на лодку переходного состояния, при этом все связи находятся в процессе формирования или разрыва в некоторой заданной точке, и, следовательно, должны подчиняться общим правилам отбора Вудворда-Хоффмана . Это означает, что для трехкомпонентной, шестиэлектронной системы все компоненты должны взаимодействовать супрафациальным образом (или один супрафациальный и два антарафациальных ). При всех супрафациальных компонентах разрешенное переходное состояние является лодкообразным; переходное состояние в виде кресла приведет к трем двухэлектронным антарафациальным компонентам. Случай кресла термически запрещен правилами Вудворда-Хоффмана. [6]
Теория молекулярных орбиталей
Стандартные реакции DA
В стандартной реакции Дильса-Альдера есть два компонента: диен , который богат электронами, и диенофил , который беден электронами. Относительное богатство электронами и дефицит электронов реагентов лучше всего можно описать визуально, на диаграмме молекулярных орбиталей . В стандартной реакции Дильса-Альдера диен , богатый электронами, имеет молекулярные орбитали, которые имеют более высокую энергию, чем орбитали диенофила, бедного электронами . Эта разница в относительных орбитальных энергиях означает, что из пограничных молекулярных орбиталей HOMO диена (HOMO диена ) и LUMO диенофила (LUMO диенофила ) более схожи по энергии, чем HOMO диенофила и LUMO диена . [2] [8] Самое сильное орбитальное взаимодействие происходит между наиболее схожими пограничными молекулярными орбиталями: HOMO диена и LUMO диенофила .

[4+2] реакции димеризации
Реакции димеризации не являются ни нормально, ни обратно ускоренными и обычно имеют низкий выход. В этом случае два мономера реагируют в режиме DA. Поскольку орбитальные энергии идентичны, нет предпочтения для взаимодействия HOMO или LUMO либо диена, либо диенофила. Низкий выход реакций димеризации объясняется теорией возмущений второго порядка . LUMO и HOMO каждого вида находятся дальше друг от друга по энергии в димеризации, чем в нормально или обратно ускоренной реакции Дильса-Альдера. Это означает, что орбитали взаимодействуют меньше, и существует более низкий термодинамический стимул для димеризации. [2]

Дильса-Альдера с обратным спросом на электроны
В реакциях димеризации диен и диенофил были одинаково богаты электронами (или одинаково бедны электронами). Если диен становится менее богатым электронами, а диенофил — более, возможная реакция циклоприсоединения [4+2] будет реакцией DA INV . В реакции DA INV LUMO- диен и HOMO- диенофил ближе по энергии, чем HOMO -диен и LUMO- диенофил . Таким образом, LUMO- диен и HOMO- диенофил являются граничными орбиталями, которые взаимодействуют наиболее сильно и приводят к образованию наиболее энергетически выгодной связи. [2] [7] [9]

Региохимия и стереохимия ДАИНВ
Региохимия
Региохимию в реакциях DA INV можно надежно предсказать во многих случаях. Это можно сделать одним из двух способов: либо электростатическим (зарядовым) контролем, либо орбитальным контролем. [2] [7] [9] Чтобы предсказать региохимию с помощью зарядового контроля, необходимо рассмотреть резонансные формы реагентов. Эти резонансные формы можно использовать для назначения частичных зарядов каждому из атомов. Частично отрицательные атомы на диене будут связываться с частично положительными атомами на диенофиле, и наоборот.

Предсказание региохимии реакции с помощью орбитального контроля требует расчета относительных орбитальных коэффициентов для каждого атома реагентов. [7] HOMO диенофила реагирует с LUMO диена. Относительный размер орбитали для каждого атома представлен орбитальными коэффициентами в теории молекулярных орбиталей Frontier (FMO). Орбитали будут выстраиваться так, чтобы максимизировать связывающие взаимодействия и минимизировать антисвязывающие взаимодействия.

Принцип Альдера–Штейна

Принцип Альдера–Штейна гласит, что стереохимия реагентов сохраняется в стереохимии продуктов в ходе реакции Дильса–Альдера. Это означает, что группы, которые были цис-по отношению друг к другу в исходных материалах, будут син-по отношению друг к другу в продукте, а группы, которые были транс-по отношению друг к другу в исходном материале, будут анти-по отношению друг к другу в продукте.
Принцип Альдера–Штейна не влияет на относительную ориентацию групп в двух исходных материалах. С помощью этого принципа невозможно предсказать, будет ли заместитель в диене син- или анти-заместителем в диенофиле. Принцип Альдера–Штейна согласуется только с одними и теми же исходными материалами. Соотношение справедливо только для групп в диене или только для групп в диенофиле. Относительную ориентацию групп между двумя реагентами можно предсказать с помощью правила эндо-отбора .
Правило выбора Эндо

Подобно стандартной реакции Дильса-Альдера, DA INV также подчиняется общему правилу эндо-отбора. В стандартной реакции Дильса-Альдера известно, что электроноакцепторные группы на диенофиле будут приближаться к эндо по отношению к диену. Точная причина этой селективности все еще обсуждается, но наиболее общепринятой точкой зрения является то, что эндо-подход максимизирует вторичное орбитальное перекрытие. [10] DA INV благоприятствует эндо-ориентации электронодонорных заместителей на диенофиле. Поскольку все реакции Дильса-Альдера протекают через переходное состояние в ванне , существует «внутри» и «снаружи» переходного состояния (внутри и снаружи «ванны»). Заместители на диенофиле считаются «эндо», если они находятся «внутри» ванны, и «экзо», если они находятся снаружи.
Экзо-путь будет благоприятствоваться стерическим факторам, поэтому необходимо другое объяснение для обоснования общего преобладания эндо-продуктов. Для объяснения этого результата можно использовать теорию пограничных молекулярных орбиталей. Когда заместители диенофила являются экзо, между этими заместителями и диеном нет взаимодействия. Однако, когда заместители диенофила являются эндо, существует значительное перекрытие орбиталей с диеном. В случае DA INV перекрытие орбиталей заместителей, оттягивающих электроны, с орбиталями диена создает благоприятное связывающее взаимодействие, стабилизируя переходное состояние относительно экзо-переходного состояния. [7] Реакция с более низкой энергией активации будет протекать с большей скоростью. [7]
Обычные диены
Диены , используемые в реакции Дильса-Альдера с обратным электронным спросом, являются относительно электронодефицитными видами; по сравнению со стандартной реакцией Дильса-Альдера, где диен богат электронами. Эти электронодефицитные виды имеют более низкую молекулярную орбитальную энергию, чем их стандартные аналоги DA. Эта пониженная энергия является результатом включения либо: A) электроноакцепторной группы, либо B) электроотрицательных гетероатомов. Ароматические соединения также могут реагировать в реакциях DA INV , такие как триазины и тетразины . Другие распространенные классы диенов - оксо- и аза -бутадиены. [9] [11]
Ключевым качеством хорошего DA INV диена является значительно сниженный HOMO и LUMO по сравнению со стандартными DA диенами. Ниже приведена таблица, показывающая несколько часто используемых DA INV диенов, их энергии HOMO и LUMO, а также некоторые стандартные DA диены вместе с их соответствующими энергиями MO. [2] [12] [13] [14]
Обычные диенофилы
Диенофилы , используемые в реакциях Дильса-Альдера с обратным электронным спросом, в отличие от стандартной DA, очень богаты электронами, содержат одну или несколько групп-доноров электронов . Это приводит к более высоким орбитальным энергиям и, следовательно, большему орбитальному перекрытию с LUMO диена. Обычные классы диенофилов для реакции DA INV включают виниловые эфиры и винилацетали, имины, енамины, алкины и высоконапряженные олефины. [11] [14]
Наиболее важным соображением при выборе диенофила является его относительная орбитальная энергия. Как HOMO, так и LUMO влияют на скорость и селективность реакции. Таблица обычных диенофилов DA INV , стандартных диенофилов DA и их соответствующих энергий MO приведена ниже. [2] [7] [12]
Вторая таблица показывает, как электронное богатство диенофилов влияет на скорость реакции с очень бедным электронами диеном, а именно гексахлорциклопентадиеном . Чем более богат электронами диенофил, тем выше будет скорость реакции. Это очень ясно при сравнении относительных скоростей реакции для стирола и менее богатого электронами п-нитростирола; реакции более богатого электронами стирола примерно на 40% быстрее, чем п-нитростирола. [5]
| Диенофил | Относительная скорость реакции с |
|---|---|
| Циклопентадиен | 15200 |
| п-метоксистирол | 1580 |
| Стирол | 750 |
| п-Нитростирол | 538 |
| 2,3-Дигидрофуран | 333 |
| Норборнен | 70,8 |
| Циклопентен | 59.0 |
| Малеиновый ангидрид | 29.1 |
| Циклогексен | 3.0 |
Область применения и применения
Реакции DA INV открывают путь к богатой библиотеке синтетических мишеней [7] [11] и были использованы для формирования многих высокофункционализированных систем, включая селективно защищенные сахара, что является важным вкладом в область химии сахара. [15] Кроме того, реакции DA INV могут производить ряд различных продуктов из одного исходного материала, такого как тетразин. [2] [13]

Реакции DA INV использовались для синтеза нескольких природных продуктов, включая (-)-CC-1065, исходное соединение в серии дуокармицинов , которое нашло применение в качестве противоракового лечения. Несколько кандидатов на лекарственные препараты в этой серии перешли в клинические испытания. Реакция DA INV использовалась для синтеза секций PDE-I и PDE-II (-)-CC-1065. Первая реакция в последовательности — это реакция DA INV между тетразином и винилацеталем, за которой следует ретрореакция Дильса-Альдера для получения продукта 1,2- диазина . После еще нескольких шагов происходит внутримолекулярная реакция DA INV , за которой снова следует ретрореакция Дильса-Альдера in situ для получения продукта индолина . Этот индолин преобразуется либо в PDE-I, либо в PDE-II за несколько синтетических шагов.

Реакция DA INV между 2,3,4,5-тетрахлортиофен-1,1-диоксидом (диеном) и производным 4,7-дигидроизоиндола (диенофилом) дала новый предшественник для тетранафтопорфиринов (TNP), содержащих перхлорированные ароматические кольца. Этот предшественник может быть преобразован в соответствующие порфирины путем конденсации, катализируемой кислотой Льюиса, с ароматическими альдегидами и дальнейшего окисления DDQ . Полихлорирование системы TNP оказывает глубокое благоприятное воздействие на ее растворимость. Сильная агрегация и плохая растворимость исходных тетранафтопорфиринов серьезно снижают полезность этого потенциально очень ценного семейства порфиринов. Таким образом, наблюдаемый эффект полихлорирования весьма приветствуется. Помимо влияния на растворимость, полихлорирование также, как оказалось, существенно улучшает устойчивость этих соединений к фотоокислению , что, как известно, является еще одним серьезным недостатком тетранафтопорфиринов. [16]

Смотрите также
- Реакция Дильса-Альдера
- Циклоприсоединение
- Перициклическая реакция
- Теория молекулярных орбиталей
- синтез пиридина по Богеру
Внешние ссылки
- Подготовка органических синтезов
Ссылки
- ^ Bodwell, Graham J.; Zulan Pi; Ian R. Pottie (1999). "Electron Deficient Dienes. 2. One Step Synthesis of a Coumarin-Fused Electron Deficient Diene and its Inverse Electron Demand Diels–Alder Reactions with Enamines" (PDF) . Synlett . 1999 (4): 477– 479. CiteSeerX 10.1.1.532.5783 . doi :10.1055/s-1999-2645. Архивировано из оригинала (PDF) 25 августа 2005 г. . Получено 31 марта 2013 г. .
- ^ abcdefghijk Богер, Дейл (1989). Прогресс в гетероциклической химии (1-е изд.). Нью-Йорк: Pergamon. ISBN 978-0-08-037044-6.
- ^ Weissler, M (2010). «Реакция Дильса-Альдера с обратным спросом на электроны, очень эффективная универсальная концепция клик-реакции для правильного лигирования различных молекулярных партнеров» (PDF) . International Journal of Medical Sciences . 7 (1): 19– 28. doi :10.7150/ijms.7.19. PMC 2792734 . PMID 20046231.
- ^ Флейшхауэр Дж., Асаад А.Н., Шлекер В., Шарф HD (1981). «Zur Issuetik der Einteilung von Diels-Alder-Reaktionen в «нормальном» и «обратном»«[О трудности классификации реакций Дильса-Альдера на «нормальные» и «обратные»]. Liebigs Annalen der Chemie (на немецком языке). 1981 (2): 306–311. doi : 10.1002/jlac.198119810214. ISSN 0170-2041.
- ^ Аб Зауэр, Дж.; Вист, Х. (21 мая 1962 г.). "Diels-Alder-Additionen mit "inversem" Elektronenbedarf". Ангеванде Хеми . 74 (10): 353. Бибкод :1962АнгЧ..74..353С. дои : 10.1002/ange.19620741006.
- ^ ab Woodward, R (1 января 1959 г.). «Механизм реакции Дильса-Альдера». Tetrahedron . 5 (1): 70–89 . doi :10.1016/0040-4020(59)80072-7.
- ^ abcdefgh Рушенас, Пархэм; Хоф, Кира; Шрайнер, Питер Р.; Уильямс, Крейг М. (1 февраля 2011 г.). «1,2,4-Триазин против 1,3- и 1,4-Оксазинонов в гетерореакциях Дильса-Альдера с нормальным и обратным электронным спросом: установление статус-кво с помощью вычислительного анализа». Европейский журнал органической химии . 2011 (5): 983– 992. doi :10.1002/ejoc.201001365.
- ^ Хоффманн, Роальд; Вудворд, Роберт Б. (1 января 1968 г.). «Сохранение орбитальной симметрии». Accounts of Chemical Research . 1 (1): 17– 22. doi :10.1021/ar50001a003.
- ^ abc Dang, Anh-Thu; Miller, David O.; Dawe, Louise N.; Bodwell, Graham J. (1 января 2008 г.). "Electron-Deficient Dienes. 5. Подход Дильса-Альдера с обратным спросом на электроны к 2-замещенным 4-метоксиксантонам и 3,4-диметоксиксантонам". Organic Letters . 10 (2): 233– 236. doi :10.1021/ol702614b. PMID 18092790.
- ^ Гарсиа Дж.И., Майораль Х.А., Сальвателла Л. (2005). «Источник эндоправила в реакции Дильса-Альдера: действительно ли необходимы вторичные орбитальные взаимодействия?». Европейский журнал органической химии . 2005 (1): 85–90 . doi :10.1002/ejoc.200400424. ISSN 1434-193Х.
- ^ abc Pottie, Ian; Nandaluru, Penchal; Bodwell, Graham (30 августа 2011 г.). "Полный синтез уролитина M7 на основе обратного электронного спроса на основе Дильса-Альдера". Synlett . 2011 (15): 2245– 2247. doi :10.1055/s-0030-1261203.
- ^ ab Flemming, Ian (2010). Молекулярные орбитали и органические химические реакции . Великобритания: Wiley. ISBN 978-0-470-74658-5.
- ^ ab Figeys, HP; Mathy, A. (1 января 1981 г.). «Реакции Дильса-Альдера с обратным спросом на электроны. II. Реакция бензамидина с π-дефицитными гетероароматическими соединениями». Tetrahedron Letters . 22 (15): 1393– 1396. doi :10.1016/S0040-4039(01)90330-2.
- ^ ab Pałasz, Aleksandra; Pałasz, Tadeusz (18 февраля 2011 г.). «Конденсация Кнёвенагеля циклических кетонов с бензоилацетонитрилом и N,N′-диметилбарбитуровой кислотой. Применение стерически затрудненных продуктов конденсации в синтезе спиро- и диспиропиранов с помощью гетерореакций Дильса–Альдера». Tetrahedron . 67 (7): 1422– 1431. doi :10.1016/j.tet.2010.12.053.
- ^ Богер, Дейл Л.; Робарж, Кирк Д. (1 ноября 1988 г.). «Расходящийся de novo синтез углеводов на основе ускоренной реакции Дильса-Альдера с обратным электронным спросом 1-окса-1,3-бутадиенов». Журнал органической химии . 53 (24): 5793– 5796. doi :10.1021/jo00259a040.
- ^ Филатов, МА; Чепраков, АВ (2011). «Синтез новых тетрабензо- и тетранафтопорфиринов с помощью реакций присоединения 4,7-дигидроизоиндола». Тетраэдр . 67 (19): 3559– 3566. doi :10.1016/j.tet.2011.01.052.