Цианистый водород
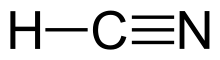 | |||
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Формонитрил [2] | |||
| Систематическое название ИЮПАК Метаннитрил [2] | |||
Другие имена
| |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ЧЭБИ | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.000.747 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
| МеШ | Водород+Цианид | ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
| Номер ООН | 1051 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| Характеристики | |||
| HCN | |||
| Молярная масса | 27,0253 г/моль | ||
| Появление | Бесцветная жидкость или газ | ||
| Запах | горький миндаль -подобный [3] | ||
| Плотность | 0,6876 г/см 3 [4] | ||
| Температура плавления | −13,29 °C (8,08 °F; 259,86 K) [4] | ||
| Точка кипения | 26 °C (79 °F; 299 K) [4] : 4,67 | ||
| Смешивающийся | |||
| Растворимость в этаноле | Смешивающийся | ||
| Давление пара | 100 кПа (25 °C) [4] : 6,94 | ||
Константа закона Генри ( k H ) | 75 мкмоль Па −1 кг −1 | ||
| Кислотность ( pK a ) | 9,21 (в воде), 12,9 (в ДМСО) [5] | ||
| Основность (p K b ) | 4,79 (цианид-анион) | ||
| Сопряженная кислота | Гидроцианоний | ||
| Сопряженное основание | Цианид | ||
Показатель преломления ( nD ) | 1.2675 [6] | ||
| Вязкость | 0,183 мПа·с (25 °C) [4] : 6,231 | ||
| Структура | |||
| тетрагональная (>170 К) орторомбическая (<170 К) [7] | |||
| С ∞в | |||
| Линейный | |||
| 2.98 Д | |||
| Термохимия | |||
Теплоемкость ( С ) | 35,9 Дж-К -1 моль -1 (газ) [4] : 5,19 | ||
Стандартная молярная энтропия ( S ⦵ 298 ) | 201,8 ДжК −1 моль −1 | ||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | 135,1 кДж моль −1 | ||
| Опасности | |||
| Маркировка СГС : | |||
    | |||
| Опасность | |||
| Х225 , Х300+Х310+Х330 , Х319 , Х336 , Х370 , Х410 | |||
| П210 , П261 , П305+П351+П338 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | −17,8 °C (0,0 °F; 255,3 К) | ||
| 538 °C (1000 °F; 811 K) | |||
| Пределы взрывоопасности | 5,6% – 40,0% [8] | ||
| Смертельная доза или концентрация (ЛД, ЛК): | |||
LC 50 ( средняя концентрация ) | 501 ppm (крыса, 5 мин) 323 ppm (мышь, 5 мин) 275 ppm (крыса, 15 мин) 170 ppm (крыса, 30 мин) 160 ppm (крыса, 30 мин) 323 ppm (крыса, 5 мин) [9] | ||
LC Lo ( самый низкий опубликованный ) | 200 ppm (млекопитающее, 5 мин) 36 ppm (млекопитающее, 2 ч) 107 ppm (человек, 10 мин) 759 ppm (кролик, 1 мин) 759 ppm (кошка, 1 мин) 357 ppm (человек, 2 мин) 179 ppm (человек, 1 ч) [9] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (допустимый) | TWA 10 частей на миллион (11 мг/м 3 ) [кожа] [8] | ||
РЕЛ (рекомендуется) | ST 4,7 частей на миллион (5 мг/м 3 ) [кожа] [8] | ||
IDLH (Непосредственная опасность) | 50 частей на миллион [8] | ||
| Родственные соединения | |||
Родственные алканнитрилы | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Цианистый водород (ранее известный как синильная кислота ) — это химическое соединение с формулой HCN и структурной формулой H−C≡N . Это высокотоксичная и легковоспламеняющаяся жидкость , которая кипит при температуре немного выше комнатной , при 25,6 °C (78,1 °F). HCN производится в промышленных масштабах и является высокоценным прекурсором многих химических соединений, от полимеров до фармацевтических препаратов. Широкомасштабное применение — производство цианида калия и адипонитрила , используемых в горнодобывающей промышленности и производстве пластмасс соответственно. [10] Он более токсичен, чем твердые цианистые соединения, из-за своей летучести . Раствор цианистого водорода в воде , представленный как HCN, называется синильной кислотой . Соли цианид-аниона известны как цианиды .
Является ли цианистый водород органическим соединением или нет, является темой для споров среди химиков, и мнения различаются от автора к автору. Традиционно, значительное количество авторов считают его неорганическим . Вопреки этой точке зрения, другие авторы считают его органическим, поскольку цианистый водород относится к классу органических соединений, известных как нитрилы , которые имеют формулу R−C≡N , где R обычно представляет собой органильную группу (например, алкил или арил ) или водород . [11] В случае цианистого водорода группа R представляет собой водород H, поэтому другие названия цианистого водорода — метаннитрил и формонитрил. [2]
Структура и общие свойства
Цианистый водород — это линейная молекула с тройной связью между углеродом и азотом . Таутомер HCN — HNC, изоцианид водорода . [ требуется цитата ]
HCN имеет слабый запах горького миндаля , который некоторые люди не могут почувствовать из-за рецессивного генетического признака . [12] Летучее соединение использовалось в качестве ингаляционного родентицида и человеческого яда, а также для убийства китов. [13] Ионы цианида мешают работе железосодержащих дыхательных ферментов. [ необходима ссылка ]
Химические свойства
Цианистый водород слабокислый с p K a 9,2 . Он частично ионизируется в воде , образуя анион цианида , CN − . HCN образует водородные связи со своим сопряженным основанием, такие виды, как (CN − )(HCN) n . [14]
Цианистый водород реагирует с алкенами, давая нитрилы. Превращение, которое называется гидроцианированием , использует комплексы никеля в качестве катализаторов. [15]
- RCH =CH2 + HCN → RCH2 −CH2CN
Четыре молекулы HCN тетрамеризуются в диаминомалеонитрил . [16]
Цианиды металлов обычно получают путем солевого обмена из солей цианидов щелочных металлов, но цианид ртути образуется из водного раствора цианида водорода: [17]
- HgO + 2 HCN → Hg(CN) 2 + H 2 O
История открытия и наименования
Цианистый водород был впервые выделен в 1752 году французским химиком Пьером Маккером , который преобразовал берлинскую лазурь в оксид железа и летучий компонент и обнаружил, что их можно использовать для ее восстановления. [18] Новый компонент был тем, что сейчас известно как цианистый водород. Впоследствии он был получен из берлинской лазури шведским химиком Карлом Вильгельмом Шееле в 1782 году [19] и в конечном итоге получил немецкое название Blausäure ( буквально «синяя кислота») из-за своей кислотной природы в воде и своего происхождения от берлинской лазури. В английском языке он стал широко известен как синильная кислота.
В 1787 году французский химик Клод Луи Бертолле показал, что синильная кислота не содержит кислорода [20] , что стало важным вкладом в теорию кислот, которая до сих пор постулировала, что кислоты должны содержать кислород [21] (отсюда и само название кислорода , которое происходит от греческих элементов, означающих «кислотообразующий» и также калькируется на немецком языке как Sauerstoff ).
В 1811 году Жозеф Луи Гей-Люссак приготовил чистый, сжиженный цианистый водород [22] , а в 1815 году вывел химическую формулу синильной кислоты [23] .
Этимология
Слово цианид для радикала в цианистом водороде произошло от его французского эквивалента cyanure , который Гей-Люссак сконструировал из древнегреческого слова κύανος для темно-синей эмали или ляпис-лазури , опять же из-за происхождения химического вещества от берлинской лазури. Кстати, греческое слово также является корнем английского названия цвета cyan .
Производство и синтез
Наиболее важным процессом является окисление Андрусова, изобретенное Леонидом Андрусовым в IG Farben, в котором метан и аммиак реагируют в присутствии кислорода при температуре около 1200 °C (2190 °F) над платиновым катализатором: [24]
- 2 CH 4 + 2 NH 3 + 3 O 2 → 2 HCN + 6 H 2 O
В 2006 году в США было произведено от 500 миллионов до 1 миллиарда фунтов (от 230 000 до 450 000 тонн). [25] Цианистый водород производится в больших количествах несколькими способами и является отходами производства акрилонитрила . [10]
Меньшее значение имеет процесс Дегусса ( процесс BMA ), в котором кислород не добавляется, а энергия должна передаваться косвенно через стенку реактора: [26]
- CH4 + NH3 → HCN + 3H2
Эта реакция похожа на паровой риформинг — реакцию метана и воды с образованием оксида углерода и водорода .
В процессе Шавинигана углеводороды , например, пропан , реагируют с аммиаком.
В лабораторных условиях небольшие количества HCN получают путем добавления кислот к цианистым солям щелочных металлов :
- Н + + CN − → HCN
Эта реакция иногда является причиной случайных отравлений, поскольку кислота преобразует нелетучую соль цианида в газообразный HCN.
Цианистый водород можно получить из феррицианида калия и кислоты:
- 6H + + [Fe(CN) 6 ]−3→ 6 HCN + Fe+3[27] [28]
Исторические методы производства
Большой спрос на цианиды для горнодобывающей промышленности в 1890-х годах был удовлетворен Джорджем Томасом Бейлби , который в 1892 году запатентовал метод получения цианида водорода путем пропускания аммиака над раскаленным углем . Этот метод использовался до тех пор, пока в 1894 году Гамильтон Кастнер не разработал синтез из угля, аммиака и натрия, в результате которого получался цианид натрия , который вступает в реакцию с кислотой, образуя газообразный HCN.
Приложения
HCN является предшественником цианида натрия и цианида калия , которые используются в основном в добыче золота и серебра и для гальванопокрытия этих металлов. Через посредничество циангидринов из HCN получают множество полезных органических соединений, включая мономер метилметакрилат , из ацетона , аминокислоту метионин , через синтез Штрекера , и хелатирующие агенты EDTA и NTA . Через процесс гидроцианирования HCN добавляется к бутадиену , чтобы получить адипонитрил , предшественник нейлона-6,6 . [10]
HCN используется во всем мире в качестве фумиганта против многих видов насекомых-вредителей, которые заражают пищевые производственные предприятия. Как его эффективность, так и способ применения приводят к использованию очень малых количеств фумиганта по сравнению с другими токсичными веществами, используемыми для той же цели. [29] Использование HCN в качестве фумиганта также оказывает меньшее воздействие на окружающую среду по сравнению с некоторыми другими фумигантами, такими как сульфурилфторид , [30] и метилбромид . [31]
Происшествие
HCN можно получить из фруктов , имеющих косточку , таких как вишня , абрикосы , яблоки и орехи, такие как горький миндаль , из которых производят миндальное масло и экстракт. Многие из этих косточек содержат небольшое количество циангидринов, таких как нитрил миндальной кислоты и амигдалин , которые медленно выделяют цианистый водород. [32] [33] Сто граммов измельченных семян яблок могут дать около 70 мг HCN. [34] Корни растений маниоки содержат цианогенные гликозиды , такие как линамарин , которые разлагаются на HCN с выходом до 370 мг на килограмм свежего корня. [35] Некоторые многоножки , такие как Harpaphe haydeniana , Desmoxytes purpurosea и Apheloria , выделяют цианистый водород в качестве защитного механизма, [36] как и некоторые насекомые, такие как огневка и личинки Paropsisterna eucalyptus . [37] Цианистый водород содержится в выхлопных газах транспортных средств и в дыме от сжигания азотсодержащих пластиков .

На Титане
HCN был измерен в атмосфере Титана четырьмя приборами на космическом зонде Кассини , одним прибором на Вояджере и одним прибором на Земле. [38] Одно из этих измерений было in situ , когда космический аппарат Кассини опустился на высоту от 1000 до 1100 км (от 620 до 680 миль) над поверхностью Титана, чтобы собрать атмосферный газ для масс-спектрометрического анализа. [39] HCN первоначально образуется в атмосфере Титана в результате реакции фотохимически полученных радикалов метана и азота, которые проходят через промежуточное соединение H 2 CN, например, (CH 3 + N → H 2 CN + H → HCN + H 2 ). [40] [41] Ультрафиолетовое излучение расщепляет HCN на CN + H; однако CN эффективно перерабатывается обратно в HCN через реакцию CN + CH 4 → HCN + CH 3 . [40]
На молодой Земле
Было высказано предположение, что углерод из каскада астероидов (известный как поздняя тяжелая бомбардировка ), образовавшийся в результате взаимодействия Юпитера и Сатурна, взорвал поверхность молодой Земли и прореагировал с азотом в атмосфере Земли, образовав HCN. [42]
У млекопитающих
Некоторые авторы [ кто? ] показали, что нейроны могут вырабатывать цианистый водород при активации их опиоидных рецепторов эндогенными или экзогенными опиоидами. Они также показали, что нейрональная продукция HCN активирует рецепторы NMDA и играет роль в передаче сигнала между нейронными клетками ( нейротрансмиссия ). Более того, повышенная эндогенная нейрональная продукция HCN под действием опиоидов, по-видимому, необходима для адекватной опиоидной анальгезии , поскольку анальгетическое действие опиоидов ослаблялось поглотителями HCN. Они считали эндогенный HCN нейромодулятором . [ 43]
Также было показано, что, хотя стимуляция мускариновых холинергических рецепторов в культивируемых клетках феохромоцитомы увеличивает выработку HCN, в живом организме ( in vivo ) мускариновая холинергическая стимуляция фактически снижает выработку HCN. [44]
Лейкоциты генерируют HCN во время фагоцитоза и могут убивать бактерии , грибки и другие патогены, вырабатывая несколько различных токсичных химических веществ, одним из которых является цианистый водород. [43]
Было показано, что вазодилатация, вызванная нитропруссидом натрия, опосредована не только образованием NO, но и эндогенным образованием цианида, что добавляет не только токсичность, но и некоторую дополнительную антигипертензивную эффективность по сравнению с нитроглицерином и другими нецианогенными нитратами , которые не вызывают повышения уровня цианида в крови. [45]
HCN является компонентом табачного дыма . [46]
HCN и происхождение жизни
Цианистый водород обсуждался как предшественник аминокислот и нуклеиновых кислот, и, как предполагается, сыграл роль в происхождении жизни . [47] Хотя связь этих химических реакций с теорией происхождения жизни остается спекулятивной, исследования в этой области привели к открытию новых путей к органическим соединениям, полученным путем конденсации HCN (например, аденина ). [48] Вот почему ученые, которые ищут жизнь на планетах за пределами Земли, в первую очередь изучают молекулы, подобные цианистому водороду, после подтверждения подходящих температур и наличия воды. [49]
В космосе
HCN был обнаружен в межзвездной среде [50] и в атмосферах углеродных звезд . [51] С тех пор обширные исследования исследовали пути образования и разрушения HCN в различных средах и изучили его использование в качестве трассера для различных астрономических видов и процессов. HCN можно наблюдать с наземных телескопов через ряд атмосферных окон. [52] Были обнаружены чисто вращательные переходы J=1→0, J=3→2, J= 4→3 и J=10→9 . [50] [53] [54]
HCN образуется в межзвездных облаках одним из двух основных путей: [55] через нейтрально-нейтральную реакцию (CH 2 + N → HCN + H) и через диссоциативную рекомбинацию (HCNH + + e − → HCN + H). Путь диссоциативной рекомбинации доминирует на 30%; однако HCNH + должен находиться в своей линейной форме. Диссоциативная рекомбинация с его структурным изомером, H 2 NC + , производит исключительно изоцианид водорода (HNC).
HCN разрушается в межзвездных облаках посредством ряда механизмов в зависимости от местоположения в облаке. [55] В фотонно-доминируемых областях (PDR) доминирует фотодиссоциация, производя CN (HCN + ν → CN + H). На больших глубинах доминирует фотодиссоциация космическими лучами, производя CN (HCN + cr → CN + H). В темном ядре два конкурирующих механизма разрушают его, образуя HCN + и HCNH + (HCN + H + → HCN + + H; HCN + HCO + → HCNH + + CO). Реакция с HCO + доминирует примерно в 3,5 раза. HCN использовался для анализа различных видов и процессов в межзвездной среде. Он был предложен в качестве трассера для плотного молекулярного газа [56] [57] и в качестве трассера звездного притока в массивных областях звездообразования. [58] Кроме того, было показано, что отношение HNC/HCN является отличным методом для различения PDR и областей с преобладанием рентгеновского излучения (XDR). [59]
11 августа 2014 года астрономы опубликовали исследования, впервые с использованием Атакамской большой миллиметровой/субмиллиметровой решетки (ALMA) , в которых подробно описывалось распределение HCN, HNC , H2CO и пыли внутри комет C/ 2012 F6 ( Леммон) и C/2012 S1 (ISON) . [60] [61]
В феврале 2016 года было объявлено, что следы цианистого водорода были обнаружены в атмосфере горячей Суперземли 55 Cancri e с помощью космического телескопа НАСА «Хаббл» . [62]
14 декабря 2023 года астрономы сообщили о первом обнаружении в шлейфах Энцелада , спутника планеты Сатурн , цианистого водорода, возможного химического вещества, необходимого для жизни [63] , какой мы ее знаем, а также других органических молекул , некоторые из которых еще предстоит лучше идентифицировать и понять. По словам исследователей, «эти [недавно открытые] соединения потенциально могут поддерживать существующие микробные сообщества или управлять сложным органическим синтезом, ведущим к возникновению жизни ». [64] [65]
Как яд и химическое оружие
В Первой мировой войне цианистый водород использовался французами с 1916 года в качестве химического оружия против Центральных держав , а также Соединенными Штатами и Италией в 1918 году. Он оказался недостаточно эффективным из-за погодных условий. [66] [67] Газ легче воздуха и быстро рассеивается в атмосфере. Быстрое разбавление делало его использование в полевых условиях непрактичным. Напротив, более плотные агенты, такие как фосген или хлор, имели тенденцию оставаться на уровне земли и опускались в траншеи полей сражений Западного фронта. По сравнению с такими агентами цианистый водород должен был присутствовать в более высоких концентрациях, чтобы быть смертельным.
Концентрация цианида водорода 100–200 ppm в вдыхаемом воздухе убьет человека в течение 10–60 минут. [68] Концентрация цианида водорода 2000 ppm (около 2380 мг/м 3 ) убьет человека примерно за одну минуту. [68] Токсический эффект вызван действием иона цианида, который останавливает клеточное дыхание . Он действует как неконкурентный ингибитор фермента в митохондриях, называемого цитохром с оксидазой . Таким образом, цианид водорода обычно причисляют к химическому оружию как кровяной агент . [69]
Конвенция о химическом оружии включает его в Приложение 3 как потенциальное оружие, которое имеет крупномасштабное промышленное применение. Подписавшие страны должны декларировать производственные предприятия, которые производят более 30 метрических тонн в год, и разрешать инспекцию со стороны Организации по запрещению химического оружия .
Возможно, его наиболее печально известное применение — Циклон Б (нем. Cyclone B , где B означает Blausäure — синильная кислота; также, чтобы отличить его от более раннего продукта, позже известного как Циклон А), [ 70] использовавшийся в нацистских немецких лагерях смерти Майданек и Аушвиц-Биркенау во время Второй мировой войны для массового убийства евреев и других преследуемых меньшинств в рамках их программы геноцида «Окончательное решение» . Цианистый водород также использовался в лагерях для дезинфекции одежды в попытках искоренить болезни, переносимые вшами и другими паразитами. Один из первоначальных чешских производителей продолжал производить Циклон Б под торговой маркой «Ураган Д2» [71] примерно до 2015 года. [72]
Во время Второй мировой войны США рассматривали возможность использования его вместе с хлорцианом в рамках операции «Даунфолл» — запланированного вторжения в Японию, но президент Гарри Трумэн отказался от этого, вместо этого применив атомные бомбы, разработанные в рамках секретного Манхэттенского проекта . [73]
Цианистый водород также использовался в качестве средства для казни в некоторых штатах США , где он производился во время казни путем воздействия серной кислоты на цианистый натрий или цианистый калий . [74]
Под названием синильная кислота HCN использовался в качестве смертоносного вещества в китобойных гарпунах, хотя он оказался довольно опасным для команды, применявшей его, и от него быстро отказались. [13] С середины XVIII века его использовали в ряде отравлений, убийств и самоубийств. [75]
Цианистый водород в воздухе взрывоопасен при концентрации выше 5,6%. [76]
Ссылки
- ^ "цианистый водород (CHEBI:18407)". Химические сущности биологического интереса . Великобритания: Европейский институт биоинформатики. 18 октября 2009 г. Основной . Получено 2012-06-04 .
- ^ abc "Цианистый водород". PubChem . Национальный центр биотехнологической информации .
- ^ Симеонова, Фина Петрова; Фишбейн, Лоуренс (2004). Цианистый водород и цианиды: аспекты здоровья человека (Отчет). Всемирная организация здравоохранения. ISBN 9241530618. ISSN 1020-6167.
- ^ abcdef Хейнс, Уильям М., ред. (2011). CRC Handbook of Chemistry and Physics (92-е изд.). CRC Press . ISBN 978-1439855119.
- ^ Evans DA. "pKa's of Inorganic and Oxo-Acids" (PDF) . Архивировано (PDF) из оригинала 2022-10-09 . Получено 19 июня 2020 .
- ^ Патнаик П. (2002). Справочник по неорганическим химикатам . McGraw-Hill. ISBN 978-0070494398.
- ^ Шульц, Аксель; Суркау, Йонас (2022-09-21). «Основная группа цианидов: от цианистого водорода до цианидных комплексов». Обзоры в неорганической химии . 43 (1). Walter de Gruyter GmbH: 49– 188. doi : 10.1515/revic-2021-0044 . ISSN 0193-4929.
- ^ abcd Карманный справочник NIOSH по химическим опасностям. "#0333". Национальный институт охраны труда и здоровья (NIOSH).
- ^ ab "Цианистый водород". Концентрации, представляющие непосредственную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда (NIOSH).
- ^ abc Gail, E.; Gos, S.; Kulzer, R.; Lorösch, J.; Rubo, A.; Sauer, M. "Cyano Compounds, Inorganic". Энциклопедия промышленной химии Ульмана . Weinheim: Wiley-VCH. doi :10.1002/14356007.a08_159.pub2. ISBN 978-3-527-30673-2.
- ^ «База данных метаболома человека: Отображение метабокарты для цианистого водорода (HMDB0060292)».
- ^ "Цианид, неспособность чувствовать запах". Онлайн Менделевское наследование у человека . Получено 2010-03-31 .
- ^ ab Lytle T. "Poison Harpoons". Whalecraft.net . Архивировано из оригинала 2019-02-15.
- ^ Блезинг, Кевин; Харлофф, Йорг; Шульц, Аксель; Стофферс, Алрик; Стер, Филип; Виллингер, Александр (2020). «Соли агрегатов HCN-цианида: [CN(HCN)2]- и [CN(HCN)3]-». Angewandte Chemie, международное издание . 59 (26): 10508–10513 . doi :10.1002/anie.201915206. ПМЦ 7317722 . ПМИД 32027458.
- ^ Леувен, фургон PWNM (2004). Гомогенный катализ: понимание техники . Дордрехт: Kluwer Academic Publishers. ISBN 1402019998. OCLC 54966334.
- ^ Феррис, Дж. П.; Санчес, Р. А. (1968). «Диаминомалеонитрил (тетрамер цианистого водорода)». Органические синтезы . 48 : 60. doi :10.15227/orgsyn.048.0060.
- ^ Ф. Вагенкнехт; Р. Джуза (1963). "Цианид ртути (II)". В Г. Брауэре (ред.). Справочник по препаративной неорганической химии . Т. 2 (2-е изд.). Нью-Йорк, Нью-Йорк: Academic Press.
- ^ Маккер П.Дж. (1756). «Éxamen chymique de bleu de Prusse» [Химическое исследование берлинской лазури]. Mémoires de l'Académie Royale des Sciences (на французском языке): 60–77 .
- ^ Шееле CW (1782). «Försök, beträffande det färgande ämnet uti Berlinerblå» [Эксперимент с красящим веществом берлинской синевы]. Kungliga Svenska Vetenskapsakademiens Handlingar (Труды Шведской королевской академии наук (на шведском языке). 3 : 264–275 .
Перепечатано на латыни как: Scheele CW, Hebenstreit EB, ред. (1789). «De materia tingente caerulei berolinensis». Opuscula Chemica et Physica [ Темная материя tingente caerulei berolinensis ] (на латыни). Том. 2. Перевод Шефера Г.Х. (Лейпциг («Lipsiae») (Германия): Иоганн Годфрид Мюллер. стр. 148–174 . - ^ Бертолле CL (1789). «Mémoire sur l'acide prussique» [Мемуары о синильной кислоте]. Mémoires de l'Académie Royale des Sciences (на французском языке): 148–161 .
Перепечатано в: Бертолле CL (1789). «Extrait d'un mémoire sur l'acide prussique» [Отрывок из мемуаров о синильной кислоте]. Анналы де Шими . 1 : 30–39 . - ^ Newbold BT (1999-11-01). "Клод Луи Бертолле: великий химик французской традиции". Canadian Chemical News . Архивировано из оригинала 2008-04-20 . Получено 31-03-2010 .
- ^ Гей-Люссак JL (1811). «Note sur l'acide prussique» [Заметка о синильной кислоте]. Анналы де Шими . 44 : 128–133 .
- ^ Гей-Люссак JL (1815). «Recherche sur l'acide prussique» [Исследование синильной кислоты]. Анналы де Шими . 95 : 136–231 .
- ^ Andrussow L (1935). «Каталитическое окисление смесей аммиака и метана до цианистого водорода». Angewandte Chemie . 48 (37): 593– 595. Bibcode : 1935AngCh..48..593A. doi : 10.1002/ange.19350483702.
- ^ "Неконфиденциальные записи прав на интеллектуальную собственность 2006 года по химическим веществам, включая информацию о производстве, обработке и использовании". EPA . Архивировано из оригинала 2013-05-10 . Получено 2013-01-31 .
- ^ Эндтер Ф (1958). «Технический синтез цианвассерстофа из метана и аммиака без Зузаца фон Зауэрстоффа». Химия Инжениор Техник . 30 (5): 305–310 . doi :10.1002/cite.330300506.
- ^ "MSDS для феррицианида калия" (PDF) . Архивировано из оригинала (PDF) 2016-04-18 . Получено 2023-04-17 .
- ^ "Феррицианид калия". PubChem . Национальный центр биотехнологической информации .
- ^ "Руководство по фумигации для борьбы с насекомыми – Космическая фумигация при атмосферном давлении (продолжение)". Продовольственная и сельскохозяйственная организация .
- ^ "Идентифицирован новый парниковый газ". News.mit.edu . 11 марта 2009 г.
- ^ "Глава 10: Метилбромид" (PDF) . Csl.noaa.gov . Архивировано (PDF) из оригинала 2022-10-09.
- ^ Vetter J (январь 2000). "Растительные цианогенные гликозиды". Toxicon . 38 (1): 11– 36. Bibcode : 2000Txcn...38...11V. doi : 10.1016/S0041-0101(99)00128-2. PMID 10669009.
- ^ Jones DA (январь 1998). «Почему так много пищевых растений цианогенны?». Фитохимия . 47 (2): 155– 162. Bibcode : 1998PChem..47..155J. doi : 10.1016/S0031-9422(97)00425-1. PMID 9431670.
- ^ «Ядовиты ли огрызки яблок?». The Naked Scientists. 26 сентября 2010 г. Архивировано из оригинала 6 марта 2014 г. Получено 6 марта 2014 г.
- ^ Aregheore EM, Agunbiade OO (июнь 1991 г.). «Токсическое воздействие маниоки (manihot esculenta grantz) на людей: обзор». Ветеринарная и человеческая токсикология . 33 (3): 274–275 . PMID 1650055.
- ^ Blum MS, Woodring JP (октябрь 1962 г.). «Выделение бензальдегида и цианистого водорода многоножкой Pachydesmus crassicutis (Wood)». Science . 138 (3539): 512– 513. Bibcode :1962Sci...138..512B. doi :10.1126/science.138.3539.512. PMID 17753947. S2CID 40193390.
- ^ Zagrobelny M, de Castro ÉC, Møller BL, Bak S (май 2018 г.). «Цианогенез у членистоногих: от химической войны до брачных подарков». Насекомые . 9 (2): 51. doi : 10.3390/insects9020051 . PMC 6023451. PMID 29751568 .
- ^ Loison JC, Hébrard E, Dobrijevic M, Hickson KM, Caralp F, Hue V и др. (февраль 2015 г.). «Нейтральная фотохимия нитрилов, аминов и иминов в атмосфере Титана». Icarus . 247 : 218– 247. Bibcode :2015Icar..247..218L. doi :10.1016/j.icarus.2014.09.039.
- ^ Magee BA, Waite JH, Mandt KE, Westlake J, Bell J, Gell DA (декабрь 2009 г.). «Состав верхней атмосферы Титана, полученный с помощью INMS: методы анализа и сравнение моделей». Planetary and Space Science . 57 ( 14– 15): 1895– 1916. Bibcode :2009P&SS...57.1895M. doi :10.1016/j.pss.2009.06.016.
- ^ ab Pearce BK, Molaverdikhani K, Pudritz RE, Henning T, Hebrard E (2020). "Производство HCN в атмосфере Титана: связь квантовой химии и моделирования неравновесной атмосферы". Astrophysical Journal . 901 (2): 110. arXiv : 2008.04312 . Bibcode :2020ApJ...901..110P. doi : 10.3847/1538-4357/abae5c . S2CID 221095540.
- ^ Pearce BK, Ayers PW, Pudritz RE (март 2019 г.). «Последовательная редуцированная сеть для химии HCN в ранних атмосферах Земли и Титана: квантовые расчеты коэффициентов скорости реакции». Журнал физической химии A . 123 (9): 1861– 1873. arXiv : 1902.05574 . Bibcode :2019JPCA..123.1861P. doi :10.1021/acs.jpca.8b11323. PMID 30721064. S2CID 73442008.
- ^ Wade N (2015-05-04). «Осмысление химии, которая привела к жизни на Земле». The New York Times . Получено 5 мая 2015 г.
- ^ ab Borowitz JL, Gunasekar PG, Isom GE (сентябрь 1997 г.). «Генерация цианистого водорода активацией мю-опиатных рецепторов: возможная нейромодуляторная роль эндогенного цианида». Brain Research . 768 ( 1– 2): 294– 300. doi : 10.1016/S0006-8993(97)00659-8. PMID 9369328. S2CID 12277593.
- ^ Gunasekar PG, Prabhakaran K, Li L, Zhang L, Isom GE, Borowitz JL (май 2004 г.). «Механизмы рецепторов, опосредующие генерацию цианида в клетках PC12 и мозге крысы». Neuroscience Research . 49 (1): 13– 18. doi :10.1016/j.neures.2004.01.006. PMID 15099699. S2CID 29850349.
- ^ Смит РП, Крушина Х (январь 1976). «Токсикология некоторых неорганических антигипертензивных анионов». Труды Федерации . 35 (1): 69–72 . PMID 1245233.
- ^ Talhout R, Schulz T, Florek E, van Benthem J, Wester P, Opperhuizen A (февраль 2011 г.). «Опасные соединения в табачном дыме». Международный журнал исследований окружающей среды и общественного здравоохранения . 8 (2): 613– 628. doi : 10.3390/ijerph8020613 . PMC 3084482. PMID 21556207 .
- ^ Руис-Бермехо, Марта; Зорзано, Мария-Пас; Осуна-Эстебан, Сусана (2013). «Простые органические вещества и биомономеры, идентифицированные в полимерах HCN: обзор». Life . 3 (3): 421– 448. Bibcode :2013Life....3..421R. doi : 10.3390/life3030421 . PMC 4187177 . PMID 25369814.
- ^ Аль-Азми А., Элассар А.З., Бут Б.Л. (2003). «Химия диаминомалеонитрила и ее применение в гетероциклическом синтезе». Тетраэдр . 59 (16): 2749– 2763. doi :10.1016/S0040-4020(03)00153-4.
- ^ Оберг, Карин (2020-04-10). Галактический рецепт живой планеты . Получено 2024-12-24 – через www.ted.com.
- ^ ab Snyder LE, Buhl D (1971). "Наблюдения радиоизлучения межзвездного цианистого водорода". Astrophysical Journal . 163 : L47 – L52 . Bibcode : 1971ApJ...163L..47S. doi : 10.1086/180664.
- ^ Jørgensen UG (1997). "Cool Star Models". In van Dishoeck EF (ред.). Molecules in Astrophysics: Probes and Processes . Симпозиумы Международного астрономического союза. Molecules in Astrophysics: Probes and Processes. Т. 178. Springer Science & Business Media. стр. 446. ISBN 978-0792345381.
- ^ Treffers RR, Larson HP, Fink U, Gautier TN (1978). «Верхние пределы следовых компонентов в атмосфере Юпитера на основе анализа его 5-мкм спектра». Icarus . 34 (2): 331– 343. Bibcode :1978Icar...34..331T. doi :10.1016/0019-1035(78)90171-9.
- ^ Bieging JH, Shaked S, Gensheimer PD (2000). «Наблюдения SiO и HCN в околозвездных оболочках звезд AGB в субмиллиметровом и миллиметровом диапазонах волн». Astrophysical Journal . 543 (2): 897–921 . Bibcode : 2000ApJ...543..897B. doi : 10.1086/317129 .
- ^ Schilke P, Menten KM (2003). «Обнаружение второй, сильной субмиллиметровой линии лазера HCN в направлении углеродных звезд». Astrophysical Journal . 583 (1): 446– 450. Bibcode :2003ApJ...583..446S. doi : 10.1086/345099 . S2CID 122549795.
- ^ ab Boger GI, Sternberg A (2005). "CN и HCN в плотных межзвездных облаках". Astrophysical Journal . 632 (1): 302– 315. arXiv : astro-ph/0506535 . Bibcode : 2005ApJ...632..302B. doi : 10.1086/432864. S2CID 118958200.
- ^ Gao Y, Solomon PM (2004). «Скорость звездообразования и плотный молекулярный газ в галактиках». Astrophysical Journal . 606 (1): 271– 290. arXiv : astro-ph/0310339 . Bibcode : 2004ApJ...606..271G. doi : 10.1086/382999. S2CID 11335358.
- ^ Gao Y, olomon PM (2004). «HCN Survey of Normal Spiral, Infrared-luminous, and Ultraluminous Galaxies». Серия приложений к астрофизическому журналу . 152 (1): 63– 80. arXiv : astro-ph/0310341 . Bibcode :2004ApJS..152...63G. doi :10.1086/383003. S2CID 9135663.
- ^ Wu J, Evans NJ (2003). «Признаки втекающих движений в регионах, формирующих массивные звезды». Astrophysical Journal . 592 (2): L79 – L82 . arXiv : astro-ph/0306543 . Bibcode :2003ApJ...592L..79W. doi :10.1086/377679. S2CID 8016228.
- ^ Loenen AF (2007). «Молекулярные свойства (U)LIRG: CO, HCN, HNC и HCO + ». Труды симпозиума IAU . 242 : 462– 466. arXiv : 0709.3423 . Bibcode : 2007IAUS..242..462L. doi : 10.1017/S1743921307013609. S2CID 14398456.
- ^ Зубрицкий Э., Нил-Джонс Н. (11 августа 2014 г.). «Выпуск 14-038 – 3-мерное исследование комет НАСА выявило работу химической фабрики». НАСА . Получено 12 августа 2014 г.
- ^ Кординер М.А., Ремижан А.Дж., Буасье Дж., Милам С.Н., Мумма М.Дж., Чарнли С.Б. и др. (11 августа 2014 г.). «Картирование выброса летучих веществ во внутренней коме комет C/2012 F6 (Леммон) и C/2012 S1 (ISON) с использованием большой миллиметровой/субмиллиметровой матрицы Атакамы». Астрофизический журнал . 792 (1): Л2. arXiv : 1408.2458 . Бибкод : 2014ApJ...792L...2C. дои : 10.1088/2041-8205/792/1/L2. S2CID 26277035.
- ^ «Первое обнаружение атмосферы суперземли». ESA/Hubble Information Centre. 16 февраля 2016 г.
- ^ Грин, Хайме (5 декабря 2023 г.). «Что такое жизнь? — Ответ важен в исследовании космоса. Но мы все еще не знаем наверняка». The Atlantic . Архивировано из оригинала 5 декабря 2023 г. . Получено 15 декабря 2023 г. .
- ^ Чанг, Кеннет (14 декабря 2023 г.). «Ядовитый газ намекает на потенциальную возможность жизни на океаническом спутнике Сатурна — исследователь, изучавший ледяной мир, сказал, что «перспективы развития жизни на Энцеладе становятся все лучше и лучше». The New York Times . Архивировано из оригинала 14 декабря 2023 г. . Получено 15 декабря 2023 г. .
- ^ Питер, Джона С.; и др. (14 декабря 2023 г.). «Обнаружение HCN и разнообразной окислительно-восстановительной химии в шлейфе Энцелада». Nature Astronomy . 8 (2): 164– 173. arXiv : 2301.05259 . Bibcode :2024NatAs...8..164P. doi :10.1038/s41550-023-02160-0. S2CID 255825649. Архивировано из оригинала 15 декабря 2023 г. . Получено 15 декабря 2023 г. .
- ^ Шнедлиц, Маркус (2008) Chemische Kampfstoffe: Geschichte, Eigenschaften, Wirkung . ГРИН Верлаг. п. 13. ISBN 3640233603 .
- ^ Оружие войны - Отравляющий газ. firstworldwar.com
- ^ ab Влияние на окружающую среду и здоровье Архивировано 30 ноября 2012 г. на Wayback Machine . Cyanidecode.org. Получено 02 июня 2012 г.
- ^ "Цианистый водород". Организация по запрещению химического оружия . Получено 14.01.2009 .
- ^ Ван Пелт, Роберт Ян ; Дворк, Дебора (1996). Освенцим, 1270 до наших дней . Нортон. стр. 443. ISBN 9780300067552.
- ^ "Синий дым". Химический завод Драсловка как . Получено 2020-07-06 .
- ^ "Ураган Д2". 2015-07-17. Архивировано из оригинала 2015-07-17 . Получено 2022-10-19 .
- ↑ Binkov's Battlegrounds (27 апреля 2022 г.). «Как бы прошла Вторая мировая война, если бы США не применили ядерные бомбы против Японии?». YouTube.Com . Получено 23 июня 2022 г.
- ^ Pilkington, Ed (28 мая 2021 г.). «Аризона „переоборудует“ свою газовую камеру, чтобы подготовиться к казням, свидетельствуют документы». The Guardian . Получено 2022-06-14 .
- ^ "Сайт The Poison Garden". Thepoisongarden.co.uk . Архивировано из оригинала 10 февраля 2020 г. Получено 18 октября 2014 г.
- ^ «Документация по концентрациям, представляющим немедленную опасность для жизни или здоровья (IDLH) – 74908». NIOSH. 2 ноября 2018 г.
Внешние ссылки
- Национальный институт исследований и безопасности (1997 год). «Гидроциан и водные растворы». Токсикологический справочник № 4 , Париж: INRS, 5 стр. (PDF-файл, на французском языке )
- Международная карта химической безопасности 0492
- Цианистый водород и цианиды ( CICAD 61)
- Национальный реестр загрязняющих веществ: информационный листок о цианидных соединениях
- Карманный справочник NIOSH по химическим опасностям
- Обзор Департамента здравоохранения
- Плотность цианистого водорода





