Генетическая устойчивость человека к малярии
Генетическая устойчивость человека к малярии относится к наследственным изменениям в ДНК людей, которые повышают устойчивость к малярии и приводят к повышению выживаемости людей с этими генетическими изменениями. Существование этих генотипов , вероятно, обусловлено эволюционным давлением, оказываемым паразитами рода Plasmodium, вызывающими малярию. Поскольку малярия поражает эритроциты , эти генетические изменения являются наиболее распространенными изменениями молекул, необходимых для функционирования эритроцитов (и, следовательно, выживания паразитов), таких как гемоглобин или другие клеточные белки или ферменты эритроцитов. Эти изменения обычно защищают эритроциты от вторжения паразитов Plasmodium или репликации паразитов внутри эритроцита.
Эти наследственные изменения гемоглобина или других характерных белков, которые являются критическими и довольно инвариантными чертами биохимии млекопитающих, обычно вызывают какое-либо наследственное заболевание. Поэтому их обычно называют по названиям заболеваний крови , связанных с ними, включая серповидноклеточную анемию , талассемию , дефицит глюкозо-6-фосфатдегидрогеназы и другие. Эти заболевания крови вызывают повышенную заболеваемость и смертность в регионах мира, где малярия менее распространена.
Развитие генетической устойчивости к малярии
Микроскопические паразиты , такие как вирусы, простейшие, вызывающие малярию, и другие, не могут размножаться самостоятельно и полагаются на хозяина для продолжения своего жизненного цикла. Они размножаются, вторгаясь в клетки хозяина и захватывая клеточный механизм для самовоспроизводства. В конце концов, неконтролируемая репликация заставляет клетки разрываться, убивая клетки и выпуская инфекционные организмы в кровоток, где они могут заражать другие клетки. По мере того, как клетки умирают и накапливаются токсичные продукты репликации инвазивных организмов, появляются симптомы заболевания. Поскольку этот процесс включает в себя определенные белки, вырабатываемые инфекционным организмом, а также клеткой-хозяином, даже очень небольшое изменение в критическом белке может сделать заражение трудным или невозможным. Такие изменения могут возникнуть в результате процесса мутации в гене, который кодирует этот белок. Если изменение происходит в гамете, то есть сперме или яйцеклетке, которые соединяются, образуя зиготу, которая вырастает в человека, защитная мутация будет унаследована. Поскольку смертельные заболевания убивают многих людей, у которых отсутствуют защитные мутации, со временем многие люди в регионах, где смертельные заболевания являются эндемичными, наследуют защитные мутации. [ необходима цитата ]
Когда паразит P. falciparum заражает клетку-хозяина, он изменяет характеристики мембраны эритроцитов, делая ее «более липкой» к другим клеткам. Скопления паразитированных эритроцитов могут превышать размер капиллярного кровообращения, прилипать к эндотелию и блокировать кровообращение. Когда эти закупорки образуются в кровеносных сосудах, окружающих мозг, они вызывают церебральную гипоксию , что приводит к неврологическим симптомам, известным как церебральная малярия . Это состояние характеризуется спутанностью сознания, дезориентацией и часто терминальной комой . На его долю приходится 80% случаев смерти от малярии. Поэтому мутации, которые защищают от заражения малярией и летальности, представляют собой значительное преимущество. [ необходима цитата ]
Малярия оказала самое сильное известное селективное давление на геном человека с момента возникновения сельского хозяйства в течение последних 10 000 лет. [1] [2] Plasmodium falciparum, вероятно, не смог закрепиться среди африканских популяций, пока не появились более крупные оседлые сообщества в связи с развитием домашнего сельского хозяйства в Африке ( сельскохозяйственная революция ). Несколько унаследованных вариантов в эритроцитах стали обычным явлением в тех частях мира, где малярия является частой, в результате отбора, осуществляемого этим паразитом . [3] Этот отбор был исторически важен как первый задокументированный пример болезни как агента естественного отбора у людей . Это также был первый пример генетически контролируемого врожденного иммунитета , который действует на ранних стадиях инфекции, предшествуя адаптивному иммунитету, который оказывает влияние через несколько дней. При малярии, как и при других заболеваниях, врожденный иммунитет приводит к адаптивному иммунитету и стимулирует его . [ необходима ссылка ]
Мутации могут иметь как вредные, так и полезные эффекты, и любая отдельная мутация может иметь и то, и другое. Инфекционность малярии зависит от специфических белков, присутствующих в клеточных стенках и в других местах эритроцитов. Защитные мутации изменяют эти белки таким образом, что они становятся недоступными для возбудителей малярии. Однако эти изменения также изменяют функционирование и форму эритроцитов, что может иметь видимые эффекты, как явно, так и при микроскопическом исследовании эритроцитов. Эти изменения могут нарушать функцию эритроцитов различными способами, что оказывает пагубное влияние на здоровье или продолжительность жизни человека. Однако, если чистый эффект защиты от малярии перевешивает другие пагубные эффекты, защитная мутация будет иметь тенденцию сохраняться и передаваться из поколения в поколение. [ необходима цитата ]
Эти изменения, которые защищают от малярийных инфекций, но ухудшают красные кровяные клетки, обычно считаются заболеваниями крови, поскольку они, как правило, имеют явные и пагубные последствия. Их защитная функция была обнаружена и признана только в последнее время. Некоторые из этих заболеваний известны под причудливыми и загадочными названиями, такими как серповидноклеточная анемия, талассемия, дефицит глюкозо-6-фосфатдегидрогеназы, овалоцитоз, эллиптоцитоз и потеря антигена Гербиха и антигена Даффи. Эти названия относятся к различным белкам, ферментам и форме или функции красных кровяных клеток. [ необходима цитата ]
Врожденное сопротивление
Мощный эффект генетически контролируемой врожденной резистентности отражается в вероятности выживания маленьких детей в районах, где малярия является эндемичной. Необходимо изучать врожденный иммунитет в восприимчивой возрастной группе (моложе четырех лет), поскольку у детей старшего возраста и взрослых эффекты врожденного иммунитета затмеваются эффектами адаптивного иммунитета. Также необходимо изучать популяции, в которых не происходит случайного использования противомалярийных препаратов . Некоторые ранние вклады в изучение врожденной резистентности к инфекциям позвоночных, включая людей, обобщены в Таблице 1.
| Год открытия | Возбудитель | Механизм сопротивления | Авторы |
|---|---|---|---|
| 1954 | P. falciparum | Серповидноклеточная гетерозигота | Эллисон [4] |
| 1975 | П. ноулеси | Отсутствие экспрессии антигена Даффи на эритроцитах | Миллер и др. |
| 1976 | P. vivax | Отсутствие экспрессии антигена Даффи на эритроцитах | Миллер и др. [5] |
Примечательно, что два из первых исследований были посвящены малярии. Классические исследования рецептора Toll у плодовой мушки Drosophila [6] были быстро распространены на рецепторы Toll-like у млекопитающих [7] , а затем и на другие рецепторы распознавания образов , которые играют важную роль во врожденном иммунитете. Однако ранние работы по малярии остаются классическими примерами врожденной устойчивости, которые выдержали испытание временем. [ необходима цитата ]
Механизмы защиты
Механизмы, посредством которых эритроциты, содержащие аномальные гемоглобины или дефицитные по G6PD, частично защищены от инфекций P. falciparum , до конца не изучены, хотя недостатка в предположениях нет. Во время периферической стадии репликации в крови малярийные паразиты потребляют большое количество кислорода [ 8] и поглощают большое количество гемоглобина. [9] Вероятно, что HbS в эндоцитарных пузырьках дезоксигенируется, полимеризуется и плохо переваривается. В эритроцитах, содержащих аномальные гемоглобины или дефицитных по G6PD, образуются кислородные радикалы , и малярийные паразиты вызывают дополнительный окислительный стресс. [10] Это может привести к изменениям в мембранах эритроцитов, включая транслокацию фосфатидилсерина на их поверхность [ жаргон ] с последующим распознаванием и поглощением макрофагами. [11] Авторы предполагают, что этот механизм, вероятно, возникает раньше в аномальных, чем в нормальных эритроцитах, тем самым ограничивая размножение в первых. Кроме того, связывание паразитированных серповидных клеток с эндотелиальными клетками значительно снижается из-за измененного проявления белка-1 мембраны эритроцитов P. falciparum (PfMP-1). [12] Этот белок является основным лигандом цитоадгезии паразита и фактором вирулентности на поверхности клетки. На поздних стадиях репликации паразита эритроциты прилипают к венозному эндотелию, и ингибирование этого прикрепления может подавить репликацию. [ необходима цитата ]
Серповидный гемоглобин индуцирует экспрессию гем-оксигеназы-1 в кроветворных клетках. Окись углерода , побочный продукт катаболизма гема гем-оксигеназой -1 (HO-1), предотвращает накопление циркулирующего свободного гема после заражения плазмодием , подавляя патогенез экспериментальной церебральной малярии. [13] Были описаны и другие механизмы, такие как повышенная толерантность к болезням, опосредованная HO-1, и снижение паразитарного роста из-за транслокации микроРНК хозяина в паразита. [14]
Типы врожденной резистентности
Первая линия защиты от малярии в основном осуществляется аномальными гемоглобинами и дефицитом глюкозо-6-фосфатдегидрогеназы. Три основных типа наследственной генетической резистентности — серповидноклеточная анемия , талассемии и дефицит G6PD — присутствовали в средиземноморском мире ко времени Римской империи . [ требуется цитата ]
Нарушения гемоглобина
Распределение аномальных гемоглобинов

Малярия не встречается в более прохладном и сухом климате высокогорий в тропических и субтропических регионах мира. Были изучены десятки тысяч людей, и высокие частоты аномальных гемоглобинов не были обнаружены ни в одной популяции, которая была бы свободна от малярии. Частоты аномальных гемоглобинов в разных популяциях сильно различаются, но некоторые из них, несомненно, полиморфны, имея частоты выше, чем ожидалось из-за повторяющейся мутации. Больше нет сомнений в том, что малярийный отбор сыграл важную роль в распространении всех этих полиморфизмов. Все они находятся в малярийных районах, [ требуется ссылка ]
- Серповидноклеточная анемия – ген HbS, связанный с серповидноклеточной анемией, сегодня широко распространен по всей Африке к югу от Сахары, на Ближнем Востоке и в некоторых частях Индийского субконтинента, где частота носителей колеблется от 5 до 40% и более от населения. Частота гетерозигот по серповидноклеточной анемии составляла 20–40% в малярийных районах Кении , Уганды и Танзании . Более поздние исследования многих исследователей дополнили картину. [15] [16] Высокие частоты гена HbS ограничены широким поясом по всей Центральной Африке , но исключают большую часть Эфиопии и восточноафриканского нагорья ; это близко соответствует областям передачи малярии. Частоты гетерозигот по серповидноклеточной анемии до 20% также встречаются в районах Индии и Греции , которые ранее были сильно малярийными.
Талассемии широко распространены в широком диапазоне, простирающемся от Средиземноморского бассейна и некоторых частей Африки, по всему Ближнему Востоку, Индийскому субконтиненту, Юго-Восточной Азии, Меланезии и на островах Тихого океана.
- α-талассемия, частота которой достигает 30% в некоторых частях Западной Африки; [17]
- β-талассемия, частота которой в некоторых частях Италии достигает 10%;
- HbE , частота которого достигает 55% в Таиланде и других странах Юго-Восточной Азии; [18] HbE встречается в восточной половине Индийского субконтинента и по всей Юго-Восточной Азии, где в некоторых районах показатели носительства могут превышать 60% населения.
- HbC , частота которого достигает 20% в северной Гане и Буркина-Фасо. HbC ограничен частями Западной и Северной Африки. [ необходима цитата ]
- одновременные полиморфизмы – двойные гетерозиготы по HbS и β-талассемии, а также по HbS и HbC, страдают от вариантов серповидноклеточной анемии, более легких, чем SS, но, вероятно, снижающих приспособленность до появления современного лечения. Как и предполагалось, эти вариантные аллели, как правило, являются взаимоисключающими в популяциях. Существует отрицательная корреляция между частотами HbS и β-талассемии в разных частях Греции и HbS и HbC в Западной Африке. [19] Там, где нет неблагоприятного взаимодействия мутаций, как в случае аномальных гемоглобинов и дефицита G6PD, можно было бы ожидать положительной корреляции этих вариантных аллелей в популяциях, и она была обнаружена. [19]
Серповидная клетка
This section is missing information about Mendelian genetics, nature of sickle-cell disease, extent of protection against malaria, Plasmodia species affected, protein chemistry that causes RBCs to deform. (April 2014) |
Серповидноклеточная анемия была генетическим заболеванием, связанным с мутацией определенного белка. Полинг представил свою фундаментально важную концепцию серповидноклеточной анемии как генетически передаваемого молекулярного заболевания. [20]
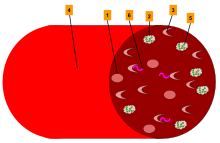
Молекулярная основа серповидноклеточной анемии была окончательно выяснена в 1959 году, когда Ингрэм усовершенствовал методы триптического пептидного отпечатка пальцев. В середине 1950-х годов одним из новейших и самых надежных способов разделения пептидов и аминокислот был фермент трипсин, который расщеплял полипептидные цепи путем специфического разрушения химических связей, образованных карбоксильными группами двух аминокислот, лизина и аргинина. Небольшие различия в гемоглобине A и S приведут к небольшим изменениям в одном или нескольких из этих пептидов. [21] Чтобы попытаться обнаружить эти небольшие различия, Ингрэм объединил методы бумажного электрофореза и бумажной хроматографии. С помощью этой комбинации он создал двумерный метод, который позволил ему сравнительно «снять отпечатки пальцев» фрагментов гемоглобина S и A, которые он получил из триспина. Отпечатки пальцев выявили около 30 пептидных пятен, одно пептидное пятно было четко видно в переваривании гемоглобина S, которое не было очевидно в отпечатке гемоглобина A. Дефект гена HbS представляет собой мутацию одного нуклеотида (A на T) гена β-глобина, заменяющую аминокислоту глутаминовую кислоту на менее полярную аминокислоту валин в шестой позиции β-цепи. [22]
HbS имеет более низкий отрицательный заряд при физиологическом pH, чем нормальный гемоглобин взрослого человека. Последствия простой замены заряженной аминокислоты гидрофобной нейтральной аминокислотой весьма многообразны. Недавние исследования в Западной Африке показывают, что наибольшее воздействие Hb S, по-видимому, заключается в защите от смерти или тяжелой болезни, то есть от глубокой анемии или церебральной малярии, при этом оказывая меньшее влияние на инфекцию как таковую. Дети, гетерозиготные по гену серповидноклеточной анемии, имеют только одну десятую риска смерти от тропической лихорадки, как и те, кто гомозиготен по нормальному гену гемоглобина. Связывание паразитированных серповидноклеточных эритроцитов с эндотелиальными клетками и моноцитами крови значительно снижается из-за измененного проявления белка мембраны эритроцитов Plasmodium falciparum 1 (PfEMP-1), основного лиганда цитоадгезии паразита и фактора вирулентности на поверхности эритроцитов. [23]
Защита также происходит из-за нестабильности серповидного гемоглобина, который кластеризует преобладающий интегральный белок мембраны эритроцитов (называемый полосой 3) и запускает ускоренное удаление фагоцитарными клетками. Естественные антитела распознают эти кластеры на стареющих эритроцитах. Защита HbAS включает в себя усиление не только врожденного, но и приобретенного иммунитета к паразиту. [24] Преждевременно денатурированный серповидный гемоглобин приводит к повышению регуляции естественных антител, которые контролируют адгезию эритроцитов как при малярии, так и при серповидноклеточной анемии. [25] Нацеливание на стимулы, которые приводят к активации эндотелия, будет представлять собой многообещающую терапевтическую стратегию для ингибирования адгезии серповидных эритроцитов и вазоокклюзии. [26]
Это привело к гипотезе о том, что в то время как гомозиготы по гену серповидноклеточной анемии страдают от болезни, гетерозиготы могут быть защищены от малярии. [27] Малярия остается селективным фактором для серповидноклеточной анемии. [28]
Талассемии
Давно известно, что вид анемии, называемый талассемией , имеет высокую частоту среди некоторых средиземноморских популяций, включая греков и южных итальянцев. Название происходит от греческих слов «море» ( thalassa ), что означает Средиземное море , и «кровь» ( haima ). Вернон Ингрэм заслуживает признания за объяснение генетической основы различных форм талассемии как дисбаланса в синтезе двух полипептидных цепей гемоглобина. [29]
В распространенном средиземноморском варианте мутации снижают выработку β-цепи (β-талассемия). При α-талассемии, которая относительно часто встречается в Африке и ряде других стран, выработка α-цепи гемоглобина нарушена, и наблюдается относительное перепроизводство β-цепи. Индивидуумы, гомозиготные по β-талассемии, страдают тяжелой анемией и вряд ли выживут и оставят потомство, поэтому отбор против гена силен. Те, кто гомозиготны по α-талассемии, также страдают от анемии, и существует некоторая степень отбора против гена. [ необходима цитата ]
Нижние предгорья Гималаев и внутренние долины Тераи или Дун в Непале и Индии являются высоко малярийными из-за теплого климата и болот, поддерживаемых в сухой сезон грунтовыми водами, просачивающимися вниз с более высоких холмов. Малярийные леса намеренно поддерживались правителями Непала в качестве защитной меры. Люди, пытавшиеся жить в этой зоне, страдали от гораздо более высокой смертности, чем на более высоких высотах или ниже на более сухой Гангской равнине . Однако народ тхару жил в этой зоне достаточно долго, чтобы развить устойчивость через несколько генов. Медицинские исследования среди населения тхару и не-тхару в Тераи дали доказательства того, что распространенность случаев остаточной малярии почти в семь раз ниже среди тхару. Было установлено, что основой устойчивости является гомозиготность гена α-талассемии среди местного населения. [30] Эндогамия по кастовым и этническим признакам, по-видимому, предотвратила более широкое распространение этих генов в соседних популяциях. [31]
Эритроиды HbC и HbE
Имеются данные, что люди с α-талассемией, HbC и HbE имеют некоторую степень защиты от паразита. [17] [32] Гемоглобин C (HbC) — это аномальный гемоглобин с заменой остатка лизина на остаток глутаминовой кислоты цепи β-глобина, в той же самой позиции β-6, что и мутация HbS. Обозначение «C» для HbC происходит от названия города, где он был обнаружен — Крайстчерч, Новая Зеландия. Люди, страдающие этим заболеванием, особенно дети, могут иметь эпизоды болей в животе и суставах, увеличенную селезенку и легкую желтуху, но у них не бывает тяжелых кризов, как это происходит при серповидноклеточной анемии. Гемоглобин C распространен в малярийных районах Западной Африки, особенно в Буркина-Фасо. В крупном исследовании случай-контроль, проведенном в Буркина-Фасо на 4348 субъектах Мосси, HbC был связан с 29% снижением риска клинической малярии у гетерозигот HbAC и на 93% у гомозигот HbCC. HbC представляет собой «медленную, но бесплатную» генетическую адаптацию к малярии через транзитный полиморфизм, по сравнению с полицентрической «быстрой, но дорогостоящей» адаптацией через сбалансированный полиморфизм HbS. [33] [34] HbC изменяет количество и распределение вариантного антигена белка мембраны эритроцитов P. falciparum 1 (PfEMP1) на поверхности инфицированных эритроцитов, а измененное отображение поверхностных белков малярии снижает адгезивность паразита (тем самым избегая очищения селезенкой) и может снизить риск тяжелого заболевания. [35] [36]
Гемоглобин E обусловлен единственной точечной мутацией в гене бета-цепи с заменой глутамата на лизин в позиции 26. Это одна из самых распространенных гемоглобинопатий, от которой страдают 30 миллионов человек. Гемоглобин E очень распространен в некоторых частях Юго-Восточной Азии. Эритроциты HbE имеют неопознанную мембранную аномалию, которая делает большую часть популяции эритроцитов относительно устойчивой к вторжению P. falciparum . [37]
Другие мутации эритроцитов
Другие генетические мутации, помимо аномалий гемоглобина, которые обеспечивают устойчивость к инфекции Plasmodia , включают изменения антигенных белков клеточной поверхности , структурных белков клеточной мембраны или ферментов, участвующих в гликолизе . [ необходима ссылка ]
Дефицит глюкозо-6-фосфатдегидрогеназы
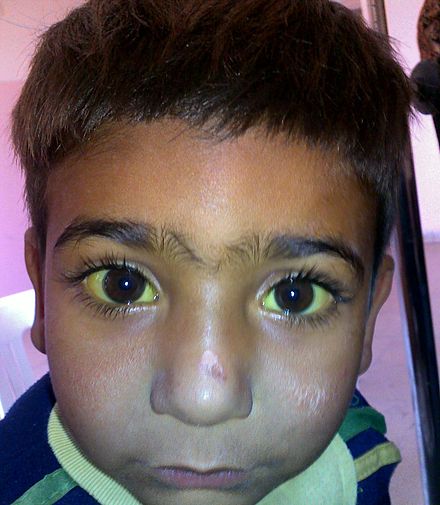
Глюкозо-6-фосфатдегидрогеназа (G6PD) является важным ферментом в эритроцитах, метаболизирующим глюкозу через пентозофосфатный путь , анаболическую альтернативу катаболическому окислению (гликолизу), при этом поддерживая восстановительную среду. [38] G6PD присутствует во всех клетках человека, но особенно важен для эритроцитов. Поскольку зрелые эритроциты не имеют ядер и цитоплазматической РНК , они не могут синтезировать новые молекулы ферментов для замены генетически ненормальных или стареющих. Все белки, включая ферменты, должны существовать в течение всей жизни эритроцита, которая обычно составляет 120 дней. [ необходима цитата ]
В 1956 году Альвинг и его коллеги показали, что у некоторых афроамериканцев противомалярийный препарат примахин вызывает гемолитическую анемию, и что эти люди имеют наследственный дефицит Г6ФД в эритроцитах. [39] Дефицит Г6ФД связан с полом и распространен в средиземноморских, африканских и других популяциях. В средиземноморских странах у таких людей может развиться гемолитический диатез ( фавизм ) после употребления конских бобов . Люди с дефицитом Г6ФД также чувствительны к нескольким препаратам в дополнение к примахину. [ необходима цитата ]
Дефицит G6PD является вторым по распространенности дефицитом фермента у людей (после дефицита ALDH2 ), который, по оценкам, затрагивает около 400 миллионов человек. [40] В этом локусе существует множество мутаций, две из которых достигают частоты 20% или выше в африканских и средиземноморских популяциях; они называются мутациями A- и Med. [41] Мутантные разновидности G6PD могут быть более нестабильными, чем естественный фермент, поэтому их активность снижается быстрее по мере старения эритроцитов.
Этот вопрос изучался в изолированных популяциях, где не применялись противомалярийные препараты в Танзании, Восточная Африка [42] и в Республике Гамбия , Западная Африка, наблюдая за детьми в период, когда они наиболее восприимчивы к малярии falciparum . [43] В обоих случаях количество паразитов было значительно ниже у лиц с дефицитом G6PD, чем у лиц с нормальными ферментами эритроцитов. Связь также изучалась у отдельных лиц, что возможно, поскольку дефицит фермента связан с полом, а женские гетерозиготы являются мозаичными из-за лионизации , когда случайная инактивация Х-хромосомы в определенных клетках создает популяцию эритроцитов с дефицитом G6PD, сосуществующих с нормальными эритроцитами. Малярийные паразиты значительно чаще наблюдались в нормальных эритроцитах, чем в клетках с дефицитом ферментов. [44] Эволюционно-генетический анализ малярийной селекции генов дефицита G6PD был опубликован Тишкоффом и Верелли. [41] Дефицит фермента распространен во многих странах, где в настоящее время или ранее наблюдалась малярия, но не в других местах. [ необходима цитата ]
Дефицит PK
Дефицит пируваткиназы (ПК), также называемый дефицитом пируваткиназы эритроцитов, является наследственным нарушением метаболизма фермента пируваткиназы. При этом состоянии недостаток пируваткиназы замедляет процесс гликолиза. Этот эффект особенно разрушительный в клетках, в которых отсутствуют митохондрии, поскольку эти клетки должны использовать анаэробный гликолиз в качестве единственного источника энергии, поскольку цикл трикарбоновых кислот недоступен. Одним из примеров являются эритроциты, которые в состоянии дефицита пируваткиназы быстро становятся дефицитными по АТФ и могут подвергаться гемолизу. Таким образом, дефицит пируваткиназы может вызвать гемолитическую анемию. [ необходима цитата ]
Существует значительная корреляция между тяжестью дефицита PK и степенью защиты от малярии. [45]
Эллиптоцитоз
Эллиптоцитоз, заболевание крови, при котором аномально большое количество эритроцитов пациента имеют эллиптическую форму. Среди больных наблюдается большая генетическая изменчивость. Существует три основные формы наследственного эллиптоцитоза: общий наследственный эллиптоцитоз, сфероцитарный эллиптоцитоз и юго-восточноазиатский овалоцитоз . [ необходима цитата ]
Юго-восточноазиатский овалоцитоз

Овалоцитоз является подтипом эллиптоцитоза и представляет собой наследственное заболевание, при котором эритроциты имеют овальную, а не круглую форму. В большинстве популяций овалоцитоз встречается редко, но юго-восточноазиатский овалоцитоз (SAO) встречается у 15% коренных жителей Малайзии и Папуа -Новой Гвинеи . Было зарегистрировано несколько аномалий эритроцитов SAO, включая повышенную жесткость эритроцитов и сниженную экспрессию некоторых антигенов эритроцитов. [47] SAO вызывается мутацией в гене, кодирующем белок полосы 3 эритроцитов . В гене происходит делеция кодонов 400–408, что приводит к делеции 9 аминокислот на границе между цитоплазматическим и трансмембранным доменами белка полосы 3. [48] Полоса 3 служит основным местом связывания для мембранного скелета, подмембранной белковой сети, состоящей из анкирина , спектрина , актина и полосы 4.1 . Овалоцитная полоса 3 связывается более прочно, чем обычная полоса 3, с анкирином, который соединяет мембранный скелет с транспортером анионов полосы 3. Эти качественные дефекты создают мембрану эритроцита, которая менее устойчива к сдвиговому напряжению и более восприимчива к постоянной деформации. [ необходима цитата ]

SAO ассоциируется с защитой от церебральной малярии у детей, поскольку он снижает секвестрацию эритроцитов, паразитирующих на P. falciparum, в микрососудах мозга. [49] Адгезия инфицированных P. falciparum эритроцитов к CD36 усиливается защитным свойством SAO от церебральной малярии. Более высокая эффективность секвестрации через CD36 у лиц с SAO может определять различное распределение по органам секвестрированных инфицированных эритроцитов. Это дает возможное объяснение селективного преимущества, предоставляемого SAO против церебральной малярии. [50]
Отрицательность рецептора антигена Даффи
Plasmodium vivax широко распространен в тропических странах, но отсутствует или встречается редко в большом регионе Западной и Центральной Африки, что недавно подтвердилось с помощью ПЦР-типирования видов. [51] Этот разрыв в распространении объясняется отсутствием экспрессии рецептора антигена Даффи для хемокинов (DARC) на эритроцитах многих африканцев к югу от Сахары. Индивидуумы с отрицательным результатом анализа Даффи являются гомозиготными по аллелю DARC, несущими мутацию одного нуклеотида (DARC 46 T → C), которая нарушает активность промотора, нарушая сайт связывания для фактора транскрипции эритроидной линии hGATA1. [ жаргон ] [52] В широко цитируемых исследованиях in vitro и in vivo Миллер и др. сообщили, что группа крови Даффи является рецептором для P. vivax и что отсутствие группы крови Даффи на эритроцитах является фактором устойчивости к P. vivax у лиц африканского происхождения. [5] Это стало известным примером врожденной устойчивости к инфекционному агенту из-за отсутствия рецептора для агента на целевых клетках. [ необходима цитата ]
Однако накопились наблюдения, показывающие, что первоначальный отчет Миллера нуждается в уточнении. В исследованиях передачи P. vivax на людях есть доказательства передачи P. vivax среди популяций с отрицательным результатом по Даффи в Западной Кении [53] , бразильском регионе Амазонки [54] и на Мадагаскаре . [55] У малагасийцев на Мадагаскаре есть примесь людей с положительным и отрицательным результатом по Даффи разного этнического происхождения. [56] Было обнаружено, что 72% населения острова являются людьми с отрицательным результатом по Даффи. Положительный результат по P. vivax был обнаружен у 8,8% из 476 бессимптомных людей с отрицательным результатом по Даффи, а клиническая малярия P. vivax была обнаружена у 17 таких людей. Генотипирование показало, что множественные штаммы P. vivax проникали в эритроциты людей с отрицательным результатом по Даффи. Авторы предполагают, что среди малагасийских популяций достаточно людей с положительным результатом теста на Даффи, чтобы поддерживать передачу комаров и заражение печени. Совсем недавно в Анголе и Экваториальной Гвинее были обнаружены люди с отрицательным результатом теста на Даффи, инфицированные двумя различными штаммами P. vivax ; кроме того, инфекции P. vivax были обнаружены как у людей, так и у комаров, что означает, что происходит активная передача. Частота такой передачи до сих пор неизвестна. [57] Из-за этих нескольких сообщений из разных частей света ясно, что некоторые варианты P. vivax передаются людям, которые не экспрессируют DARC на своих эритроцитах. То же самое явление наблюдалось у обезьян Нового Света. [Примечание 1] Однако DARC по-прежнему, по-видимому, является основным рецептором для передачи P. vivax человеку .
Распространение отрицательности Даффи в Африке не коррелирует точно с распространением P. vivax . [51] Частоты отрицательности Даффи столь же высоки в Восточной Африке (более 80%), где паразит передается, как и в Западной Африке, где он не передается. Эффективность P. vivax как агента естественного отбора неизвестна и может варьироваться от места к месту. Негативность DARC остается хорошим примером врожденной устойчивости к инфекции, но она вызывает относительную, а не абсолютную устойчивость к передаче P. vivax . [ необходима цитата ]

Негативность рецептора антигена Гербиха
Система антигенов Gerbich является интегральным мембранным белком эритроцита и играет функционально важную роль в поддержании формы эритроцита. Она также действует как рецептор для белка связывания эритроцитов P. falciparum . Существует четыре аллеля гена, кодирующего антиген, Ge-1 до Ge-4. Известны три типа негативности антигена Ge: Ge-1,-2,-3, Ge-2,-3 и Ge-2,+3. Лица с относительно редким фенотипом Ge-1,-2,-3 менее восприимчивы (~60% от контрольной частоты) к инвазии P. falciparum . Такие лица имеют подтип состояния, называемого наследственным эллиптоцитозом , который характеризуется овальной или эллиптической формой эритроцитов. [ необходима цитата ]
Другие редкие мутации эритроцитов
Известно также, что редкие мутации белков гликофорина А и В обусловливают устойчивость к P. falciparum .
Полиморфизмы антигенов лейкоцитов человека
Полиморфизмы человеческого лейкоцитарного антигена (HLA), распространенные у западных африканцев, но редкие у других расовых групп, связаны с защитой от тяжелой малярии. Эта группа генов кодирует белки, представляющие антиген на поверхности клеток, и имеет много других функций. В Западной Африке они отвечают за такое же значительное снижение заболеваемости, как и вариант серповидноклеточного гемоглобина. Исследования показывают, что необычный полиморфизм генов главного комплекса гистосовместимости развился в первую очередь путем естественного отбора инфекционными патогенами. [ необходима цитата ]
Полиморфизмы в локусах HLA, которые кодируют белки, участвующие в презентации антигена, влияют на течение малярии. В Западной Африке антиген HLA класса I (HLA Bw53) и гаплотип HLA класса II (DRB1*13OZ-DQB1*0501) независимо связаны с защитой от тяжелой малярии. [60] Однако корреляции HLA различаются в зависимости от генетической конституции полиморфного малярийного паразита, которая различается в разных географических точках. [61] [62]
Наследственная персистенция фетального гемоглобина
Некоторые исследования показывают, что высокий уровень фетального гемоглобина (HbF) обеспечивает некоторую защиту от тропической малярии у взрослых с наследственной персистенцией фетального гемоглобина . [63]
Подтверждение гипотезы малярии
Эволюционный биолог Дж. Б. С. Холдейн был первым, кто выдвинул гипотезу о связи между малярией и генетическим заболеванием. Впервые он представил свою гипотезу на Восьмом международном генетическом конгрессе, состоявшемся в 1948 году в Стокгольме, на тему «Скорость мутации человеческих генов». [64] Он формализовал ее в технической статье, опубликованной в 1949 году, в которой сделал пророческое заявление: «Корпускулы анемичных гетерозигот меньше, чем нормальные, и более устойчивы к гипотоническим растворам. По крайней мере, можно предположить, что они также более устойчивы к атакам споровиков, вызывающих малярию». [65] Это стало известно как «гипотеза малярии Холдейна» или, кратко, «гипотеза малярии». [66]

Подробное исследование когорты из 1022 кенийских детей, живущих около озера Виктория , опубликованное в 2002 году, подтвердило это предсказание. [67] Многие дети с синдромом Аспергера все еще умирали, не достигнув возраста одного года. Было обнаружено, что в возрасте от 2 до 16 месяцев смертность у детей с синдромом Аспергера была значительно ниже, чем у детей с синдромом АА. Это хорошо контролируемое исследование показывает продолжающееся действие естественного отбора через болезни в человеческой популяции. [ необходима цитата ]
Анализ геномной ассоциации (GWA) и картирование ассоциаций с высоким разрешением являются мощным методом установления наследования устойчивости к инфекциям и другим заболеваниям. Было проведено два независимых предварительных анализа ассоциации GWA с тяжелой тропической малярией у африканцев: один — консорциумом Malariagen в популяции Гамбии, а другой — Рольфом Хорстманном (Институт тропической медицины Бернхарда Нохта, Гамбург) и его коллегами в популяции Ганы. В обоих случаях единственным сигналом ассоциации, достигающим общегеномной значимости, был локус HBB, кодирующий β -цепь гемоглобина, которая является аномальной в HbS. [68] Это не означает, что HbS — единственный ген, обеспечивающий врожденную устойчивость к тропической малярии; может быть много таких генов, оказывающих более скромные эффекты, которые сложно обнаружить с помощью GWA из-за низкого уровня неравновесия сцепления в африканских популяциях. Однако та же ассоциация GWA в двух популяциях является убедительным доказательством того, что единственный ген, обеспечивающий самую сильную врожденную устойчивость к тропической малярии, кодирует HbS. [ необходима цитата ]
Приспособленность различных генотипов
Приспособленность различных генотипов в африканском регионе, где наблюдается интенсивный малярийный отбор, была оценена Энтони Эллисоном в 1954 году . [69] В популяции баамба , проживающей в районе леса Семлики в Западной Уганде, частота гетерозигот по серповидноклеточной анемии (AS) составляет 40%, что означает, что частота гена серповидноклеточной анемии составляет 0,255, а 6,5% рожденных детей являются гомозиготами SS. [Примечание 2] Разумно предположить, что до появления современного лечения три четверти гомозигот SS не могли размножаться. Чтобы компенсировать эту потерю генов серповидноклеточной анемии, необходима частота мутаций 1:10,2 на ген на поколение. Это примерно в 1000 раз больше, чем частота мутаций, измеренная у дрозофилы и других организмов, и намного выше, чем зафиксировано для локуса серповидноклеточной анемии у африканцев. [70] Чтобы сбалансировать полиморфизм, Энтони Эллисон подсчитал, что приспособленность гетерозиготы AS должна быть в 1,26 раза выше, чем у нормальной гомозиготы. Более поздние анализы показателей выживаемости дали схожие результаты, с некоторыми различиями от участка к участку. У гамбийцев было подсчитано, что гетерозиготы AS имеют 90% защиты от тяжелой анемии и церебральной малярии, связанной с P. falciparum , [60] тогда как у популяции луо в Кении было подсчитано, что гетерозиготы AS имеют 60% защиты от тяжелой малярийной анемии. [67] Эти различия отражают интенсивность передачи малярии P. falciparum от местности к местности и от сезона к сезону, поэтому расчеты приспособленности также будут различаться. Во многих африканских популяциях частота AS составляет около 20%, и превосходство приспособленности над теми, у кого нормальный гемоглобин, порядка 10% достаточно для получения стабильного полиморфизма. [ необходима цитата ]
Глоссарий
- актин, анкрин, спектрин – белки, которые являются основными компонентами цитоскелета, образующего каркас внутри цитоплазмы клетки
- аэробный – использует кислород для производства энергии (в отличие от анаэробного )
- аллель – одна из двух или более альтернативных форм гена, возникающих в результате мутации
- α-цепь/β-цепь (гемоглобин) – субкомпоненты молекулы гемоглобина; две α-цепи и две β-цепи составляют нормальный гемоглобин (HbA)
- альвеолярный – относящийся к альвеолам, крошечным воздушным мешочкам в легких
- аминокислота – любое из двадцати органических соединений, являющихся субъединицами белка в организме человека
- анаболический – относящийся к синтезу сложных молекул в живых организмах из более простых
- вместе с запасанием энергии; конструктивный метаболизм (в отличие от катаболического )
- анаэробный – относится к процессу или реакции, которая не требует кислорода, но производит энергию другими способами (в отличие от аэробного )
- переносчик анионов (органический) – молекулы, которые играют важную роль в распределении и выведении многочисленных эндогенных продуктов метаболизма и экзогенных органических анионов
- антиген – любое чужеродное для организма вещество (как иммуноген или гаптен), которое вызывает иммунный ответ либо само по себе, либо после образования комплекса с более крупной молекулой (как белок) и которое способно связываться с компонентом (как антитело или Т-клетка) иммунной системы
- АТФ ( аденозинтрифосфат ) – органическая молекула, содержащая высокоэнергетические фосфатные связи, используемые для транспортировки энергии внутри клетки.
- катаболический – относящийся к распаду сложных молекул в живых организмах с образованием более простых, сопровождающемуся высвобождением энергии; деструктивный метаболизм (в отличие от анаболического )
- хемокины – это семейство небольших цитокинов, или сигнальных белков, секретируемых клетками
- кодон – последовательность из трех нуклеотидов, которая определяет, какая аминокислота будет добавлена следующей в ходе синтеза белка
- корпускула — устаревшее название эритроцита
- цитоадгезия – инфицированные эритроциты могут прилипать к стенкам кровеносных сосудов и неинфицированным эритроцитам
- цитоплазма – прозрачное желеобразное вещество, в основном вода, внутри клетки
- диатез – склонность к определенному заболеванию
- ДНК – дезоксирибонуклеиновая кислота, наследственный материал генома
- Дрозофила — вид плодовой мушки, используемый для генетических экспериментов из-за простоты размножения и манипуляций с ее геномом.
- эндоцитоз – транспорт твердого вещества или жидкости в клетку с помощью покрытой вакуоли или везикулы
- эндогамия — обычай заключать браки только в пределах местной общины, клана или племени
- эндотелиальный – относящийся к тонкой внутренней поверхности кровеносных сосудов
- фермент – белок, который стимулирует клеточный процесс, подобно катализатору в обычной химической реакции.
- эпидемиология – изучение распространения болезней среди населения
- эритроцит – красное кровяное тельце, которое вместе с лейкоцитами составляет клеточный состав крови (контрастный лейкоцит )
- эритроидный – относящийся к эритроцитам, красным кровяным клеткам
- приспособленность (генетическая) – в широком смысле, репродуктивный успех, который имеет тенденцию распространять признак или признаки (см. естественный отбор )
- геном – (абстрактно) все наследуемые признаки организма; представлены его хромосомами
- генотип – генетическая структура клетки, организма или индивидуума, обычно со ссылкой на определенный признак
- гликолиз – расщепление глюкозы ферментами с высвобождением энергии
- гликофорин – трансмембранный белок эритроцитов
- гаплотип — набор вариаций ДНК, или полиморфизмов, которые, как правило, наследуются вместе.
- Hb (HbC, HbE, HbS и т.д.) гемоглобин (полиморфизмы гемоглобина: гемоглобин типа C, гемоглобин типа E,
- гемоглобин типа S)
- кроветворные (стволовые клетки) – стволовые клетки крови, которые дают начало всем остальным клеткам крови
- гем-оксигеназа-1 (ГО-1) – фермент, расщепляющий гем, железосодержащую небелковую часть гемоглобина
- гемоглобин – органическая молекула на основе железа в эритроцитах, которая переносит кислород и придает крови красный цвет
- гемолиз – разрыв эритроцитов и выброс их содержимого (цитоплазмы) в окружающую жидкость (например, плазму крови)
- гетерозиготный – обладающий только одной копией гена для определенного признака
- гомозиготный – обладающий двумя идентичными копиями гена определенного признака, по одной от каждого родителя
- гипотонический – обозначает раствор с более низким осмотическим давлением, чем другой раствор, с которым он контактирует, так что некоторые молекулы будут мигрировать из области с более высоким осмотическим давлением в область с более низким осмотическим давлением, пока давления не выровняются
- in vitro – в пробирке или другом лабораторном сосуде; обычно используется в отношении протокола тестирования
- in vivo – на живом человеке (или животном); обычно используется в отношении протокола тестирования
- лейкоцит – белая кровяная клетка, часть иммунной системы, которая вместе с красными кровяными клетками составляет клеточный компонент крови (контрастный эритроцит )
- лиганд – внеклеточная сигнальная молекула, которая при связывании с клеточным рецептором вызывает ответ клетки
- локус (ген или хромосома) – определенное местоположение гена или последовательности ДНК или положение на хромосоме
- макрофаг – крупный белый кровяной тельце, часть иммунной системы, которая поглощает чужеродные частицы и инфекционные микроорганизмы
- главный комплекс гистосовместимости (ГКГС) – белки, находящиеся на поверхности клеток, которые помогают иммунной системе распознавать чужеродные вещества; также называемые системой человеческих лейкоцитарных антигенов (HLA)
- микроРНК — фрагмент клеточной РНК, который предотвращает выработку определенного белка путем связывания и разрушения матричной РНК, которая могла бы выработать этот белок.
- микрососуды – очень мелкие кровеносные сосуды
- митохондрии – органеллы клетки, вырабатывающие энергию
- мутация – спонтанное изменение гена, возникающее из-за ошибки в репликации ДНК; обычно мутации упоминаются в контексте наследственных мутаций, т. е. изменений в гаметах
- естественный отбор – постепенный процесс, посредством которого биологические признаки становятся более или менее распространенными в популяции в зависимости от влияния наследственных признаков на дифференциальный репродуктивный успех организмов, взаимодействующих с окружающей средой (тесно связан с приспособленностью ).
- нуклеотиды – органические молекулы, являющиеся субъединицами нуклеиновых кислот, таких как ДНК и РНК
- Нуклеиновая кислота — сложная органическая молекула, присутствующая в живых клетках, особенно ДНК или РНК, которая состоит из множества нуклеотидов, связанных в длинную цепь.
- кислородный радикал – высокореакционный ион, содержащий кислород, способный повреждать микроорганизмы и нормальные ткани.
- патогенез – способ развития болезни
- ПЦР – полимеразная цепная реакция, ферментативная реакция, посредством которой ДНК реплицируется в пробирке для последующего тестирования или анализа.
- фенотип – совокупность наблюдаемых характеристик или признаков организма, таких как его морфология
- Plasmodium – общий тип (род) простейших микроорганизмов, вызывающих малярию, хотя лишь немногие из них
- полимеризовать – объединять реплицированные субъединицы в более длинную молекулу (обычно относится к синтетическим материалам, но также и к органическим молекулам)
- полиморфизм – существование чего-либо в нескольких различных формах, например гемоглобина (HbA, HbC и т. д.)
- полипептид – цепь аминокислот, входящая в состав молекулы белка
- рецептор (клеточная поверхность) – специализированные интегральные мембранные белки, которые принимают участие в коммуникации клетки с внешним миром; рецепторы реагируют на специфические лиганды , которые к ним присоединяются.
- восстановительная среда (клеточная) – восстановительная среда – это среда, в которой окисление предотвращается путем удаления кислорода и других окисляющих газов или паров, и которая может содержать активно восстанавливающие газы, такие как водород, оксид углерода, и газы, которые окислялись бы в присутствии кислорода, такие как сероводород .
- РНК – рибонуклеиновая кислота, нуклеиновая кислота, присутствующая во всех живых клетках. Ее основная роль – выступать в качестве посредника, передающего инструкции от ДНК для управления синтезом белков.
- секвестрация (биология) – процесс, посредством которого организм накапливает соединение или ткань (в виде эритроцитов) из окружающей среды
- сцепленный с полом – признак, связанный с геном, который передается только по мужской или женской линии (в отличие от аутосомного)
- Споровики – большой класс строго паразитических неподвижных простейших, включая плазмодии, вызывающие малярию.
- Цикл трикарбоновых кислот (ЦТК) — это серия катализируемых ферментами химических реакций, которые играют ключевую роль в аэробном дыхании клеток.
- транслокация (клеточная биология) – перемещение молекул снаружи внутрь клетки (или наоборот)
- трансмембранный – существующий или происходящий через клеточную мембрану
- венозный – относящийся к венам
- везикула – небольшая органелла внутри клетки, состоящая из жидкости, окруженной жировой мембраной
- Факторы вирулентности – позволяют инфекционному агенту размножаться и распространяться внутри хозяина, частично подрывая или ускользая от его защиты.
Смотрите также
Примечания
- ^ P. vivax может передаваться беличьим обезьянам ( Saimiri boliviensis и S. sciureus ), и Барнвелл и др. [58] получили доказательства того, что P. vivax проникает в эритроциты обезьян Saimiri независимо от группы крови Даффи, показывая, что у P. vivax есть альтернативный путь для вторжения в эти клетки. Связывающий белок Даффи, обнаруженный на плазмодиях , единственный лиганд вторжения для DARC, не связывается с эритроцитами Saimiri , хотя эти клетки экспрессируют DARC и, очевидно, заражаются P. vivax . [59]
- ^ Если частота гетерозиготы составляет 0,40, то частоту гена серповидноклеточной анемии (q) можно рассчитать по уравнению Харди-Вайнберга 2q(1-q) = 0,40, откуда q = 0,255 и q 2 , частота гомозигот серповидноклеточной анемии, составляет 0,065.
Ссылки
- ^ Kwiatkowski DP (август 2005 г.). «Как малярия повлияла на геном человека и чему генетика человека может научить нас о малярии». American Journal of Human Genetics . 77 (2): 171–92. doi :10.1086/432519. PMC 1224522. PMID 16001361 .
- ^ Hedrick PW (октябрь 2011 г.). «Популяционная генетика устойчивости к малярии у людей». Наследственность . 107 (4): 283–304. doi :10.1038/hdy.2011.16. PMC 3182497. PMID 21427751 .
- ^ Anstee DJ (июнь 2010 г.). «Связь между группами крови и болезнями». Blood . 115 (23): 4635–43. doi : 10.1182/blood-2010-01-261859 . PMID 20308598.
- ^ Allison AC (1954). «Protection Afforded by Sickle-cell Trait Against Subtertian Malarial Infection» (PDF) . Br Med J . 1 (4857): 290–294. doi :10.1136/bmj.1.4857.290. PMC 2093356 . PMID 13115700. Архивировано из оригинала (PDF) 28.09.2011.
- ^ ab Miller LH, Mason SJ, Clyde DF, McGinniss MH (1976). "Фактор устойчивости к Plasmodium vivax у чернокожих. Генотип группы крови Даффи, FyFy". N Engl J Med . 295 (6): 302–4. doi :10.1056/NEJM197608052950602. PMID 778616.
- ^ Lemaitre B, Nicolas E, Michaut L, Reichhart JM, Hoffmann JA (1996). «Дорсовентральная регуляторная генная кассета spätzle/Toll/cactus контролирует мощный противогрибковый ответ у взрослых особей Drosophila» (PDF) . Cell . 86 (6): 973–983. doi : 10.1016/S0092-8674(00)80172-5 . PMID 8808632. S2CID 10736743.
- ^ Полторак А, Хе X, Смирнова I, Лю М.Ю., Ван Хаффель С, Ду X, Бердвелл Д, Алехос Э, Сильва М, Галанос С, Фрейденберг М, Риккарди-Кастаньоли П, Лейтон Б, Бейтлер Б (1998). «Дефектная передача сигналов LPS у мышей C3H/HeJ и C57BL/10ScCr: мутации в гене Tlr4». Наука . 282 (5396): 2085–2088. Бибкод : 1998Sci...282.2085P. дои : 10.1126/science.282.5396.2085. ПМИД 9851930.
- ^ Vaidya AB, Mather MW (2009). «Эволюция и функции митохондрий у малярийных паразитов». Annu Rev Microbiol . 63 : 249–267. doi :10.1146/annurev.micro.091208.073424. PMID 19575561.
- ^ Elliott DA, McIntosh MT, Hosgood HD 3rd, Chen S, Zhang G, Baevova P, Joiner KA (2008). «Четыре различных пути поглощения гемоглобина малярийным паразитом Plasmodium falciparum». Proc. Natl. Acad. Sci. USA . 105 (7): 2463–2468. Bibcode : 2008PNAS..105.2463E. doi : 10.1073/pnas.0711067105 . PMC 2268159. PMID 18263733 .
- ^ Kuross SA, Rank BH, Hebbel RP (1988). «Избыток гема в серповидных эритроцитарных мембранах изнутри наружу: возможная роль в окислении тиолов» (PDF) . Кровь . 71 (4): 876–882. doi : 10.1182/blood.V71.4.876.876 . PMID 3355895.
- ^ Föller M, Bobbala D, Koka S, Huber SM, Gulbins E, Lang F (2009). «Самоубийство ради выживания — смерть инфицированных эритроцитов как механизм хозяина для выживания при малярии». Cell Physiol Biochem . 24 (3–4): 133–140. doi : 10.1159/000233238 . PMID 19710527.
- ^ Cholera R, Brittain NJ, Gillrie MR, Lopera-Mesa TM, Diakité SA, Arie T, Krause MA, Guindo A, Tubman A, Fujioka H, Diallo DA, Doumbo OK, Ho M, Wellems TE, Fairhurst RM (2008). «Нарушенная цитоадгезия эритроцитов, инфицированных Plasmodium falciparum и содержащих серповидный гемоглобин». Proc. Natl. Acad. Sci. USA . 105 (3): 991–996. Bibcode :2008PNAS..105..991C. doi : 10.1073/pnas.0711401105 . PMC 2242681 . PMID 18192399.
- ^ Феррейра А., Маргути I, Бекманн I, Джени В., Хора А., Палья Н.Р., Ребелу С., Анри А., Бёзар Ю., Соарес MP (2011). «Серповидный гемоглобин придает толерантность к инфекции Plasmodium». Клетка . 145 (3): 398–409. дои : 10.1016/j.cell.2011.03.049 . PMID 21529713. S2CID 8567718.
- ^ Gong L, Parikh S, Rosenthal PJ, Greenhouse B (2013). «Биохимические и иммунологические механизмы, с помощью которых серповидноклеточная анемия защищает от малярии» (PDF) . Malaria Journal . 12 (1): 317. doi : 10.1186/1475-2875-12-317 . PMC 3847285 . PMID 24025776.
- ^ Allison AC (2009). «Генетический контроль устойчивости к человеческой малярии». Current Opinion in Immunology . 21 (5): 499–505. doi :10.1016/j.coi.2009.04.001. PMID 19442502.
- ^ Piel FB, Patil AP, Howes RE, Nyangiri OA, Gething PW, Williams TN, Weatherall DJ, Hay SI (2010). «Глобальное распространение гена серповидноклеточной анемии и географическое подтверждение гипотезы малярии». Nat Commun . 1 (8): 104. Bibcode : 2010NatCo...1..104P. doi : 10.1038/ncomms1104. PMC 3060623. PMID 21045822.
- ^ ab May J, Evans JA, Timmann C, Ehmen C, Busch W, Thye T, Agbenyega T, Horstmann RD (2007). «Варианты гемоглобина и проявления заболевания при тяжелой малярии falciparum». JAMA . 297 (20): 2220–2226. doi : 10.1001/jama.297.20.2220 . PMID 17519411.
- ^ Flatz G (1967). «Гемоглобин E: распределение и динамика популяции». Humangenetik . 3 (3): 189–234. doi :10.1007/BF00273124. PMID 6074385. S2CID 22541254.
- ^ ab Allison AC (1955). «Аспекты полиморфизма у человека». Cold Spring Harb Symp Quant Biol . 20 : 239–251. doi :10.1101/SQB.1955.020.01.023. PMID 13433567.
- ^ Полинг Л., Итано Х., Сингер С.Дж., Уэллс И. (1949). «Серповидноклеточная анемия, молекулярная болезнь» (PDF) . Science . 110 (2865): 543–548. Bibcode :1949Sci...110..543P. doi :10.1126/science.110.2865.543. PMID 15395398. S2CID 31674765.
- ^ Ingram VM (1959). «Аномальные гемоглобины человека. III. Химическое различие между нормальными и серповидноклеточными гемоглобинами». Biochim Biophys Acta . 36 (2): 543–548. doi :10.1016/0006-3002(59)90183-0. PMID 13852872.
- ^ Ingram VM (2004). «Гемоглобин серповидноклеточной анемии: молекулярная биология первой «молекулярной болезни» — решающее значение счастливой случайности». Генетика . 167 (1): 1–7. doi :10.1534/genetics.167.1.1. PMC 1470873. PMID 15166132 .
- ^ Cholera R, Brittain NJ, Gillrie MR, Lopera-Mesa TM, Diakité SA, Arie T, Krause MA, Guindo A, Tubman A, Fujioka H, Diallo DA, Doumbo OK, Ho M, Wellems TE, Fairhurst RM (2008). «Нарушение цитоадгезии эритроцитов, инфицированных Plasmodium falciparum и содержащих серповидный гемоглобин». Proc Natl Acad Sci USA . 105 (3): 991–996. Bibcode : 2008PNAS..105..991C. doi : 10.1073/pnas.0711401105 . PMC 2242681. PMID 18192399 .
- ^ Williams TN, Mwangi TW, Roberts DJ, Alexander ND, Weatherall DJ, Wambua S и др. (май 2005 г.). «Иммунная основа защиты от малярии с помощью серповидноклеточного признака». PLOS Medicine . 2 (5): e128. doi : 10.1371/journal.pmed.0020128 . PMC 1140945. PMID 15916466 .
- ^ Хеббель РП (2003). «Нестабильность серповидного гемоглобина: механизм защиты от малярии». Redox Report . 8 (5): 238–40. doi :10.1179/135100003225002826. PMID 14962356. S2CID 28951874.
- ^ Кауль ДК (2008). «Адгезия серповидноклеточных эритроцитов: много вопросов и некоторые ответы». Transfusion Clinique et Biologique . 15 (1–2): 51–5. doi :10.1016/j.tracli.2008.03.012. PMID 18495516.
- ^ Brain P (1952). «Серповидноклеточная анемия в Африке». Br Med J . 2 (4789): 880. doi :10.1136/bmj.2.4789.880. PMC 2021738 .
- ^ Elguero E, Délicat-Loembet LM, Rougeron V, Arnathau C, Roche B, Becquart P и др. (2015). «Малярия продолжает выбирать серповидноклеточный признак в Центральной Африке». Proc Natl Acad Sci USA . 112 (22): 7051–4. Bibcode : 2015PNAS..112.7051E. doi : 10.1073/pnas.1505665112 . PMC 4460506. PMID 25941403 .
- ^ Ingram VM, Stretton AO (1959). «Генетическая основа заболеваний талассемии». Nature . 184 (4703): 1903–1909. Bibcode :1959Natur.184.1903I. doi :10.1038/1841903a0. PMID 13852871. S2CID 36535895.
- ^ Модиано Г, Морпурго Г, Терренато Л, Новеллетто А, Ди Риенцо А, Коломбо Б, Пурпура М, Мариани М, Сантакьяра-Бенерекетти С, Брега А, Диксит К.А., Шреста СЛ, Лания А, Ваначиванавин В, Луццатто Л (1991) ). «Защита от заболеваемости малярией: почти фиксация гена α-талассемии у населения Непала». Являюсь. Дж. Хум. Жене . 48 (2): 390–397. ПМК 1683029 . ПМИД 1990845.
- ^ Terrenato L, Shrestha S, Dixit KA, Luzzatto L, Modiano G, Morpurgo G, Arese P (1988). «Снижение заболеваемости малярией у народа тхару по сравнению с симпатрическими популяциями в Непале». Ann Trop Med Parasitol . 82 (1): 1–11. doi :10.1080/00034983.1988.11812202. PMID 3041928.
- ^ Hutagalung R, Wilairatana P, Looareesuwan S, Brittenham GM, Aikawa M, Gordeuk VR (1999). «Влияние признака гемоглобина E на тяжесть малярии Falciparum». J Infect Dis . 179 (1): 283–286. doi : 10.1086/314561 . JSTOR 30117260. PMID 9841856.
- ^ Модиано Д., Луони Дж., Сирима Б.С., Симпоре Дж., Верра Ф., Конате А., Растрелли Е., Оливьери А., Калиссано С., Паганотти Г.М., Д'Урбано Л., Сану I, Савадого А., Модиано Г., Колуцци М. (2001) . «Гемоглобин C защищает от клинической малярии Plasmodium falciparum». Природа . 414 (6861): 305–308. Бибкод : 2001Natur.414..305M. дои : 10.1038/35104556. PMID 11713529. S2CID 4360808.
- ^ Modiano D, Bancone G, Ciminelli BM, Pompei F, Blot I, Simporé J, Modiano G (2008). «Гемоглобин S и гемоглобин C: „быстрые, но дорогостоящие“ против „медленные, но бесплатные“ генетические адаптации к малярии Plasmodium falciparum». Hum Mol Genet . 17 (6): 789–799. doi : 10.1093/hmg/ddm350 . hdl : 2108/26909 . PMID 18048408.
- ^ Rihet P, Flori L, Tall F, Traore AS, Fumoux F (2004). «Гемоглобин C связан с уменьшением паразитемии Plasmodium falciparum и низким риском легкой атаки» (PDF) . Hum Mol Genet . 13 (1): 1–6. doi : 10.1093/hmg/ddh002 . PMID 14613965.
- ^ Фэйрхерст Р.М., Барух Д.И., Бриттен Нью-Джерси, Остера Г.Р., Уоллах Дж.С., Хоанг Х.Л., Хэйтон К., Гиндо А., Макобонго М.О., Шварц О.М., Тункара А., Думбо ОК, Диалло Д.А., Фудзиока Х., Хо М., Веллемс Т.Э. (2005) ). «Аномальное отображение PfEMP-1 на эритроцитах, несущих гемоглобин C, может защитить от малярии». Природа . 435 (7045): 1117–1121. Бибкод : 2005Natur.435.1117F. дои : 10.1038/nature03631 . PMID 15973412. S2CID 4412263.
- ^ Chotivanich K, Udomsangpetch R, Pattanapanyasat K, Chierakul W, Simpson J, Looareesuwan S, White N (август 2002 г.). «Гемоглобин E: сбалансированный полиморфизм, защищающий от высокой паразитемии и, следовательно, тяжелой малярии P. falciparum». Blood . 100 (4): 1172–6. doi : 10.1182/blood.V100.4.1172.h81602001172_1172_1176 . PMID 12149194.
- ^ "Дефицит глюкозо-6-фосфатдегидрогеназы (G6PD)". Библиотека медицинских концепций Lecturio . 3 сентября 2020 г. Получено 23 июля 2021 г.
- ^ Alving AS, Carson PE, Flanagan CL, Ickes CE (1956). «Ферментативная недостаточность в эритроцитах, чувствительных к примахину». Science . 124 (3220): 484–485. Bibcode :1956Sci...124..484C. doi :10.1126/science.124.3220.484-a. PMID 13360274. S2CID 41112750.
- ^ Каппеллини, доктор медицинских наук, Фиорелли Дж. (январь 2008 г.). «Дефицит глюкозо-6-фосфатдегидрогеназы». Ланцет . 371 (9606): 64–74. дои : 10.1016/S0140-6736(08)60073-2. PMID 18177777. S2CID 29165746.
- ^ ab Tishkoff SA, Verelli BJ (2004). «Дефицит G6PD и устойчивость к малярии у людей: выводы из эволюционного генетического анализа». В Dronamraju K (ред.). Эволюционные аспекты инфекционных заболеваний . Cambridge University Press.
- ^ Allison AC, Clyde DF (1961). «Малярия у африканских детей с дефицитом эритроцитарной глюкозо-6-фосфатдегидрогеназы». Br Med J . 1 (5236): 1346–1349. doi :10.1136/bmj.1.5236.1346. PMC 1954496 . PMID 13682585.
- ^ Ruwende C, Khoo SC, Snow RW, Yates SN, Kwiatkowski D, Gupta S, Warn P, Allsopp CE, Gilbert SC, Peschu N, Newbold CI, Greenwood BM, Marsh K, Hill AV (1995). "Естественный отбор геми- и гетерозигот по дефициту G6PD в Африке по устойчивости к тяжелой малярии". Nature . 376 (6537): 246–249. Bibcode :1995Natur.376..246R. doi :10.1038/376246a0. PMID 7617034. S2CID 4301352.
- ^ Луццатто Л. (1979). «Генетика эритроцитов и восприимчивость к малярии» (PDF) . Кровь . 54 (5): 961–976. doi : 10.1182/blood.V54.5.961.961 . PMID 387115.
- ^ Ayi K, Min-Oo G, Serghides L, Crockett M, Kirby-Allen M, Quirt I, Gros P, Kain KC (2008). «Дефицит пируваткиназы и малярия». N Engl J Med . 358 (17): 1805–1810. doi : 10.1056/NEJMoa072464 . PMID 18420493. S2CID 611960.
- ^ Hempelmann E, Götze O (1984). «Характеристика мембранных белков с помощью полихроматического окрашивания серебром». Hoppe-Seyler's Z Physiol Chem . 365 : 241–242.
- ^ Jarolim P, Palek J, Amato D, Hassan K, Sapak P, Nurse GT, Rubin HL, Zhai S, Sahr KE, Liu SC (1991). «Делеция в гене полосы 3 эритроцитов при овалоцитозе, устойчивом к малярии в Юго-Восточной Азии». Proc. Natl. Acad. Sci. USA . 88 (24): 11022–11026. Bibcode : 1991PNAS...8811022J. doi : 10.1073 /pnas.88.24.11022 . PMC 53065. PMID 1722314.
- ^ Лю С.К., Чжай С., Палек Дж., Голан Д.Е., Амато Д., Хасан К., Медсестра Г.Т., Бабона Д., Кутцер Т., Джаролим П., Заик М., Борвейн С. (1990). «Молекулярный дефект белка полосы 3 при овалоцитозе в Юго-Восточной Азии». N Engl J Med . 323 (22): 1530–1538. дои : 10.1056/NEJM199011293232205 . ПМИД 2146504.
- ^ Allen SJ, O'Donnell A, Alexander ND, Mgone CS, Peto TE, Clegg JB, Alpers MP, Weatherall DJ (1999). «Профилактика церебральной малярии у детей в Папуа-Новой Гвинее с помощью юго-восточноазиатского овалоцитоза полосы 3». Am J Trop Med Hyg . 60 (6): 1056–1060. doi : 10.4269/ajtmh.1999.60.1056 . PMID 10403343.
- ^ Cortés A, Mellombo M, Mgone CS, Beck HP, Reeder JC, Cooke BM (2005). «Адгезия эритроцитов, инфицированных Plasmodium falciparum, к CD36 под действием потока усиливается церебральным защитным признаком от малярии — овалоцитозом в Юго-Восточной Азии». Mol Biochem Parasitol . 142 (2): 252–257. doi :10.1016/j.molbiopara.2005.03.016. PMID 15978955.
- ^ ab Каллетон РЛ, Мита Т, Ндунга М, Унгер Х, Краво П.В., Паганотти ГМ, Такахаши Н, Канеко А, Это Х, Тинто Х, Карема С, Д'Алессандро У, до Розарио В, Кобаякава Т, Нтоуми Ф, Картер Р., Танабэ К. (2008). «Неспособность обнаружить Plasmodium vivax в Западной и Центральной Африке методом ПЦР-типирования». Малар Дж . 7 (1): 174–182. дои : 10.1186/1475-2875-7-174 . ПМК 2546428 . ПМИД 18783630.
- ^ Tournamille C, Colin Y, Cartron JP, Le Van Kim C (1995). «Нарушение мотива GATA в промоторе гена Даффи отменяет экспрессию эритроидного гена у лиц с отрицательным геном Даффи». Nat Genet . 10 (2): 224–228. doi :10.1038/ng0695-224. PMID 7663520. S2CID 7125832.
- ^ Райан Дж. Р., Стоут Дж. А., Амон Дж., Дантон Р. Ф., Мталиб Р., Корос Дж., Овур Б., Лакхарт С., Виртц РА., Барнуэлл Дж. В., Розенберг Р. (2006). «Доказательства передачи Plasmodium vivax среди популяции с отрицательным антигеном Даффи в Западной Кении» (PDF) . Am J Trop Med Hyg . 75 (4): 575–581. doi :10.4269/ajtmh.2006.75.575. PMID 17038676. S2CID 39140682.[ постоянная мертвая ссылка ]
- ^ Cavasini CE, de Mattos LC, Couto AA, Couto VS, Gollino Y, Moretti LJ, Bonini-Domingos CR, Rossit AR, Castilho L, Machado RL (2007). "Полиморфизмы генов группы крови Даффи среди пациентов с малярией vivax в четырех районах бразильского региона Амазонки". Malar J . 6 (1): 167. doi : 10.1186/1475-2875-6-167 . PMC 2244634 . PMID 18093292.
- ^ Менар Д., Барнадас С., Бушье С., Генри-Халдин С., Грей Л.Р., Рацимбасоа А., Тонье В., Карод Дж.Ф., Домарль О., Колин Ю., Бертран О., Пико Дж., Кинг CL, Гримберг Б.Т., Мерсеро-Пуихалон О, Циммерман П.А. (2010). «Клиническая малярия Plasmodium vivax обычно наблюдается у малагасийцев, отрицательных по Даффи». Учеб. Натл. акад. наук. США . 107 (13): 5967–71. Бибкод : 2010PNAS..107.5967M. дои : 10.1073/pnas.0912496107 . ПМК 2851935 . ПМИД 20231434.
- ^ Pierron D, Heiske M, Razafindrazaka H, Pereda-Loth V, Sanchez J, Alva O и др. (март 2018 г.). «Сильный отбор в течение последнего тысячелетия для африканского происхождения в смешанной популяции Мадагаскара». Nature Communications . 9 (1): 932. Bibcode :2018NatCo...9..932P. doi :10.1038/s41467-018-03342-5. PMC 5834599 . PMID 29500350.
- ^ Мендес С, Диас Ф, Фигейреду Х, Мора ВГ, Кано Дж, де Соуза Б, до Росарио ВЕ, Бенито А, Берсоса П, Арес АП (2011). Франко-Паредес С. (ред.). «Даффи-негативный антиген больше не является барьером для Plasmodium vivax - молекулярные данные с западного побережья Африки (Ангола и Экваториальная Гвинея)». PLOS Негль Троп Дис . 5 (е1192): е1192. дои : 10.1371/journal.pntd.0001192 . ПМК 3119644 . ПМИД 21713024.
- ^ Barnwell JW, Nichols ME, Rubinstein P (1989). «Оценка in vitro роли группы крови Даффи в инвазии эритроцитов Plasmodium vivax». J Exp Med . 169 (5): 1795–802. doi :10.1084/jem.169.5.1795. PMC 2189319. PMID 2469769 .
- ^ Вертхаймер СП, Барнвелл ДЖВ (1989). " Взаимодействие Plasmodium vivax с человеческим гликопротеином группы крови Даффи: идентификация белка, похожего на рецептор паразита". Exp Parasitol . 69 (4): 340–350. doi :10.1016/0014-4894(89)90083-0. PMID 2680568.
- ^ ab Hill AV, Allsopp CE, Kwiatkowski D, Anstey NM, Twumasi P, Rowe PA, Bennett S, Brewster D, McMichael AJ, Greenwood BM (1991). «Обычные западноафриканские антигены HLA связаны с защитой от тяжелой малярии». Nature . 352 (6336): 595–600. Bibcode :1991Natur.352..595H. doi : 10.1038/352595a0 . PMID 1865923. S2CID 2667496.
- ^ Frodsham AJ, Hill AV (2004). «Генетика инфекционных заболеваний». Hum Mol Genet . 13 Spec No 2: R187–R194. doi : 10.1093/hmg/ddh225 . PMID 15358724.
- ^ Billig EM, McQueen PG, McKenzie FE (2012). "Фетальный гемоглобин и динамика детской малярии". Malaria Journal . 11 : 396. doi : 10.1186/1475-2875-11-396 . PMC 3538578. PMID 23190739 .
- ^ Бренда Акини И Вебала, «Распространенность фетального гемоглобина и реакции антител на антигены Plasmodium falciparum у пациентов с серповидноклеточной анемией в Западной Кении». Магистерская диссертация, Школа чистых и прикладных наук Университета Кениата, 2013 г.
- ^ Bengtsson BO, Tunlid A (июль 2010 г.). «Международный конгресс генетики 1948 г. в Швеции: люди и политика». Genetics . 185 (3): 709–15. doi :10.1534/genetics.110.119305. PMC 2907196 . PMID 20660651.
- ^ Холдейн, Дж. Б. С. (1949). «Скорость мутации генов человека». Hereditas . 35 (S1): 267–273. doi : 10.1111/j.1601-5223.1949.tb03339.x .
- ^ Lederberg J (сентябрь 1999 г.). «JBS Haldane (1949) об инфекционных заболеваниях и эволюции». Genetics . 153 (1): 1–3. doi :10.1093/genetics/153.1.1. PMC 1460735 . PMID 10471694.
- ^ abc Aidoo M, Terlouw DJ, Kolczak MS, McElroy PD, ter Kuile FO, Kariuki S, Nahlen BL, Lal AA, Udhayakumar V (2002). «Защитные эффекты гена серповидноклеточной анемии против заболеваемости и смертности от малярии» (PDF) . Lancet . 359 (9314): 1311–1312. doi :10.1016/S0140-6736(02)08273-9. PMID 11965279. S2CID 37952036. Архивировано из оригинала (PDF) 2010-06-09.
- ^ Jallow M, Teo YY, Small KS, Rockett KA и др. (2009). «Анализ ассоциаций генома и высокого разрешения малярии в Западной Африке». Nat Genet . 41 (6): 657–665. doi :10.1038/ng.388. PMC 2889040 . PMID 19465909.
- ^ Allison AC (1954). «Заметки о серповидноклеточном полиморфизме». Annals of Human Genetics . 19 (1): 39–57. doi :10.1111/j.1469-1809.1954.tb01261.x. PMID 13208024. S2CID 10056569.[ мертвая ссылка ]
- ^ Vandepitte JM, Zuelzer WW, Neel JV, Colaert J (1955). «Доказательства неадекватности мутации как объяснения частоты гена серповидноклеточной анемии в Бельгийском Конго». Blood . 10 (4): 341–350. doi : 10.1182/blood.V10.4.341.341 . PMID 14363315.
Дальнейшее чтение
- Дронамраджу КР, Аресе П (2006) Малярия: генетические и эволюционные аспекты , Springer; Берлин, ISBN 0-387-28294-7 / ISBN 978-0-387-28294-7
- Фэй ФБК (2009) Устойчивость к малярии или восприимчивость к ней при заболеваниях эритроцитов , Nova Science Publishers Inc, Нью-Йорк. ISBN 9781606929438
Внешние ссылки
- Фавизм
- Гемоглобинопатии
- Малярия и эритроциты
