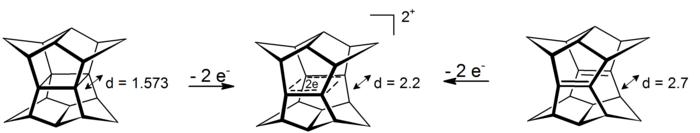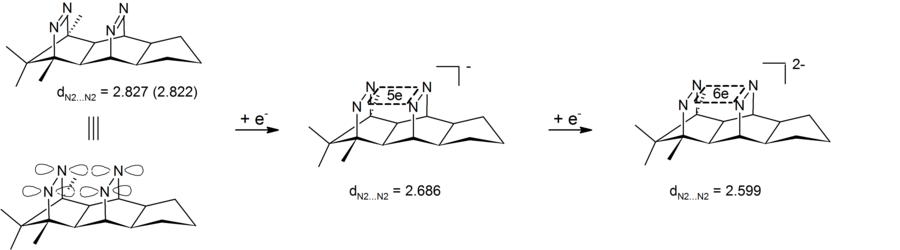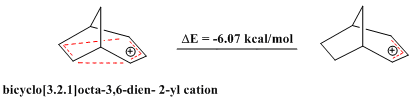Гомоароматичность
Гомоароматичность в органической химии относится к особому случаю ароматичности , в котором сопряжение прерывается одним sp 3 гибридизированным атомом углерода. Хотя этот sp 3 центр нарушает непрерывное перекрытие p-орбиталей , традиционно считающееся необходимым условием ароматичности, для таких соединений по-прежнему наблюдаются значительная термодинамическая стабильность и многие спектроскопические, магнитные и химические свойства, связанные с ароматическими соединениями. Этот формальный разрыв, по-видимому, перекрывается перекрытием p-орбиталей, поддерживая непрерывный цикл π-электронов, который отвечает за эту сохраненную химическую стабильность . [1]

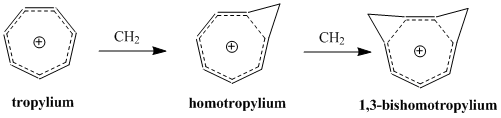
Концепция гомоароматичности была впервые предложена Солом Винстейном в 1959 году под влиянием его исследований катиона «трис-гомоциклопропенил». [2] После публикации статьи Винстейна многие исследования были посвящены пониманию и классификации этих молекул, которые представляют собой дополнительный класс ароматических молекул, включенных в постоянно расширяющееся определение ароматичности.
На сегодняшний день известно, что гомоароматические соединения существуют в виде катионных и анионных видов, а некоторые исследования подтверждают существование нейтральных гомоароматических молекул, хотя они встречаются реже. [3] Катион «гомотропилия» (C 8 H 9 + ), возможно, является наиболее изученным примером гомоароматического соединения.
Обзор
Нейминг
Термин «гомоароматичности» происходит от структурного сходства между гомоароматическими соединениями и аналогичными гомосопряженными алкенами, ранее наблюдавшимися в литературе. [2] Золотая книга ИЮПАК требует, чтобы префиксы бис-, трис- и т. д. использовались для описания гомоароматических соединений, в которых два, три и т. д. sp 3 -центра по отдельности прерывают сопряжение ароматической системы.
История
Концепция гомоароматичности берет свое начало в дебатах по поводу неклассических карбоний-ионов , которые произошли в 1950-х годах. Сол Винстейн , известный сторонник неклассической ионной модели, впервые описал гомоароматичность, изучая катион 3-бицикло[3.1.0]гексила.
В серии экспериментов по ацетолизу Винстейн и др. наблюдали, что реакция сольволиза эмпирически протекала быстрее, когда тозильная уходящая группа находилась в экваториальном положении. Группа приписала эту разницу в скоростях реакции анхимерной помощи , вызванной «цис»-изомером. Таким образом, этот результат подтвердил неклассическую структуру катиона. [4]
Винстейн впоследствии заметил, что эта неклассическая модель 3-бицикло[3.1.0]гексильного катиона аналогична ранее хорошо изученному ароматическому циклопропенильному катиону. Подобно циклопропенильному катиону, положительный заряд делокализован по трем эквивалентным атомам углерода, содержащим два π-электрона. Таким образом, эта электронная конфигурация удовлетворяет правилу Хюккеля (требующему 4n+2 π-электронов) для ароматичности. Действительно, Винстейн заметил, что единственное фундаментальное различие между этим ароматическим пропенильным катионом и его неклассическим гексильным катионом заключается в том, что в последнем ионе сопряжение прерывается тремя - CH
2- единицы . Таким образом, группа предложила название «трис-гомоциклопропенил» — трис-гомо аналог циклопропенильного катиона.
Доказательства гомоароматичности
Критерий гомоароматичности
Критерий ароматичности развивался по мере того, как новые разработки и идеи продолжают вносить вклад в наше понимание этих удивительно стабильных органических молекул . [5] Требуемые характеристики этих молекул, таким образом, оставались предметом некоторых споров. Классически ароматические соединения определялись как плоские молекулы, которые обладают циклически делокализованной системой (4n+2)π электронов, удовлетворяющей правилу Хюккеля . Самое важное, что эти сопряженные кольцевые системы, как известно, демонстрируют огромную термохимическую стабильность относительно предсказаний, основанных на локализованных резонансных структурах. Три важные особенности, по-видимому, характеризуют ароматические соединения: [6]
- молекулярная структура (т.е. копланарность : все участвующие атомы находятся в одной плоскости)
- молекулярная энергетика (т.е. повышенная термодинамическая стабильность )
- спектроскопические и магнитные свойства (т.е. кольцевой ток, индуцированный магнитным полем)
Однако существует ряд исключений из этих общепринятых правил. Многие молекулы, включая виды электронов Мёбиуса 4nπ, перициклические переходные состояния , молекулы, в которых делокализованные электроны циркулируют в кольцевой плоскости или через σ (а не π ) связи, многие сэндвичевые молекулы переходных металлов и другие, считаются ароматическими, хотя они каким-то образом отклоняются от общепринятых параметров ароматичности. [7]
Следовательно, критерий гомоароматической делокализации остается таким же неоднозначным и несколько спорным. Катион гомотропилия (C 8 H 9 + ), хотя и не первый пример гомоароматического соединения, когда-либо обнаруженного, оказался наиболее изученным из соединений, классифицированных как гомоароматические, и поэтому часто считается классическим примером гомоароматичности. К середине 1980-х годов было сообщено о более чем 40 замещенных производных катиона гомотропилия, что отражает важность этого иона в формулировании нашего понимания гомоароматических соединений. [6]
Ранние доказательства гомоароматичности
После того, как Винстейн опубликовал первые сообщения о «гомоароматической» структуре для трис-гомоциклопропенильного катиона, многие группы начали сообщать о наблюдениях подобных соединений. Одной из наиболее изученных из этих молекул является катион гомотропилия, исходное соединение которого было впервые выделено в виде стабильной соли Петтитом и др. в 1962 году, когда группа провела реакцию циклооктатраена с сильными кислотами. [8] Большая часть ранних доказательств гомоароматичности исходит из наблюдений необычных свойств ЯМР, связанных с этой молекулой.
Исследования методом ЯМР-спектроскопии
Характеризуя соединение, полученное в результате депротонирования циклооктатриена , с помощью спектроскопии ЯМР 1 H , группа обнаружила, что резонанс, соответствующий двум протонам, связанным с одним и тем же углеродом метиленового мостика, демонстрирует поразительную степень разделения в химическом сдвиге .
Из этого наблюдения Петтит и др. пришли к выводу, что классическая структура циклооктатриенильного катиона должна быть неверной. Вместо этого группа предложила структуру бицикло[5.1.0]октадиенильного соединения, предположив, что циклопропановая связь, расположенная внутри восьмичленного кольца, должна подвергаться значительной делокализации , тем самым объясняя резкое различие в наблюдаемом химическом сдвиге. При дальнейшем рассмотрении Петтит склонился к тому, чтобы представить соединение как «гомотропилиевый ион», который показывает, что «внутренняя циклопропановая» связь полностью заменена электронной делокализацией. Эта структура показывает, как делокализация является циклической и включает 6 π-электронов, что согласуется с правилом Хюккеля для ароматичности. Магнитное поле ЯМР, таким образом, может индуцировать кольцевой ток в ионе, ответственный за значительные различия в резонансе между экзо- и эндо-протонами этого метиленового мостика. Петтит и др. Таким образом, подчеркивается поразительное сходство между этим соединением и ароматическим ионом тропилия, что описывает новый «гомо-аналог» уже известного ароматического вида, как и предсказывал Винстейн.
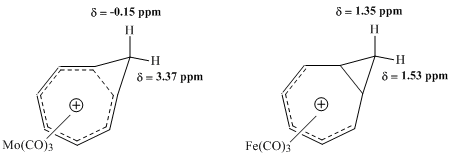
Последующие исследования ЯМР, предпринятые Винстейном и другими, стремились оценить свойства комплексов карбонила металлов с ионом гомотропилия. Сравнение между комплексом молибдена и комплексом железа оказалось особенно плодотворным. Ожидалось, что трикарбонил молибдена будет координироваться с катионом гомотропилия, принимая 6 π-электронов, тем самым сохраняя гомоароматические особенности комплекса. Напротив, ожидалось, что трикарбонил железа будет координироваться с катионом, принимая только 4 π-электрона от иона гомотропилия, создавая комплекс, в котором электроны катиона локализованы. Исследования этих комплексов с помощью спектроскопии ЯМР 1 H показали большую разницу в значениях химического сдвига для метиленовых протонов комплекса Mo, что согласуется с гомоароматической структурой, но практически не обнаружили сопоставимой разницы в резонансе для тех же протонов в комплексе Fe. [9]
Исследования методом УФ-спектроскопии
Важным ранним доказательством в поддержку структуры катиона гомотропилия, которая не опиралась на магнитные свойства молекулы, было получение ее УФ-спектра . Винстейн и др. определили, что максимумы поглощения для катиона гомотропилия демонстрируют значительно более короткую длину волны , чем можно было бы предсказать для классического циклооктатриенильного катиона или бицикло[5.1.0]октадиенильного соединения с полностью сформированной внутренней циклопропановой связью (и локализованной электронной структурой). Вместо этого УФ-спектр больше всего напоминал спектр ароматического иона тропилия . Дальнейшие расчеты позволили Винстейну определить, что порядок связи между двумя атомами углерода, соседствующими с внешним метиленовым мостиком, сопоставим с порядком π-связи, разделяющей соответствующие атомы углерода в катионе тропилия. [10] Хотя этот эксперимент оказался весьма информативным, УФ-спектры обычно считаются плохими индикаторами ароматичности или гомоароматичности. [6]
Более поздние доказательства гомоароматичности
Совсем недавно была проделана работа по исследованию структуры предположительно гомоароматического иона гомотропилия с использованием различных других экспериментальных методов и теоретических расчетов. Одно ключевое экспериментальное исследование включало анализ замещенного иона гомотропилия с помощью рентгеновской кристаллографии . Эти кристаллографические исследования были использованы для демонстрации того, что межъядерное расстояние между атомами в основании структуры циклопропенила действительно больше, чем можно было бы ожидать для нормальной молекулы циклопропана , в то время как внешние связи кажутся короче, что указывает на участие внутренней связи циклопропана в делокализации заряда. [6]
Описание молекулярной орбитали
Молекулярно-орбитальное объяснение стабильности гомоароматичности широко обсуждалось с многочисленными разнообразными теориями, в основном сосредоточенными на катионе гомотропенилия в качестве эталона. RC Haddon изначально предложил модель Мёбиуса , в которой внешние электроны sp 3 гибридизированного метиленового мостика углерода (2) отдают обратный донор соседним атомам углерода для стабилизации расстояния C1-C3. [11]
Теория возмущенных молекулярных орбиталей
Гомоароматичность можно лучше объяснить с помощью теории молекулярных орбиталей возмущений (PMO), как описано в исследовании Роберта С. Хэддона 1975 года. Катион гомотропенилия можно рассматривать как возмущенную версию катиона тропенилия из-за добавления гомосопряженной связи, мешающей резонансу исходного катиона. [12]
Эффекты первого порядка
Самым важным фактором, влияющим на гомоароматический характер, является добавление одной гомосопряженной связи в исходное ароматическое соединение. Расположение гомосопряженной связи не имеет значения, поскольку все гомоароматические виды могут быть получены из ароматических соединений, обладающих симметрией и одинаковым порядком связи между всеми атомами углерода. Вставка гомосопряженной связи возмущает π-электронную плотность на величину δβ, которая в зависимости от размера кольца должна быть больше 0 и меньше 1, где 0 представляет отсутствие возмущения, а 1 представляет полную потерю ароматичности (дестабилизация, эквивалентная форме открытой цепи). [12] Считается, что с увеличением размера кольца резонансная стабилизация гомоароматичности компенсируется напряжением при формировании гомосопряженного мостика. Фактически, максимальный размер кольца для гомоароматичности довольно низок, поскольку 16-членное аннулированное кольцо благоприятствует образованию ароматического дикатиона по сравнению с напряженным мостиковым гомокатионом. [13]
Эффекты второго порядка
Вторая гомоконъюгатная связь
Значительным эффектом второго порядка на модель гомоароматичности Perturbation Molecular Orbital является добавление второй гомосопряженной связи и ее влияние на стабильность. Эффект часто заключается в удвоении нестабильности, вызванной добавлением одной гомосопряженной связи, хотя есть дополнительный член, который зависит от близости двух связей. Чтобы минимизировать δβ и, таким образом, свести к минимуму член связи, бисгомоароматические соединения образуются в зависимости от конформации наибольшей стабильности за счет резонанса и наименьшего стерического препятствия. Синтез катиона 1,3-бисгомотропенилия путем протонирования цис-бицикло[6.1.0]нона-2,4,6-триена согласуется с теоретическими расчетами и максимизирует стабильность за счет образования двух метиленовых мостиков на 1-м и 3-м атомах углерода. [12]
Заместители
Добавление заместителя к гомоароматическому соединению оказывает большое влияние на стабильность соединения. В зависимости от относительного расположения заместителя и гомосопряженной связи заместитель может иметь либо стабилизирующий, либо дестабилизирующий эффект. Это взаимодействие лучше всего продемонстрировать, рассмотрев замещенный катион тропенилия. Если индуктивно электронодонорная группа присоединена к катиону в 1-м или 3-м положении углерода, она оказывает стабилизирующий эффект, улучшая гомоароматический характер соединения. Однако, если этот же заместитель присоединен ко 2-му или 4-му углероду, взаимодействие между заместителем в гомосопряженном мостике оказывает дестабилизирующий эффект. Поэтому протонирование метил- или фенилзамещенных циклооктатетраенов приведет к 1-изомеру катиона гомотропенилия. [12]
Примеры гомоароматических соединений
После открытия первых гомоароматических соединений исследования были направлены на синтез новых гомоароматических соединений, которые обладают схожей стабильностью с их ароматическими исходными соединениями. Существует несколько классов гомоароматических соединений, каждый из которых был предсказан теоретически и доказан экспериментально.
Катионные гомоароматические соединения
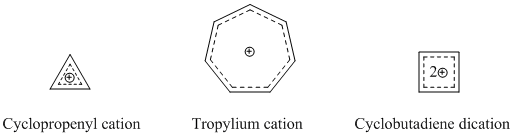
Наиболее устоявшиеся и известные гомоароматические виды — это катионные гомоароматические соединения. Как было сказано ранее, катион гомотропилия является одним из наиболее изученных гомоароматических соединений. Многие гомоароматические катионные соединения используют в качестве основы циклопропениловый катион, катион тропилия или дикатион циклобутадиена, поскольку эти соединения проявляют сильный ароматический характер. [14]
Помимо катиона гомотропилия, другим хорошо известным катионным гомоароматическим соединением является катион норборнен-7-ила, который, как было показано, является сильно гомоароматическим, что доказано как теоретически, так и экспериментально. [15]
Интригующий случай σ-бисгомоароматичности можно обнаружить в дикатионах пагоданов . В этих 4-центровых-2-электронных системах делокализация происходит в плоскости, которая определяется четырьмя атомами углерода (прототипом явления σ-ароматичности является циклопропан , который приобретает около 11,3 ккал моль −1 стабильности из-за эффекта [16] ). Дикатионы доступны либо через окисление пагодана, либо через окисление соответствующего бис-секо-додекаэдрадиена: [17]

Окисление пагодана и додекаэдрадиена до сигма-бисгомоароматического дикатиона. Расстояния в ангстремах рассчитаны на уровне HF/3-21G для дикатиона и диена, рентгенограмма для нейтрального
Восстановление соответствующих шестиэлектронных дианионов до сих пор не представлялось возможным.
Нейтральные гомоароматические соединения
Существует много классов нейтральных гомоароматических соединений, хотя ведутся жаркие споры о том, действительно ли они проявляют гомоароматический характер или нет.
Один класс нейтральных гомоароматических соединений называется моногомоароматическими соединениями, одним из которых является циклогептатриен, и были синтезированы многочисленные сложные моногомоароматические соединения. Одним из конкретных примеров является производное фуллероида с 60 атомами углерода , имеющее один метиленовый мостик. Анализы УФ и ЯМР показали, что ароматический характер этого модифицированного фуллероида не нарушается добавлением гомосопряженной связи, поэтому это соединение определенно является гомоароматическим. [18]
Замещенные нейтральные производные барбаралана (гомоаннулены) были раскрыты как стабильные гомоароматические молекулы в основном состоянии в 2023 году. Доказательства гомоароматического характера в этом классе молекул вытекают из анализа длины связей ( рентгеноструктурный анализ ), а также сдвигов в спектре ЯМР . [19] [20] Гомоаннулены также действуют как фотопереключатели, с помощью которых локальная 6π гомоароматичность может быть переключена на глобальную 10π гомоароматичность.

Бишомоароматика
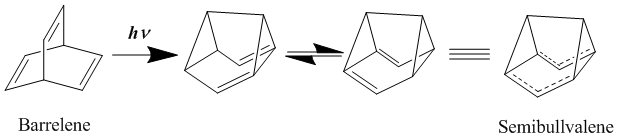
Долгое время считалось, что лучшими примерами нейтральных гомоароматических соединений являются бис-гомоароматические соединения, такие как баррелен и семибулвален. Впервые синтезированный в 1966 году [21] , семибулвален имеет структуру, которая должна хорошо подходить для гомоароматичности, хотя было много споров о том, могут ли производные семибулвалена обеспечить истинное делокализованное, нейтральное гомоароматическое соединение в основном состоянии или нет. В попытке дальнейшей стабилизации делокализованной переходной структуры путем замены семибулвалена на группы, отдающие и принимающие электроны , было обнаружено, что активационный барьер для этой перегруппировки может быть снижен, но не устранен. [22] [23] Однако с введением кольцевого напряжения в молекулу, направленного на дестабилизацию локализованных структур основного состояния посредством стратегического добавления циклических аннулирований, действительно может быть достигнута делокализованная гомоароматическая структура основного состояния. [24]
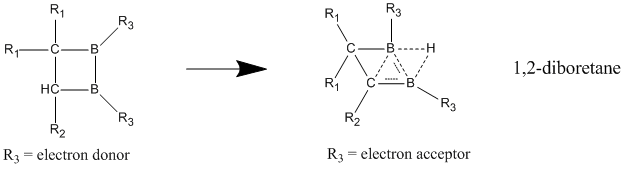
Из нейтральных гомоароматических соединений, соединения, которые, как полагают, лучше всего проявляют нейтральную гомоароматичность, — это борсодержащие соединения 1,2-диборетана и его производных. Показано, что замещенные диборетаны имеют гораздо большую стабилизацию в делокализованном состоянии по сравнению с локализованным, что дает сильные признаки гомоароматичности. [25] Когда электронодонорные группы присоединены к двум атомам бора, соединение предпочитает классическую модель с локализованными связями. Гомоароматический характер лучше всего проявляется, когда электроноакцепторные группы связаны с атомами бора, заставляя соединение принимать неклассическую, делокализованную структуру.
Тришомоароматика
Как следует из названия, тришомоароматические соединения определяются как содержащие один дополнительный метиленовый мостик по сравнению с бишомоароматическими соединениями, следовательно, содержащие три гомосопряженных мостика в общей сложности. Как и в случае с семибулваленом, все еще ведутся споры о степени гомоароматичности тришомоароматических соединений. Хотя теоретически они являются гомоароматическими, эти соединения демонстрируют стабилизацию не более 5% бензола из-за делокализации. [26]
Анионные гомоароматические соединения
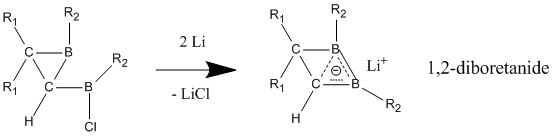
В отличие от нейтральных гомоароматических соединений, анионные гомоароматические соединения широко признаны демонстрирующими «истинную» гомоароматичность. Эти анионные соединения часто получают из их нейтральных исходных соединений путем восстановления металлического лития. Производные 1,2-диборетанида проявляют сильный гомоароматический характер через их трехатомную (бор, бор, углерод), двухэлектронную связь, которая содержит более короткие связи CB, чем в нейтральном классическом аналоге. [27] Эти 1,2-диборетаниды могут быть расширены до более крупных размеров кольца с различными заместителями, и все они содержат некоторую степень гомоароматичности.
Анионная гомоароматичность может также наблюдаться в дианионных бис-диазеновых соединениях, которые содержат четырехатомный (четыре азота) шестиэлектронный центр. Экспериментальные результаты показали сокращение трансаннулярного расстояния азот-азот, тем самым демонстрируя, что дианионный бис-диазен является типом анионного бис-гомоароматического соединения. Особенностью этих систем является то, что циклическая электронная делокализация происходит в σ-плоскости, определяемой четырьмя азотами. Таким образом, эти бис-диазен-дианионы являются первыми примерами 4-центровой-6-электронной σ-бигомоароматичности . [28] [29] Соответствующие 2-электронные σ-бигомоароматические системы были реализованы в форме пагодановых дикатионов (см. выше).

Восстановление бисдиазена до сигма-бисгомоароматического дианиона. Расстояния в ангстремах, рассчитанные на уровне B3LYP?6-31G* (рентгеновское для нейтрального)
Антигомоароматичность
Также имеются сообщения об антигомоароматических соединениях. Так же, как ароматические соединения демонстрируют исключительную стабильность, антиароматические соединения, которые отклоняются от правила Хюккеля и содержат замкнутую петлю из 4n π-электронов, относительно нестабильны. Мостиковый катион бицикло[3.2.1]окта-3,6-диен-2-ил содержит только 4 π-электрона и, следовательно, является «бисгомоантиароматическим». Серия теоретических расчетов подтверждает, что он действительно менее стабилен, чем соответствующий аллильный катион. [30]
Аналогично, замещенный бицикло[3.2.1]окта-3,6-диен-2-ил катион (2-(4'-фторфенил)бицикло[3.2.1]окт-3,6-диен-2-ил катион) также показал себя антиароматом по сравнению с соответствующим ему аллильным катионом, что подтверждено теоретическими расчетами, а также анализом ЯМР. [30]
Внешние ссылки
- Гомоароматичности в Золотой Книге
Ссылки
- ^ IUPAC , Compendium of Chemical Terminology , 2nd ed. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) «Homoaromatic». doi :10.1351/goldbook.H02839
- ^ ab Winstein, S (1959). «Гомоароматические структуры». J. Am. Chem. Soc. 81 (24): 6523. doi :10.1021/ja01533a052.
- ^ Freeman, PK (2005). «Нейтральная гомоароматичность в некоторых нейтральных гетероциклах». J. Org. Chem . 70 (6): 1998–2001. doi :10.1021/jo040250o. PMID 15760178.
- ^ Winstein, S.; Sonnenberg, J.; DeVries, L. (1959). «Трис-гомоциклопропениловый катион». J. Am. Chem. Soc . 81 (24): 6523–6524. doi :10.1021/ja01533a051.
- ^ le Noble, WJ "Aromaticity" в Highlights of Organic Chemistry: продвинутый учебник; Marcel Dekker, Inc.: Нью-Йорк, 1974. ISBN 0-8247-6210-X
- ^ abcd Чайлдс, РФ (1984). «Ион гомотропилия и гомоароматичность». Acc. Chem. Res . 17 (10): 347–352. doi :10.1021/ar00106a001.
- ^ Schleyer, PR (2001). «Введение: Ароматичность». Chem. Rev. 101 ( 5): 1115–1118. doi : 10.1021/cr0103221 . PMID 11749368.
- ^ Розенбург, Дж. Л.; Малер, Дж. Э.; Петтит, Р. Дж. (1962). «Бицикло[5.1.0]октадиенильный катион, новый стабильный ион карбония». J. Am. Chem. Soc . 84 (14): 2842–2843. doi :10.1021/ja00873a051.
- ^ Winstein, S.; Kaesz, HD; Kreiter, CG; Friedrich, EC (1965). «Ион гомотропилия и его комплекс трикарбонила молибдена». J. Am. Chem. Soc. 87 (14): 3267–3269. doi :10.1021/ja01092a060.
- ^ Winstein, S.; Kreiter, CG; Brauman, JI (1966). «Инверсия кольца, ультрафиолетовый спектр и электронная структура иона моногомотропилия». J. Am. Chem. Soc. 88 (9): 2047–2048. doi :10.1021/ja00961a037.
- ^ Хэддон, RC (1975). «Структура катиона гомотропенилия». Tetrahedron Lett . 16 (11): 863–866. doi :10.1016/S0040-4039(00)72004-1.
- ^ abcd Хэддон, RC (1975). «Теория гомоароматичности на основе возмущений молекулярных орбиталей (PMO)». J. Am. Chem. Soc . 97 (13): 3608–3615. doi :10.1021/ja00846a009.
- ^ Oth, JFM; Smith, DM; Prange, U.; Schröder, G. (1973). "A [16]Annulenediyl Dication". Angew. Chem. Int. Ed. Engl . 12 (4): 327–328. doi :10.1002/anie.197303271.
- ^ Сальников, Г.Е.; Генаев, А.М.; Маматюк, В.И.; Шубин, В.Г. (2008). «Гомофеналенильные катионы — новые представители гомоароматических систем». Журн. органич. химии . 44 (7): 1000–1005. doi :10.1134/S1070428008070099. S2CID 93688550.
- ^ Кэри, ФА; Сандберг, Р. Дж. Продвинутая органическая химия: Часть А: Структура и механизм; Kluwer Academic/Plenum Publishers: Нью-Йорк, 2000 ; 327-334. ISBN 978-0-387-68346-1
- ^ Экснер, Кай; Шлейер, Пауль фон Раге (2001). «Теоретические энергии связей: критическая оценка». J. Phys. Chem. A. 105 ( 13): 3407–3416. Bibcode : 2001JPCA..105.3407E. doi : 10.1021/jp004193o.
- ^ Prinzbach, H.; Gescheidt, G.; Martin, H.-D.; Herges, R.; Heinze, J.; Prakash, GK Surya; Olah, GA "Циклическая электронная делокализация в углеводородных клетках (пагоданы, изопагоданы, (биссеко-/секо-)-(додекаэдрадиены))". Pure and Applied Chemistry . 67 (5): 673–682, 1995. doi : 10.1351/pac199567050673 . S2CID 96232491.
- ^ Suzuki, T.; Li, Q.; Khemani, KC; Wudl, F. (1992). «Дигидрофуллероид H3C61: синтез и свойства родительского фуллероида». J. Am. Chem. Soc . 114 (18): 7301–7302. doi :10.1021/ja00044a055.
- ^ Tran Ngoc, Trung; Grabicki, Niklas; Irran, Elisabeth; Dumele, Oliver; Teichert, Johannes F. (март 2023 г.). «Фотопереключение нейтральных гомоароматических углеводородов». Nature Chemistry . 15 (3): 377–385. doi :10.1038/s41557-022-01121-w. ISSN 1755-4349. PMC 9986110 . PMID 36702883.
- ^ Тран Нгок, Трунг; ван дер Велле, Джаспер; Рюффер, Тобиас; Тейхерт, Йоханнес Ф. (3 июля 2023 г.). «Синтез стабильных нейтральных гомоароматических углеводородов». Синтез . дои : 10.1055/s-0042-1751468. ISSN 0039-7881.
- ^ Циммерман, Х. Э.; Грюневальд, Г. Л. (1966). «Химия баррелена. III. Уникальная фотоизомеризация в полубулвален». Журнал Американского химического общества . 88 : 183–184. doi :10.1021/ja00953a045.
- ^ Dewar, MJS; Lo, DH (1971). «Основные состояния молекул с .сигма.-связями. XIV. Применение энергетического разделения к методу MINDO/2 и изучение перегруппировки Копа». J. Am. Chem. Soc . 93 (26): 7201–7207. doi :10.1021/ja00755a014.
- ^ Хоффман, Д.; Сторер, В. Д. (1971). «Перегруппировка Копе снова». J. Am. Chem. Soc . 93 (25): 6941–6948. doi :10.1021/ja00754a042.
- ^ Гриффитс, PR; Пивонка, DE; Уильямс, RV (2011). «Экспериментальная реализация нейтрального гомоароматического карбоцикла». Химия: Европейский журнал . 17 (33): 9193–9199. doi :10.1002/chem.201100025. PMID 21735493.
- ^ Штайнер, Д.; Бальцерайт, К.; Винклер, HJR; Стаматис, Н.; Масса, В.; Берндт, А.; Хофманн, М.; Фон Раге Шлейер, П. (1994). «Неклассические 1,2-диборетаны и 1,2-дибороланы». Angewandte Chemie International Edition на английском языке . 33 (22): 2303–2306. дои : 10.1002/anie.199423031.
- ^ Мартин, HD; Майер, B. (1983). «Эффекты близости в органической химии? Фотоэлектронное спектроскопическое исследование несвязывающих и трансаннулярных взаимодействий». Angew. Chem. Int. Ed. Engl . 22 (4): 283–314. doi :10.1002/anie.198302831.
- ^ Steiner, D.; Winkler, H.; Balzereit, C.; Happel, T.; Hofmann, M.; Subramanian, G.; Schleyer, PVR; Massa, W.; Berndt, A. (1996). "1,2-Diboretanides: Homoaromatic 2π-Electron Compounds with High Inversion Barriers". Angew. Chem. Int. Ed. Engl . 35 (17): 1990–1992. doi :10.1002/anie.199619901.
- ^ Экснер, К.; Ханклер, Д.; Гешайдт, Г.; Принцбах, Х. (1998). «Существуют ли неклассические, циклически делокализованные анионы-радикалы 4N/5e и дианионы 4N/6e? – Одно- и двухэлектронное восстановление близких, синперипланарных бис-диазенов». Angew. Chem. Int. Ed. Engl . 37 (13–14): 1910–1913. doi :10.1002/(SICI)1521-3773(19980803)37:13/14<1910::AID-ANIE1910>3.0.CO;2-D.
- ^ Экснер, К.; Кульманн, О.; Фёгтле, М.; Принцбах, Х.; Гроссманн, Б.; Хайнце, Й.; Лизум, Л.; Бахманн, Р.; Швайгер, А.; Гешайдт, Г. (2000). «Циклическая внутриплоскостная делокализация электронов (σ-бисомоароматичность) в радикальных анионах 4N/5e и дианионах 4N/6e – генерация, структуры, свойства, ионное спаривание и расчеты». J. Am. Chem. Soc . 122 (43): 10650–10660. doi :10.1021/ja0014943.
- ^ аб Фольц, Х.; Шин, Дж. (2006). «Бицикло[3.2.1]окта-3,6-диен-2-ил катион: бишомоантиаромат». Дж. Орг. Хим . 71 (6): 2220–2226. дои : 10.1021/jo0515125. ПМИД 16526766.