Генетика старения
Генетика старения, как правило, занимается продлением жизни, связанным с генетическими изменениями, а не с болезнями ускоренного старения, ведущими к сокращению продолжительности жизни.
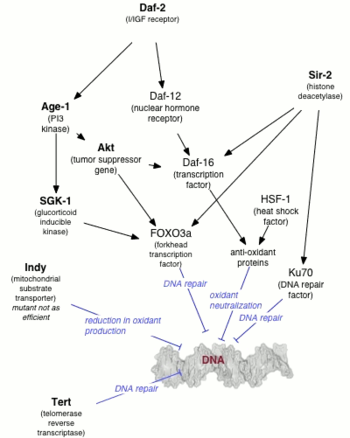
Первой мутацией, которая, как было обнаружено, увеличивает продолжительность жизни у животных, был ген age-1 у Caenorhabditis elegans . Майкл Класс обнаружил, что продолжительность жизни C. elegans может быть изменена мутациями, но Класс считал, что эффект был вызван сокращением потребления пищи ( ограничением калорий ). [1] Томас Джонсон позже показал, что продление жизни до 65% было вызвано самой мутацией, а не ограничением калорий, [2] и он назвал ген age-1 в надежде, что будут найдены другие гены, контролирующие старение. Ген age-1 кодирует каталитическую субъединицу фосфатидилинозитол-3-киназы класса I (PI3K).
Спустя десятилетие после открытия Джонсона daf-2 , один из двух генов, необходимых для формирования личинок дауэра , [3] был показан Синтией Кеньон для удвоения продолжительности жизни C. elegans . [4] Кеньон показала, что мутанты daf-2 , которые формируют дауэры при температуре выше 25 °C (77 °F), обходят состояние дауэра при температуре ниже 20 °C (68 °F) с удвоением продолжительности жизни. [4] До исследования Кеньон считалось, что продолжительность жизни может быть увеличена только за счет потери репродуктивной способности, но нематоды Кеньон сохранили репродуктивную способность молодого возраста, а также продлили молодость в целом. Было показано, что последующая генетическая модификация (мутация PI3K-null) C. elegans увеличила максимальную продолжительность жизни в десять раз. [5] [6]
Долгоживущие мутанты C. elegans ( age-1 и daf-2 ) продемонстрировали устойчивость к окислительному стрессу и ультрафиолетовому излучению . [7] Эти долгоживущие мутанты обладали более высокой способностью к восстановлению ДНК , чем дикий тип C. elegans . [7] Выключение гена эксцизионной репарации нуклеотидов Xpa-1 увеличило чувствительность к ультрафиолету и сократило продолжительность жизни долгоживущих мутантов. Эти результаты подтверждают гипотезу о том, что повреждение ДНК играет важную роль в процессе старения . [7]
Генетические модификации у других видов не привели к такому значительному увеличению продолжительности жизни, как у C. elegans . Продолжительность жизни Drosophila melanogaster была удвоена. [8] Генетические мутации у мышей могут увеличить максимальную продолжительность жизни в 1,5 раза от нормы и до 1,7 раза от нормы в сочетании с ограничением калорий . [9]
У дрожжей NAD +-зависимая гистондеацетилаза Sir2 необходима для геномного сайленсинга в трех локусах: локусах спаривания дрожжей , теломерах и рибосомальной ДНК (рДНК). У некоторых видов дрожжей репликативное старение может быть частично вызвано гомологичной рекомбинацией между повторами рДНК; вырезание повторов рДНК приводит к образованию внехромосомных колец рДНК (ERC). Эти ERC реплицируются и преимущественно сегрегируют в материнскую клетку во время деления клетки и, как полагают, приводят к клеточному старению путем титрования (конкурирования за) основных ядерных факторов . ERC не наблюдались у других видов (и даже у всех штаммов того же вида дрожжей) дрожжей (которые также демонстрируют репликативное старение), и считается, что ERC не способствуют старению у высших организмов, таких как люди (не было показано, что они накапливаются у млекопитающих аналогично дрожжам). Экстрахромосомная кольцевая ДНК (eccDNA) была обнаружена у червей, мух и людей. Происхождение и роль eccDNA в старении, если таковые имеются, неизвестны.
Несмотря на отсутствие связи между кольцевой ДНК и старением у высших организмов, дополнительные копии Sir2 способны продлевать продолжительность жизни как червей, так и мух (хотя у мух это открытие не было воспроизведено другими исследователями, а активатор Sir2 ресвератрол не воспроизводимо увеличивает продолжительность жизни ни у одного из видов. [10] ) Неясно, играют ли гомологи Sir2 у высших организмов какую-либо роль в продолжительности жизни, но было показано, что человеческий белок SIRT1 деацетилирует p53 , Ku70 и семейство факторов транскрипции forkhead . SIRT1 также может регулировать ацетилирование, такое как CBP/p300 , и, как было показано, деацетилирует определенные остатки гистонов .
RAS1 и RAS2 также влияют на старение дрожжей и имеют человеческого гомолога. Было показано, что повышенная экспрессия RAS2 увеличивает продолжительность жизни дрожжей.
Другие гены регулируют старение дрожжей, увеличивая устойчивость к окислительному стрессу . Супероксиддисмутаза , белок , который защищает от воздействия митохондриальных свободных радикалов , может продлить продолжительность жизни дрожжей в стационарной фазе при сверхэкспрессии.
У высших организмов старение, вероятно, частично регулируется через путь инсулина/IGF-1. Мутации, которые влияют на инсулиноподобную сигнализацию у червей, мух и ось гормона роста/IGF1 у мышей, связаны с увеличением продолжительности жизни. У дрожжей активность Sir2 регулируется никотинамидазой PNC1. PNC1 транскрипционно повышается в стрессовых условиях, таких как ограничение калорийности , тепловой шок и осмотический шок . Превращая никотинамид в ниацин , никотинамид удаляется, ингибируя активность Sir2. Никотинамидаза, обнаруженная у людей, известная как PBEF, может выполнять аналогичную функцию, а секретируемая форма PBEF, известная как висфатин, может помогать регулировать уровень инсулина в сыворотке . Однако неизвестно, существуют ли эти механизмы также у людей, поскольку существуют очевидные различия в биологии между людьми и модельными организмами.
Было показано, что активность Sir2 увеличивается при ограничении калорий. Из-за недостатка доступной глюкозы в клетках доступно больше NAD+, который может активировать Sir2. Сообщалось, что ресвератрол , стильбеноид, обнаруженный в кожице красного винограда , увеличивает продолжительность жизни дрожжей, червей и мух (независимые исследователи доказали невоспроизводимость увеличения продолжительности жизни мух и червей [10] ). Было показано, что он активирует Sir2 и, следовательно, имитирует эффекты ограничения калорий, если принять, что ограничение калорий действительно зависит от Sir2.
Согласно базе данных GenAge генов, связанных со старением, существует более 1800 генов, изменяющих продолжительность жизни модельных организмов : 838 у почвенного круглого червя ( Caenorhabditis elegans ), 883 у пекарских дрожжей ( Saccharomyces cerevisiae ), 170 у плодовой мушки ( Drosophila melanogaster ) и 126 у мыши ( Mus musculus ). [11]
Ниже приведен список генов, связанных с долголетием по результатам исследований [11] на модельных организмах :
| Подоспора | Сахаромицеты | Каэнорабдитис | Дрозофила | Мус |
|---|---|---|---|---|
| гризея | ЛАГ1 | даф-2 | sod1 | Проп-1 |
| ЛАК1 | возраст-1 /daf-23 | кот1 | p66shc (независимая проверка не проводилась) | |
| пит-1 | Гхр | |||
| РАС1 | даф-18 | мтх | mclk1 | |
| РАС2 | акт-1/акт-2 | |||
| ФГБ1 | даф-16 | |||
| ФГБ2 | даф-12 | |||
| CDC7 | ctl-1 | |||
| БУД1 | старый-1 | |||
| РТГ2 | спе-26 | |||
| РПД3 | клк-1 | |||
| HDA1 | мэв-1 | |||
| СИР2 | ||||
| аак-2 | ||||
| СИР4-42 | ||||
| УТХ4 | ||||
| YGL023 | ||||
| СГС1 | ||||
| РАД52 | ||||
| FOB1 |

В июле 2020 года ученые, используя общедоступные биологические данные о 1,75 млн человек с известной продолжительностью жизни в целом, идентифицировали 10 геномных локусов , которые, по-видимому, по сути влияют на продолжительность жизни , здоровье и долголетие — из которых половина ранее не была зарегистрирована на уровне генома и большинство из них связаны с сердечно-сосудистыми заболеваниями — и определили метаболизм гема как перспективный кандидат для дальнейших исследований в этой области. Их исследование предполагает, что высокий уровень железа в крови, вероятно, снижает, а гены, участвующие в метаболизме железа, вероятно, увеличивают здоровые годы жизни у людей. [13] [12]
Нед Шарплесс и его коллеги продемонстрировали первую связь in vivo между экспрессией p16 и продолжительностью жизни. [14] Они обнаружили сниженную экспрессию p16 в некоторых тканях мышей с мутациями, которые увеличивают продолжительность жизни, а также у мышей, продолжительность жизни которых была увеличена за счет ограничения питания. Ян ван Дёрсен и Даррен Бейкер в сотрудничестве с Андре Терзичем в клинике Майо в Рочестере, штат Миннесота, представили первые доказательства in vivo причинно-следственной связи между клеточным старением и старением, предотвратив накопление стареющих клеток у прогероидных мышей BubR1 . [15] При отсутствии стареющих клеток ткани мышей показали значительное улучшение обычного бремени возрастных расстройств. У них не развивалась катаракта , они избегали обычной потери мышечной массы с возрастом. Они сохраняли жировые слои в коже, которые обычно истончаются с возрастом и у людей вызывают появление морщин. Второе исследование, проведенное Яном ван Дёрсеном в сотрудничестве с группой сотрудников клиники Майо и Гронингенского университета, предоставило первые прямые доказательства in vivo того, что клеточное старение вызывает признаки старения, устраняя стареющие клетки у прогероидных мышей путем введения индуцируемого лекарством гена самоубийства , а затем обработки мышей препаратом для избирательного уничтожения стареющих клеток, в отличие от снижения p16 во всем организме. [16] Другое исследование Майо, проведенное Джеймсом Киркландом в сотрудничестве со Скриппсом и другими группами, продемонстрировало, что сенолитики, препараты, нацеленные на стареющие клетки, улучшают сердечную функцию и улучшают сосудистую реактивность у старых мышей, облегчают нарушение походки, вызванное радиацией у мышей, и задерживают дряхлость, неврологическую дисфункцию и остеопороз у прогероидных мышей. Открытие сенолитических препаратов было основано на подходе, основанном на гипотезе: исследователи использовали наблюдение, что стареющие клетки устойчивы к апоптозу, чтобы обнаружить, что пути, способствующие выживанию, активируются в этих клетках. Они продемонстрировали, что эти пути выживания являются «ахиллесовой пятой» стареющих клеток, используя подходы РНК-интерференции , включая пути, связанные с Bcl-2, AKT, p21 и тирозинкиназой. Затем они использовали препараты, известные своей нацеленностью на идентифицированные пути, и показали, что эти препараты убивают стареющие клетки путем апоптоза в культуре и снижают нагрузку стареющих клеток в нескольких тканях in vivo. Важно, что эти препараты имели долгосрочные эффекты после однократной дозы, соответствующие удалению стареющих клеток, а не временный эффект, требующий постоянного присутствия препаратов. Это было первое исследование, показавшее, что очистка стареющих клеток улучшает функцию у хронологически старых мышей. [17]
Генетически обусловленная способность к восстановлению ДНК и старение
Генетически обусловленная способность восстанавливать повреждения ДНК, по -видимому, является ключевым фактором старения при сравнении нескольких видов птиц и животных. Когда скорость накопления повреждений ДНК (двухцепочечных разрывов) в лейкоцитах дельфинов, коз, северных оленей, американских фламинго и белоголовых сипов сравнивалась с продолжительностью жизни особей этих различных видов, было обнаружено, что виды с большей продолжительностью жизни имеют более медленное накопление повреждений ДНК. [18] Активность фермента PARP1, используемого в нескольких процессах восстановления ДНК, сравнивалась у тринадцати различных видов млекопитающих, и было обнаружено, что его активность коррелирует с максимальной продолжительностью жизни вида. [19] У людей генетически обусловленная способность к восстановлению ДНК, по-видимому, влияет на продолжительность жизни. Было обнаружено, что линии лимфобластоидных клеток, полученные из образцов крови людей, проживших более 100 лет (столетних), имеют значительно более высокую активность белка репарации ДНК поли (АДФ-рибоза) полимеразы ( PARP ), чем линии клеток от более молодых людей (от 20 до 70 лет). [20]
Стада для увеличения продолжительности жизни
Эффект отцовского возраста
В статье 2008 года была обнаружена U-образная связь между возрастом отца и общим уровнем смертности детей (т. е. уровнем смертности до 18 лет). [21] Хотя относительные показатели смертности были выше, абсолютные цифры были низкими из-за относительно низкой частоты генетических аномалий. Исследование подверглось критике за то, что оно не учитывало материнское здоровье, которое могло бы оказать большое влияние на детскую смертность. [22] Исследователи также обнаружили корреляцию между возрастом отца и смертью потомства от травм или отравлений, что указывает на необходимость контроля социальных и поведенческих факторов. [23]
В 2012 году исследование показало, что больший возраст отцовства имеет тенденцию увеличивать длину теломер у потомства на протяжении двух поколений. Поскольку длина теломер влияет на здоровье и смертность, это может влиять на здоровье и скорость старения у этого потомства. Авторы предположили, что этот эффект может обеспечить механизм, с помощью которого популяции обладают некоторой пластичностью в адаптации долголетия к различным социальным и экологическим контекстам. [24]Смотрите также
Ссылки
- ^ Класс MR (1983). «Метод изоляции мутантов долголетия у нематоды Caenorhabditis elegans и начальные результаты». Механизмы старения и развития . 22 (3–4): 279–286. doi :10.1016/0047-6374(83)90082-9. PMID 6632998. S2CID 6870538.
- ^ Фридман ДБ, Джонсон ТЕ (1988). «Мутация в гене age-1 у Caenorhabditis elegans удлиняет жизнь и снижает плодовитость гермафродитов» ( PDF ) . Генетика . 118 (1): 75–86. doi :10.1093/genetics/118.1.75. PMC 1203268. PMID 8608934 .
- ^ Готтлиб С., Рувкун Г. (1994). "daf-2, daf-16 и daf-23: генетически взаимодействующие гены, контролирующие формирование Дауэра у Caenorhabditis elegans". Генетика . 137 (1): 107–120. doi :10.1093/genetics/137.1.107. PMC 1205929. PMID 8056303 .
- ^ ab Kenyon C, Chang J, Gensch E, Rudner A, Tabtiang R (1993). "Мутант C. elegans, который живет вдвое дольше дикого типа". Nature . 366 (6454): 461–4. Bibcode :1993Natur.366..461K. doi :10.1038/366461a0. PMID 8247153. S2CID 4332206.
- ^ Ayyadevara S, Alla R, Thaden JJ, Shmookler Reis RJ (2008). "Замечательная долговечность и устойчивость к стрессу нематодных мутантов PI3K-null". Aging Cell . 7 (1): 13–22. doi : 10.1111/j.1474-9726.2007.00348.x . PMID 17996009. S2CID 2470599.
- ^ Shmookler Reis RJ, Bharill P, Tazearslan C, Ayyadevara S (2009). «Мутации с экстремальной продолжительностью жизни организуют подавление множественных сигнальных путей». Biochimica et Biophysica Acta (BBA) - General Subjects . 1790 (10): 1075–83. doi :10.1016/j.bbagen.2009.05.011. PMC 2885961. PMID 19465083 .
- ^ abc Hyun M, Lee J, Lee K, May A, Bohr VA, Ahn B (март 2008 г.). «Продолжительность жизни и устойчивость к стрессу коррелируют со способностью к восстановлению ДНК у Caenorhabditis elegans». Nucleic Acids Res . 36 (4): 1380–9. doi :10.1093/nar/gkm1161. PMC 2275101. PMID 18203746 .
- ^ Татар М., Копельман А., Эпштейн Д., Ту МП., Инь К. М., Гарофало Р. С. (1988). «Мутантный гомолог инсулинового рецептора дрозофилы, который увеличивает продолжительность жизни и нарушает нейроэндокринную функцию». Science . 292 (5514): 107–110. doi :10.1126/science.1057987. PMID 11292875. S2CID 28565101.
- ^ Bartke A, Wright JC, Mattison JA, Ingram DK, Miller RA, Roth GS (2001). «Продление срока жизни долгоживущих мышей» (PDF) . Nature . 414 (6862): 412. doi : 10.1038/35106646 . hdl :2027.42/62803. PMID 11719795. S2CID 4379930.
- ^ ab Bass TM; Weinkove D; Houthoofd K; Gems D; Partridge L (октябрь 2007 г.). "Влияние ресвератрола на продолжительность жизни Drosophila melanogaster и Caenorhabditis elegans ". Механизмы старения и развития . 128 (10): 546–552. doi :10.1016/j.mad.2007.07.007. PMID 17875315. S2CID 1780784.
- ^ ab "GenAge database" . Получено 26 февраля 2011 г. .
- ^ ab Timmers, Paul RHJ; Wilson, James F.; Joshi, Peter K.; Deelen, Joris (16 июля 2020 г.). «Многомерное геномное сканирование выявляет новые локусы и метаболизм гема в старении человека». Nature Communications . 11 (1): 3570. Bibcode :2020NatCo..11.3570T. doi : 10.1038/s41467-020-17312-3 . PMC 7366647 . PMID 32678081.
 Текст и изображения доступны по лицензии Creative Commons Attribution 4.0 International.
Текст и изображения доступны по лицензии Creative Commons Attribution 4.0 International. - ^ "Уровень железа в крови может быть ключом к замедлению старения, показывают генные исследования". phys.org . Получено 18 августа 2020 г. .
- ^ Кришнамурти, Дж.; Торрис, К.; Рэмси, М.Р.; Ковалев, ГИ.; Аль-Регайи, К.; Су, Л.; Шарплесс, Н.Е. (2004). «Экспрессия Ink4a/Arf является биомаркером старения». J. Clin. Invest . 114 (9): 1299–1307. doi :10.1172/JCI22475. PMC 524230. PMID 15520862 .
- ^ Бейкер DJ; Давлати М.М.; Виджшейк Т; Джеганатан КБ; Малуреану Л; ван Ри Дж. Х.; Креспо-Диас Р.; Рейес С; Сиберг Л; Шапиро В; Бехфар А; Терзич А; ван де Слюис Б; ван Дёрсен Дж. М. (январь 2013 г.). «Повышенная экспрессия BubR1 защищает от анеуплоидии и рака и продлевает продолжительность здоровой жизни». Nat Cell Biol . 15 (1): 96–102. дои : 10.1038/ncb2643. ПМК 3707109 . ПМИД 23242215.
- ^ Бейкер, Д.; Вийшейк, Т.; Чкония, Т.; ЛеБрассер, Н.; Чайлдс, Б.; ван де Слюис, Б.; Киркланд, Дж.; ван Дёрсен, Дж. (10 ноября 2011 г.). «Очистка p16Ink4a-положительных сенесцентных клеток задерживает возрастные расстройства». Nature . 479 (7372): 232–6. Bibcode :2011Natur.479..232B. doi :10.1038/nature10600. PMC 3468323 . PMID 22048312.
- ^ Чжу, Ю; Чкония, Т; Пирцхалава, Т; Гауэр, AC; Дин, Х; Гиоргадзе, Н; Палмер, АК; Икено, Ю; Хаббард, Великобритания; Ленбург, М; О'Хара, СП; ЛаРуссо, Северная Каролина; Миллер, доктор медицинских наук; Роос, КМ; Верзоса, Греция; ЛеБрассер, Северная Каролина; Рен, доктор медицинских наук; Фарр, Дж. Н.; Хосла, С; Стаут, МБ; Макгоуэн, С.Дж.; Фурманн-Штройсснигг, Х; Гуркар, Австралия; Чжао, Дж; Коланджело, Д; Дорронсоро, А; Линг, ГГ; Баргути, AS; Наварро, округ Колумбия; Сано, Т; Роббинс, PD; Нидернхофер, LJ; Киркланд, Дж. Л. (9 марта 2015 г.). «Ахиллесова пята стареющих клеток: от транскриптома до сенолитических препаратов». Aging Cell . 14 (4): 644–658. doi :10.1111/acel.12344. PMC 4531078. PMID 25754370 .
- ^ Whittemore K, Martínez-Nevado E, Blasco MA (ноябрь 2019 г.). «Более медленные темпы накопления повреждений ДНК в лейкоцитах коррелируют с более длительной продолжительностью жизни у нескольких видов птиц и млекопитающих». Aging (Albany NY) . 11 (21): 9829–9845. doi :10.18632/aging.102430. PMC 6874430. PMID 31730540 . .
- ^ Bürkle A, Grube K, Küpper JH (1992). «Поли(АДФ-рибозил)ация: ее роль в индуцируемой амплификации ДНК и ее корреляция с продолжительностью жизни видов млекопитающих». Exp Clin Immunogenet . 9 (4): 230–40. PMID 1307244.
- ^ Муирас М.Л., Мюллер М., Шехтер Ф., Бюркле А. (апрель 1998 г.). «Повышенная активность поли(АДФ-рибозы)-полимеразы в линиях лимфобластоидных клеток долгожителей». Джей Мол Мед (Берл) . 76 (5): 346–54. дои : 10.1007/s001090050226. ПМИД 9587069.
- ^ Zhu JL, Vestergaard M, Madsen KM, Olsen J (2008). «Отцовский возраст и смертность у детей». Европейский журнал эпидемиологии . 23 (7): 443–7. doi :10.1007/s10654-008-9253-3. PMID 18437509. S2CID 2092996.
- ^ «В этом конкретном исследовании не было сделано никаких поправок на здоровье матери, а это могло бы оказать большое влияние на детскую смертность». Национальная служба здравоохранения (Великобритания), «Пожилые отцы и смерть детей» (дата обращения: 15 ноября 2013 г.)
- ^ Турне 2009, стр. 102
- ^ Eisenberg DT, Hayes MG, Kuzawa CW (июнь 2012 г.). «Задержка отцовского возраста воспроизводства у людей связана с более длинными теломерами в двух поколениях потомков». Труды Национальной академии наук Соединенных Штатов Америки . 109 (26): 10251–6. Bibcode : 2012PNAS..10910251E. doi : 10.1073/pnas.1202092109 . PMC 3387085. PMID 22689985 .
Источники
- Турнай, Герман (июнь 2009 г.). «Старение мужской репродуктивной функции». В Bewley, Susan; Ledger, William; Nikolaou, Dimitrios (ред.). Старение репродуктивной функции . Cambridge University Press. стр. 95–104. doi :10.1017/CBO9781107784734.012. ISBN 978-1-906985-13-4.
Внешние ссылки
- Ресурсы по геномике старения человека, коллекция баз данных и инструментов, призванных помочь исследователям изучать генетику старения человека.
- База данных NetAge — онлайн-база данных и инструменты сетевого анализа для биогеронтологических исследований.
