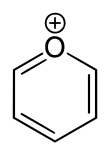
Пирилий
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Пирилий [1] | |||
| Другие имена Пираниум | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| 1421881 | |||
| ЧЭБИ | |||
| ChemSpider | |||
| 558560 | |||
CID PubChem |
| ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С5Н5О + | |||
| Молярная масса | 81,09 г/моль | ||
| Родственные соединения | |||
Родственные соединения | тиопирилий , селенопирилий , теллуропирилий | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Пирилий — катион (положительный ион ) с формулой C5H5O + , состоящий из шестичленного кольца из пяти атомов углерода, каждый с одним атомом водорода и одним положительно заряженным атомом кислорода . Связи в кольце сопряжены , как в бензоле , что придает ему ароматический характер. В частности, из-за положительного заряда атом кислорода трехвалентен . Пирилий — моноциклическое и гетероциклическое соединение , один из ионов оксония .
Синтез
Соли пирилия легко получаются из простых исходных материалов посредством реакции конденсации . [2]
Пирилиевые соли с ароматическими заместителями, такие как тетрафторборат 2,4,6-трифенилпирилия, могут быть получены из двух молей ацетофенона , одного моля бензальдегида и избытка тетрафторборной кислоты . [3] Для пирилиевых солей с алкильными заместителями, таких как соли 2,4,6-триметилпирилия, наилучшим методом является синтез Балабана - Неницеску -Прайля из третичного бутанола и уксусного ангидрида в присутствии тетрафторборной, [4] перхлорной, [5] или трифторметансульфоновой кислот. [6]
Гидроксидные основания раскрывают и гидролизуют пиридин до основания ендиона, которое циклизуется в очень сильных кислотах до катиона пирилия. [7]
Условия енолиза (сильная кислота) заставляют пироны переходить в пирилиевый таутомер. [8]
Химические свойства
Пирилий и его производные образуют стабильные соли с различными анионами. [9] [10] [11] [12] [13] [14]
Как и другие ионы оксония , пирилий нестабилен в нейтральной воде. Однако пирилий гораздо менее реакционноспособен, чем обычные ионы оксония из-за ароматической стабилизации. Высоко электроотрицательный кислород сильно возмущает орбитали в ароматическом кольце, и производные пирилия чрезвычайно устойчивы к электрофильному ароматическому замещению . Катионы пирилия реагируют с нуклеофилами в орто- и пара -положениях , как правило, через ANRORC . [15]
Соли 2,4,6-трифенилпирилия преобразуются гидроксидными основаниями в стабильный 1,5-ендион (псевдобазование), но соли 2,4,6-триметилпирилия при обработке горячими щелочными гидроксидами дают нестабильное псевдооснование, которое подвергается внутримолекулярной конденсации, давая 3,5- диметилфенол . В теплом оксиде дейтерия соли 2,4,6-триметилпирилия подвергаются изотопному обмену 4-метилводородов быстрее, чем для 2- и 6-метильных групп, что позволяет синтезировать региоселективно дейтерированные соединения. [ необходима цитата ]
Производные
Электрофильность пирилия делает их полезными материалами для получения других соединений с более сильным ароматическим характером. Соли пирилия дают пиридины с аммиаком , [16] соли пиридиния с первичными аминами, пиридин -N -оксиды с гидроксиламином , фосфабензолы с производными фосфина , соли тиопирилия с сероводородом и производные бензола с ацетонитрилом или нитрометаном .
Многие важные катионы формально получены из пирилия путем замены различных функциональных групп на некоторые или все атомы водорода в кольце. 2,4,6-Трифенилпирилий реагирует с первичными аминами, образуя производные пиридиния, называемые « солями Катрицкого »; они обычно используются в катализируемом металлом нуклеофильном замещении амина. [15]
Пироны
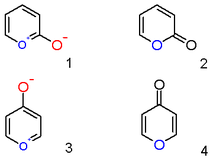
Пирилиевый катион с гидроксильным анионным заместителем в положении 2 не является цвиттерионным ароматическим соединением ( 1 ), а нейтральным ненасыщенным лактоном 2-пироном или пиран-2-оном ( 2 ). Важными представителями этого класса являются кумарины . Аналогично 4-гидроксильное пирилиевое соединение является γ-пироном или пиран-4-оном ( 4 ), к этой группе относятся такие соединения, как мальтол .
Известно, что 2-пироны реагируют с алкинами в реакции Дильса-Альдера с образованием ареновых соединений с выделением диоксида углерода , например: [17]

Полициклические оксониевые арены
Ион хроменилия

Один бициклический ион пирилия называется ионом бензопирилия ( ИЮПАК : ион хроменилия) (формула: C9H7O + , молярная масса : 131,15 г/моль, точная масса: 131,04968983). Его можно рассматривать как заряженное производное 2H - 1 - бензопирана ( ИЮПАК : 2H - хромен, C9H8O ) , или ( заряженное ) замещенное гетероциклическое производное нафталина ( C10H8 ) .

В биологии ион 2-фенилбензопирилия (2-фенилхроменилия) называется флавилием . Класс соединений, полученных из флавилия, — это антоцианидины и антоцианы , пигменты, которые отвечают за окраску многих цветов. [ необходима цитата ]
Катион нафтоксантения

Существуют также более высокие полициклические производные пирилия. Хорошим примером является нафтоксантений. Этот краситель очень стабилен, ароматичен и плосок. Он поглощает в УФ- и синей области и обладает исключительными фотофизическими свойствами. Его можно синтезировать химическими или фотохимическими реакциями. [18]
Смотрите также
- 6-членные ароматические кольца с одним углеродом, замещенным другой группой: борабензол , силабензол , гермабензол , станнабензол , пиридин , фосфорин , арсабензол , стибабензол , бисмабензол , тиопирилий , селенопирилий , теллуропирилий
- Пиран , C5H6O ( пироны , не имеющие кетонную группу )
Ссылки
- ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013. Королевское химическое общество . стр. 1097. doi :10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ Балабан, AT; Врей, В. (1977). " 13 C ЯМР спектры некоторых солей пирилия и родственных соединений". Органический магнитный резонанс . 9 (1): 16–22. doi :10.1002/mrc.1270090105.
- ^ Димрот, Карл; Рейхардт, К.; Фогель, К. (1969). "2,4,6-Трифенилпирилий тетрафторборат". Органические синтезы . 49; Собрание томов , т. 5.
- ^ Балатан, А. Т.; Болтон, А. Дж. (1969). "2,4,6-Триметилпирилий тетрафторборат". Органические синтезы . 49; Собрание томов , т. 5, стр. 1112–1113.
- ^ Балабан, Александру Т.; Неницеску, Костин Д. (1968). «2,4,6-Триметилпирилий перхлорат». Органические синтезы . 44; Собрание томов , т. 5, стр. 1088, 1106, 1114, 1135.
- ^ Балабан, Александру Т.; Бултон, А. Дж. (1973). "2,4,6-Триметилпирилий трифторметансульфонат". Органические синтезы; Собрание томов , т. 5, стр. 1112, 1114–1116.
- ^ Гомес-Паломино, Алехандро; Гьяцца, Клеман; Буш, Джулия; Вагнер, Лукас; Корнелла, Хосеп (2023). «Получение тетрафторбората пирилия (Pyry-BF4)». Органические синтезы . 100 : 361–381.
- ^ Агиеманг, Нана Б.; Мурелли, Райан П. (2019). «Синтез 5-гидрокси-4-метокси-2-метилпирилий трифторметансульфоната из койевой кислоты». Органические синтезы . 96 : 494–510.
- ^ Gilchrist, TL (1997). Гетероциклическая химия . Longman. ISBN 0-582-27843-0.
- ^ Балабан, AT; Шрот, W.; Фишер, G. (1969). «Соли пирилия, часть I. Синтезы». В Katritzky, AR; Boulton, AJ (ред.). Advances in Heterocyclic Chemistry Volume 10. Vol. 10. New York: Academic Press. pp. 241–326. doi :10.1016/S0065-2725(08)60499-7. ISBN 978-0-12-020610-0.
- ^ Балабан, AT; Динкулеску, A.; Дорофеенко, GN; Фишер, GW; Коблик, AV; Межерицкий, VV; Шрот, W. (1982). Катрицкий, AR (ред.). Соли пирилия. Синтезы, реакции и физические свойства . Достижения в гетероциклической химии: Приложение. Том 2. Нью-Йорк: Academic Press. ISBN 978-0-12-020652-0.
- ^ Балабан, AT (1979). «Пирилиевый катион как синтон в органической химии». В Mitra, RB; Ayyangar, NR; Gogte, VN; Acheson, RM; Cromwell, N. (ред.). Новые тенденции в гетероциклической химии . Исследования по органической химии. Том 3. Амстердам: Elsevier. С. 79–111. ISBN 978-0-444-41737-4.
- ^ Балабан, AT (1987). «Соли пирилия как полезные синтоны». В Chizov, O. (ред.). Органический синтез: современные тенденции . Oxford: Blackwell. стр. 263–274. ISBN 0-632-02014-8.
- ^ Балабан, ТС; Балабан, АТ (2003). "Соли пирилия". Гетарены и родственные кольцевые системы, шестичленные гетарены с одним халькогеном . Наука синтеза; Методы молекулярных превращений Губена-Вейля. Т. 14. Штутгарт: Georg Thieme Verlag. С. 11–200. ISBN 978-3-13-118641-6.
- ^ ab Pang, Yue; Moser, Daniel; Cornella, Josep (2020). «Соли пирилия: селективные реагенты для активации первичных аминогрупп в органическом синтезе». Synthesis . 52 (4): 489–503. doi :10.1055/s-0039-1690703. S2CID 208705148.
- ^ Андерсон, АГ; Стэнг, ПДж (1981). "2,6-Ди-трет-Бутил-4-Метилпиридин" (PDF) . Органические синтезы . 60 : 34; Собрание томов , т. 7, стр. 144.
- ^ Delaney, PM; Moore, JE; Harrity, JPA (2006). «Путь циклоприсоединения алкинилборонового эфира к функционализированным ароматическим бороновым эфирам». Chemical Communications . 2006 (31): 3323–3325. doi :10.1039/b607322k. PMID 16883424.
- ^ Bucher, G.; Bresolí-Obach, R.; Brosa, C.; Flors, C.; Luis, JL; Grillo, TA; Nonell, S. (2014). «β-Phenyl quenching of 9-phenylphenalenones: a novel photocyclisation response with biology symptoms». Physical Chemistry Chemical Physics . 16 (35): 18813–18820. Bibcode :2014PCCP...1618813B. doi :10.1039/C4CP02783C. PMID 25079707.