ЕСКРТ
Эндосомальные сортировочные комплексы, необходимые для транспортного ( ESCRT ) механизма, состоят из цитозольных белковых комплексов, известных как ESCRT-0, ESCRT-I, ESCRT-II и ESCRT-III. Вместе с рядом вспомогательных белков эти комплексы ESCRT обеспечивают уникальный режим ремоделирования мембран , который приводит к изгибу/отпочкованию мембран от цитоплазмы . [1] [2] Эти компоненты ESCRT были выделены и изучены у ряда организмов, включая дрожжи и людей. [3] Эукариотический сигнатурный белок , механизм обнаружен у всех эукариот и некоторых архей . [4]
Механизм ESCRT играет жизненно важную роль в ряде клеточных процессов, включая биогенез мультивезикулярных телец (MVB), клеточную абсцисию и вирусное почкование . Биогенез мультивезикулярных телец (MVB) — это процесс, в котором убиквитин -меченые белки попадают в органеллы, называемые эндосомами, посредством образования везикул . Этот процесс необходим клеткам для разрушения неправильно свернутых и поврежденных белков. [5] Без механизма ESCRT эти белки могут накапливаться и приводить к нейродегенеративным заболеваниям. Например, аномалии в компонентах ESCRT-III могут приводить к неврологическим расстройствам, таким как наследственная спастическая параплегия (HSP). [6] Клеточное абсциссия, процесс, при котором расщепляется мембрана, соединяющая две дочерние клетки, также опосредуется механизмом ESCRT. Без комплексов ESCRT дочерние клетки не могли бы разделиться, и образовывались бы аномальные клетки, содержащие вдвое больше ДНК . Эти клетки неизбежно были бы уничтожены в результате процесса, известного как апоптоз . Наконец, вирусное почкование, или процесс, посредством которого определенные типы вирусов покидают клетки, может не происходить при отсутствии механизма ESCRT. Это неизбежно предотвратило бы распространение вирусов от клетки к клетке.
Комплексы ESCRT и вспомогательные белки

Каждый из комплексов ESCRT и вспомогательных белков имеет уникальную структуру, которая обеспечивает различные биохимические функции. Существует ряд синонимов для каждого белкового компонента механизма ESCRT, как для дрожжей, так и для метазоа . Ниже приведена сводная таблица всех этих белков.
У дрожжей существуют следующие комплексы/вспомогательные белки:
ЕСКРТ-0
Комплекс ESCRT-0 играет жизненно важную роль в образовании мультивезикулярных телец путем связывания и кластеризации убиквитинированных белков и/или рецепторов на поверхности клетки. Затем комплекс отвечает за связывание с липидом на эндосомальной мембране, который привлекает эти меченые белки в эндосому. [7] После правильной локализации эти белки затем попадают в эндосому через везикулы, образуя мультивезикулярные тела, и в конечном итоге доставляются в лизосому , где они деградируют. Этот процесс имеет важное значение, поскольку это основной путь деградации поврежденных белков, прошедших через аппарат Гольджи . [5] Компоненты комплекса ESCRT-0 существуют следующим образом:
Комплекс представляет собой гетеродимер 1:1 Vps27 ( белок сортировки вакуолярных белков 27) и Hse1 . [1] [6] Vps27 и Hse1 димеризуются через антипараллельные спирально-спиральные домены GAT (названные так в честь белков GGA и Tom1). [1] Как Vps27, так и Hse1 содержат аминоконцевой домен VHS (названный так потому, что он содержится в белках V ps27, H RS и S TAM). [8] Эти домены VHS связывают убиквитин с белками, которые клетка стремится деградировать. Убиквитин также может ассоциироваться с мотивами взаимодействия с убиквитином, такими как тот, что находится на Hse1, или двухсторонний домен, обнаруженный на Vps27. Домен FYVE (названный в честь четырех белков, в которых он был первоначально идентифицирован: Fab1p, YOTB, Vac1 и EEA1) обнаружен зажатым между доменами мотива взаимодействия VHS и убиквитина Vps27. [6] [9] Фосфатидилинозитол-3-фосфат , распространенный эндосомальный липид, связывается с этим доменом FYVE, что приводит к привлечению ESCRT-0 в эндосому. [6]
ESCRT-I
Роль комплекса ESCRT-I заключается в содействии образованию мультивезикулярных тел путем кластеризации убиквитинированных белков и действия в качестве моста между комплексами ESCRT-0 и ESCRT-II. [10] Он также играет роль в распознавании и ремоделировании мембраны во время отслоения мембраны, образуя кольца по обе стороны от срединного тела делящихся клеток. ESCRT-I также отвечает за привлечение ESCRT-III, который образует зону сужения непосредственно перед разделением клеток. [11] Кроме того, ESCRT-I играет роль в почковании вируса, взаимодействуя со специфическими вирусными белками, что приводит к привлечению дополнительного аппарата ESCRT к потенциальному месту высвобождения вируса. [12] Подробности аппарата ESCRT-I описаны ниже.
Комплекс ESCRT-I представляет собой гетеротетрамер (1:1:1:1) Vps23, Vps28 , Vps37 и Mvb12. [3] Собранный гетеротетрамер выглядит как стержнеобразный стебель, состоящий из Vps23, Vps37 и Mvb12 с веерообразным колпачком, состоящим из одиночных спиралей Vps23, Vps28 и Vps37. [3] [6] Vps23 содержит один домен варианта убиквитина E2, который отвечает за связывание убиквитина, комплекса ESCRT-0 и мотива PTAP ( пролин , треонин , аланин , пролин ) вирусных белков Gag . [3] [6] Сразу после этого домена варианта убиквитина E2 присутствует богатый пролином мотив (GPPX 3 Y), который направляет ESCRT-I к среднему тельцу во время отслоения мембраны. [6] Mvb12 также может связывать убиквитин через свой карбоксильный конец . Vps28 отвечает за взаимодействие ESCRT-I и ESCRT-II, связываясь с доменом GLUE ( связывание биквитина G RAM- подобно U в E AP45) Vps36 через свой карбоксильный конец четырехспирального домена. [1]
ESCRT-II
Комплекс ESCRT-II функционирует в основном во время биогенеза мультивезикулярных тел и доставки убиквитин-меченых белков в эндосому. Убиквитин-меченые белки передаются от ESCRT-0 к ESCRT-I, а затем к ESCRT-II. ESCRT-II ассоциируется с ESCRT-III, который защемляет везикулу, содержащую груз. [6] Конкретные аспекты ESCRT-II следующие:
ESCRT-II представляет собой гетеротетрамер (2:1:1), состоящий из двух субъединиц Vps25 , одной субъединицы Vps22 и одной субъединицы Vps36 . [3] Молекулы Vps25 содержат мотивы PPXY, которые связываются с мотивами крылатой спирали (WH) Vps22 и Vps36, создавая Y-образный комплекс с Vps22 и Vps36 в качестве основания и молекулами Vps25 в качестве плеч. [3] [6] Молекулы Vps25 также содержат мотивы WH, которые отвечают за взаимодействие ESCRT-II с ESCRT-III. Vps36 содержит домен GLUE, который связывает фосфатидилинозитол-3-фосфат и Vps28 ESCRT-I. [3] [6] Два домена цинковых пальцев соединены петлей с доменом GLUE дрожжевого Vps36. Один из этих доменов цинкового пальца связывает карбокси-концевой домен Vps28, а другой ассоциируется с убиквитином. [6]
ESCRT-III
Комплекс ESCRT-III, вероятно, является самым важным из всех механизмов ESCRT, поскольку он играет роль во всех процессах, опосредованных ESCRT. [13] Во время отслоения мембраны и вирусного почкования ESCRT-III образует длинные нити, которые обвиваются вокруг места сужения мембраны непосредственно перед расщеплением мембраны. [11] [14] Это опосредование отслоения происходит посредством взаимодействия с комплексом центрального шпиндлина . [15] Эти нитевидные структуры также присутствуют во время формирования мультивезикулярных тел и функционируют как кольцевой забор, который закупоривает отпочковывающуюся везикулу, чтобы предотвратить утечку грузовых белков в цитозоль клетки. [11] ESCRT-III существует и функционирует следующим образом:
Комплекс ESCRT-III отличается от всех других механизмов ESCRT тем, что он существует только временно и содержит как основные, так и неосновные компоненты. [1] [11] Основные субъединицы должны собираться в правильном порядке (Vps20, Snf7, Vps24 , затем Vps2) для функционирования механизма. [6] Неосновные субъединицы включают Vps60, Did2 и Ist1. [11] Vps20 инициирует сборку ESCRT-III, действуя как нуклеатор сборки полимера Snf7. Затем Vps24 ассоциируется с Snf7, чтобы запечатать комплекс и рекрутировать Vps2. [1] [3] Затем Vps2 приносит Vps4 в комплекс. [16] Все «свободные» цитозольные формы каждой субъединицы считаются закрытыми. То есть, карбоксиконцевая часть каждой субъединицы сворачивается сама на себя аутоингибиторным образом, стабилизируя мономерные субъединицы. [1] [3] Карбокси-конец большинства субъединиц ESCRT-III, как основных, так и второстепенных, содержит мотивы MIM ( MIT ( microtubule interactioning and transport domain) i nteracting motif ). [17] Эти мотивы отвечают за связывание Vps4 и спастина AAA-ATPase . [3]
Vps4-Vta1
Белки Vps4-Vta1 требуются для удаления других компонентов ESCRT (обычно ESCRT-III) из мембран после завершения определенного процесса. Существуют некоторые споры относительно того, расщепляет ли Vps4 комплекс ESCRT-III или ремоделирует комплекс так, чтобы один компонент сбрасывался в определенное время. [12] Считается, что Vta1 действует как активатор Vps4, помогая его сборке и усиливая его активность AAA-АТФазы. [13] [18] Эти белки функционируют следующим образом:
Субъединицы Vps4 имеют два функциональных домена, аминоконцевой домен MIT и центральный домен AAA-АТФазы. [3] Домен MIT отвечает за взаимодействие Vps4 с доменом MIM Vps2. [1] Домен AAA-АТФазы гидролизует АТФ для обеспечения разборки комплекса ESCRT-III. [11] Это «раздевание» ESCRT-III позволяет всем связанным субъединицам быть повторно использованы для дальнейшего использования. [11] [12] Vta1 представляет собой димерный белок, содержащий один домен VSL (названный так потому, что он обнаружен в белках V ps4, S BP1 и L IP5), который обеспечивает связывание с Vps4, и домен MIT для ассоциации с субъединицей ESCRT-III Vps60. Хотя это и не является необходимым, было показано, что Vta1 помогает в сборке кольца Vps4, ускоряет активность АТФазы Vsp4 и способствует разборке ESCRT-III. [6]
Бро1
Основная функция Bro1 — привлечение деубиквитиназ к комплексу ESCRT-III. [19] Это приводит к удалению убиквитиновых меток из белков, предназначенных для деградации в лизосоме непосредственно перед образованием мультивезикулярных телец. Также предполагалось, что Bro1 помогает стабилизировать ESCRT-III, в то время как убиквитиновые метки отщепляются от грузовых белков. [19]
Bro1 содержит аминоконцевой домен Bro1, который связывается с Snf7 ESCRT-III. [20] Это связывание переносит Bro1 к месту отслоения мембраны. Bro1 также связывает каталитический домен Doa4, убиквитингидролазы (деубиквитиназы), перенося его к месту отслоения. Doa4 удаляет убиквитин из грузовых белков, направляемых в лизосому. [20]
Биогенез мультивезикулярных тел и перемещение грузов
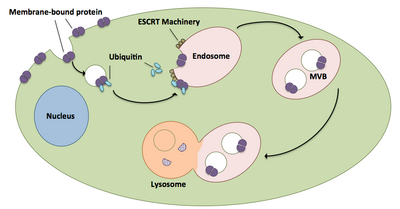
Мультивезикулярные тельца играют большую роль в транспортировке убиквитинированных белков и рецепторов в лизосому. [21] Комплексы ESCRT транспортируют убиквитинированный груз в клеточные везикулы, которые почковываются непосредственно в эндосомальный отсек клетки, образуя мультивезикулярные тельца. [21] Эти мультивезикулярные тельца в конечном итоге сливаются с лизосомой, вызывая деградацию груза. [16] Более подробное описание процесса, включая связанный с ним механизм, существует ниже:
- Компоненты ESCRT-0 Vps27 и Hse1 каждый связываются с убиквитинированным грузом. [1] [21]
- Vps27 связывается с фосфатидилинозитол-3-фосфатом, эндосомальным липидом, который затем привлекает весь комплекс в эндосому. [1] [21]
- Vps27 связывает субъединицу Vps23 ESCRT-I, перенося ESCRT-I в эндосому. ESCRT-I также может связывать убиквитинированные белки. [1] [21]
- Vps36 связывается с субъединицей ESCRT-I Vps28, что приводит к рекрутированию комплекса ESCRT-II. [1]
- Субъединица Vps25 ESCRT-II связывается с Vps20 комплекса ESCRT-III и активирует его. [1] [16] [21]
- Vps20 запускает формирование нитей Snf7, которые затем покрываются Vps24. [16]
- Vps24 привлекает Vps2, который приводит Vps4 в комплекс. [16]
- Vps4 образует пору из двух гексамерных колец, с которыми связывается Vta1. [1] Этот комплекс Vps4-Vta1 запускает разборку ESCRT-III и знаменует собой конец формирования мультивезикулярных телец. [2]
Отслоение мембраны

Отделение мембраны во время цитокинеза — это процесс, при котором мембрана, соединяющая две дочерние клетки, расщепляется во время деления клетки . Поскольку это сохраняется у ряда архей , отделение мембраны считается самой ранней ролью механизма ESCRT. [6] Процесс начинается, когда центросомальный белок Cep55 привлекается к среднему тельцу делящихся клеток в ассоциации с MKLP1, митотическим кинезиноподобным белком, который ассоциируется с микротрубочками. [6] [23] Затем Cep55 привлекает субъединицу Vps23 ESCRT-I и вспомогательный белок ALIX, которые образуют кольца по обе стороны среднего тельца. [6] [11] [12] ESCRT-I и ALIX привлекают ESCRT-III через его субъединицу Snf7. [6] Субъединицы ESCRT-III Vps20, Snf7, Vps24, Vps2 и Did2 образуют спиралевидную фибриллу, прилегающую к кольцам, образованным Vps23. [1] [12] [19] Образование этой спиралевидной структуры деформирует мембрану, и спастин ААА-АТФазы вводится Did2 и Ist1 для расщепления микротрубочек, образованных в средней части тела. [12] [19] Затем Vps4 катализирует разборку комплекса ESCRT-III, что приводит к образованию двух новых разделенных дочерних клеток. [19] Процесс отделения мембраны был описан с использованием белков многоклеточных животных, поскольку этот процесс был изучен в большей степени у многоклеточных животных.
Вирусное почкование

Высвобождение вирусных частиц, также известное как вирусное почкование , представляет собой процесс, посредством которого свободные вирионы высвобождаются из клеток посредством захвата механизма ESCRT клетки-хозяина. [1] [14] Ретровирусы , такие как ВИЧ-1 и человеческий Т-лимфотропный вирус , а также ряд оболочечных вирусов , включая вирус Эбола , требуют механизма ESCRT для выхода из клетки-хозяина. [1] Процесс инициируется вирусными белками Gag, основными структурными белками ретровирусных оболочек, которые взаимодействуют с TSG101 комплекса ESCRT-I и вспомогательным белком ALIX. [12] [13] Субъединицы ESCRT-III (только CHMP4 и CHMP2 являются необходимыми) [10] привлекаются к месту вирусного почкования, чтобы сжать и разорвать шейку почки способом, аналогичным описанному для отслоения мембраны во время цитокинеза. [1] [6] [12] Затем Vps4 перерабатывает компоненты ESCRT-III в цитозоль, и вирус высвобождается из клетки. [6] Описанный здесь механизм использует белки многоклеточных организмов, поскольку почкование вируса более подробно изучалось у многоклеточных организмов.
Ссылки
- ^ abcdefghijklmnopqrs Schmidt O, Teis D (февраль 2012 г.). "The ESCRT machinery". Curr. Biol . 22 (4): R116–20. doi :10.1016/j.cub.2012.01.028. PMC 3314914. PMID 22361144 .
- ^ ab Babst M (август 2011 г.). «Образование везикул MVB: ESCRT-зависимое, ESCRT-независимое и все, что между ними». Curr. Opin. Cell Biol . 23 (4): 452– 7. doi :10.1016/j.ceb.2011.04.008. PMC 3148405. PMID 21570275 .
- ^ abcdefghijkl Hurley JH, Hanson PI (август 2010 г.). «Почкование и расщепление мембраны с помощью механизма ESCRT: все дело в шее». Nat. Rev. Mol. Cell Biol . 11 (8): 556– 66. doi :10.1038/nrm2937. PMC 2922035. PMID 20588296 .
- ^ Сэмсон, RY; Добро, MJ; Дженсен, GJ; Белл, SD (2017). «Структура, функция и роль аппарата ESCRT архей». Прокариотические цитоскелеты . Субклеточная биохимия. Т. 84. С. 357–377 . doi :10.1007/978-3-319-53047-5_12. ISBN 978-3-319-53045-1. PMID 28500532.
- ^ ab Piper RC, Katzmann DJ (2007). «Биогенез и функция мультивезикулярных тел». Annu. Rev. Cell Dev. Biol . 23 : 519– 47. doi :10.1146/annurev.cellbio.23.090506.123319. PMC 2911632 . PMID 17506697.
- ^ abcdefghijklmnopqrst Hurley JH (декабрь 2010 г.). "Комплексы ESCRT". Crit. Rev. Biochem. Mol. Biol . 45 (6): 463– 87. doi :10.3109/10409238.2010.502516. PMC 2988974. PMID 20653365 .
- ^ Wollert T, Hurley JH (апрель 2010 г.). «Молекулярный механизм биогенеза мультивезикулярных тел комплексами ESCRT». Nature . 464 (7290): 864– 9. Bibcode :2010Natur.464..864W. doi :10.1038/nature08849. PMC 2851844 . PMID 20305637.
- ^ Ren X, Hurley JH (март 2010 г.). «VHS-домены ESCRT-0 взаимодействуют в высокоавидном связывании с полиубиквитинированным грузом». EMBO J . 29 (6): 1045– 54. doi :10.1038/emboj.2010.6. PMC 2845278 . PMID 20150893.
- ^ Баннерджи С., Басу С., Саркар С. (2010). «Сравнительная геномика выявляет селективное распределение и доменную организацию белков доменов FYVE и PX в эукариотических линиях». BMC Genomics . 11 : 83. doi : 10.1186/1471-2164-11-83 . PMC 2837644. PMID 20122178 .
- ^ ab Morita E, Sandrin V, McCullough J, Katsuyama A, Baci Hamilton I, Sundquist WI (март 2011 г.). «Требования к белку ESCRT-III для почкования ВИЧ-1». Cell Host Microbe . 9 (3): 235– 42. doi :10.1016/j.chom.2011.02.004. PMC 3070458 . PMID 21396898.
- ^ abcdefgh Adell MA, Teis D (октябрь 2011 г.). «Сборка и разборка комплекса разделения мембраны ESCRT-III». FEBS Lett . 585 (20): 3191– 6. doi :10.1016/j.febslet.2011.09.001. PMC 3192940. PMID 21924267 .
- ^ abcdefgh Mueller M, Adell MA, Teis D (август 2012 г.). «Отслоение мембраны: первый взгляд на динамические ESCRT». Curr. Biol . 22 (15): R603–5. doi :10.1016/j.cub.2012.06.063. PMC 3414845. PMID 22877781 .
- ^ abc McDonald B, Martin-Serrano J (июль 2009 г.). «Без обязательств: механизм ESCRT в вирусном почковании и цитокинезе». J. Cell Sci . 122 (Pt 13): 2167–77 . doi :10.1242/jcs.028308. PMC 2723143. PMID 19535732 .
- ^ ab Jouvenet N, Zhadina M, Bieniasz PD , Simon SM (апрель 2011 г.). «Динамика набора белка ESCRT во время ретровирусной сборки». Nat. Cell Biol . 13 (4): 394– 401. doi :10.1038/ncb2207. PMC 3245320. PMID 21394083 .
- ^ Глотцер, Майкл. «Цитокинез: центральный шпиндель играет роль мембранного якоря», Current Biology , 18 февраля 2013 г.
- ^ abcde Teis D, Saksena S, Judson BL, Emr SD (март 2010 г.). «ESCRT-II координирует сборку филаментов ESCRT-III для сортировки грузов и формирования многовезикулярных телец». EMBO J . 29 (5): 871– 83. doi :10.1038/emboj.2009.408. PMC 2837172 . PMID 20134403.
- ^ Скотт А., Гаспар Дж., Стачелл-Бреретон М. Д., Алам С. Л., Скалицки Дж. Дж., Сандквист В. И. (сентябрь 2005 г.). «Структура и взаимодействия белков ESCRT-III домена MIT человеческого VPS4A». Proc. Natl. Acad. Sci. USA . 102 (39): 13813– 8. Bibcode : 2005PNAS..10213813S. doi : 10.1073/pnas.0502165102 . PMC 1236530. PMID 16174732 .
- ^ Азми И., Дэвис Б., Димаано С., Пейн Дж., Эккерт Д., Бабст М., Кацманн DJ (февраль 2006 г.). «Переработка ESCRT с помощью AAA-АТФазы Vps4 регулируется консервативной областью VSL в Vta1». Дж. Клеточная Биол . 172 (5): 705–17 . doi :10.1083/jcb.200508166. ПМК 2063703 . ПМИД 16505166.
- ^ abcde Babst M, Davies BA, Katzmann DJ (октябрь 2011 г.). "Регуляция Vps4 во время сортировки MVB и цитокинеза". Traffic . 12 (10): 1298– 305. doi :10.1111/j.1600-0854.2011.01230.x. PMC 3171586 . PMID 21658171.
- ^ ab Wemmer M, Azmi I, West M, Davies B, Katzmann D, Odorizzi G (январь 2011 г.). «Связывание Bro1 с Snf7 регулирует активность расщепления мембраны ESCRT-III у дрожжей». J. Cell Biol . 192 (2): 295–306 . doi :10.1083/jcb.201007018. PMC 3172170. PMID 21263029 .
- ^ abcdef Hurley JH, Emr SD (2006). «Комплексы ESCRT: структура и механизм сети мембранного транспорта». Annu Rev Biophys Biomol Struct . 35 : 277– 98. doi : 10.1146/annurev.biophys.35.040405.102126. PMC 1648078. PMID 16689637 .
- ^ Carmena M (июль 2012 г.). "Abscission checkpoint control: stuck in middle with Aurora B". Open Biol . 2 (7): 120095. doi :10.1098/rsob.120095. PMC 3411112. PMID 22870391 .
- ^ Zhu C, Bossy-Wetzel E, Jiang W (июль 2005 г.). «Привлечение MKLP1 в среднюю зону веретена/среднее тело с помощью INCENP необходимо для формирования среднего тела и завершения цитокинеза в клетках человека». Biochem. J . 389 (Pt 2): 373– 81. doi :10.1042/BJ20050097. PMC 1175114 . PMID 15796717.
