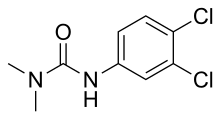
DCMU
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК N ′-(3,4-Дихлорфенил) -N , N -диметилмочевина | |
| Другие имена 3-(3,4-Дихлорфенил)-1,1-диметилмочевина, Кармекс, Диурон, Дирекс | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ЧЭБИ | |
| ChEMBL | |
| ChemSpider | |
| Информационная карта ECHA | 100.005.778 |
| Номер ЕС |
|
| КЕГГ | |
CID PubChem |
|
| Номер RTECS |
|
| УНИИ |
|
| Номер ООН | 3077, 2767 |
Панель инструментов CompTox ( EPA ) |
|
| |
| Характеристики | |
| С9Н10Cl2N2O | |
| Молярная масса | 233,09 г·моль −1 |
| Появление | белое кристаллическое вещество [1] |
| Плотность | 1,48 г/см 3 |
| Температура плавления | 158 °C (316 °F; 431 К) |
| Точка кипения | 180 °C (356 °F; 453 К) |
| 42 мг/л | |
| Давление пара | 0,000000002 мм рт. ст. (20°С) [1] |
| Опасности | |
| Маркировка СГС : | |
   | |
| Предупреждение | |
| Н302 , Н351 , Н373 , Н410 | |
| Р201 , Р202 , Р260 , Р264 , Р270 , Р273 , Р281 , Р301+Р312 , Р308+Р313 , Р314 , Р330 , Р391 , Р405 , Р501 | |
| точка возгорания | негорючий [1] |
| NIOSH (пределы воздействия на здоровье в США): | |
PEL (допустимый) | нет [1] |
РЕЛ (рекомендуется) | Средневзвешенная по времени концентрация 10 мг/м 3 [1] |
IDLH (Непосредственная опасность) | НД [1] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
DCMU ( 3-(3,4-дихлорфенил)-1,1-диметилмочевина ) — альгицид и гербицид класса арилмочевины , подавляющий фотосинтез . Был представлен компанией Bayer в 1954 году под торговым названием Диурон .
История
В 1952 году химики из EI du Pont de Nemours and Company запатентовали ряд производных арильной мочевины в качестве гербицидов . Несколько соединений, защищенных этим патентом, были коммерциализированы в качестве гербицидов: хлортолурон (3-хлор-4-метилфенил) и DCMU, например (3,4-дихлорфенил). [2] [3] Впоследствии более тридцати родственных аналогов мочевины с тем же механизмом действия вышли на мировой рынок. [4]
Синтез
Как описано в патенте du Pont, исходным материалом является 3,4-дихлоранилин , который обрабатывается фосгеном для образования производного изоцианата . Затем он реагирует с диметиламином для получения конечного продукта. [2]
- Арил-NH 2 + COCl 2 → Арил-NCO
- Арил-NCO + NH(CH 3 ) 2 → Арил-NHCON(CH 3 ) 2
Механизм действия
DCMU является очень специфичным и чувствительным ингибитором фотосинтеза. Он блокирует сайт связывания пластохинона Q B фотосистемы II , не допуская поток электронов от фотосистемы II к пластохинону. [5] Это прерывает фотосинтетическую электронно-транспортную цепь в фотосинтезе и, таким образом, снижает способность растения превращать энергию света в химическую энергию ( АТФ и восстановительный потенциал ).
DCMU блокирует только поток электронов из фотосистемы II, он не влияет на фотосистему I или другие реакции фотосинтеза, такие как поглощение света или фиксация углерода в цикле Кальвина . [ необходима ссылка ]
Однако, поскольку он блокирует электроны, полученные в результате окисления воды в ФС II , от входа в пластохиноновый пул, «линейный» фотосинтез эффективно отключается, поскольку нет доступных электронов для выхода из цикла фотосинтетического потока электронов для восстановления НАДФ + до НАДФН. Фактически, было обнаружено, что DCMU не только не ингибирует циклический фотосинтетический путь , но при определенных обстоятельствах фактически стимулирует его. [6] [7]
Из-за этих эффектов DCMU часто используется для изучения потока энергии при фотосинтезе .
Токсичность
DCMU (диурон) был охарактеризован как известный/вероятный канцероген для человека на основе испытаний на животных. [8] [9]
Ссылки
- ^ abcdef Карманный справочник NIOSH по химическим опасностям. "#0247". Национальный институт охраны труда и здоровья (NIOSH).
- ^ ab патент США 2655445, Тодд CW, «3-(Галофенил)-1-метил-1-(метил или этил) мочевины и гербицидные композиции и методы их применения», выдан 1953-10-13, передан EI du Pont de Nemours & Co.
- ^ Лю, Цзин (2010). «Фенилмочевинные гербициды». Справочник Хейса по токсикологии пестицидов . С. 1725–1731. doi :10.1016/B978-0-12-374367-1.00080-X. ISBN 9780123743671.
- ^ "Гербициды на основе мочевины". alanwood.net . Получено 2021-03-26 .
- ^ Metz, J; Pakrasi, H; Seibert, M; Arntzer, C (1986). «Доказательства двойной функции связывающего гербицид белка D1 в фотосистеме II». FEBS Letters . 205 (2): 269. doi : 10.1016/0014-5793(86)80911-5 . S2CID 84205263.
- ^ HUBER, SC EDWARDS, GE (1976), Исследования пути циклического потока электронов в мезофильных хлоропластах растения C4, Biochimica et Biophysica Acta (BBA) - Биоэнергетика, том 449, выпуск 3, 6 декабря 1976 г., страницы 420-433, doi :10.1016/0005-2728(76)90153-5
- ^ Hosler, JP; Yocum, CF (апрель 1987 г.). «Регулирование циклического фотофосфорилирования во время опосредованного ферредоксином транспорта электронов: влияние DCMU и соотношения NADPH/NADP». Plant Physiol . 83 (4): 965–9. doi :10.1104/pp.83.4.965. PMC 1056483. PMID 16665372 .
- ^ "Diuron". Национальный центр биотехнологической информации . Национальная медицинская библиотека США . Получено 9 ноября 2021 г.
- ^ Линда, Тейлор; Эстер, Ринд (1997-05-08). Экспертная оценка канцерогенности диурона (PDF) (Меморандум). Вашингтон, округ Колумбия: Агентство по охране окружающей среды США. 20460.
