Диэтилсульфат
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Диэтилсульфат | |
| Другие имена Диэтиловый эфир серной кислоты | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ЧЭБИ |
|
| ChEMBL | |
| ChemSpider | |
| Информационная карта ECHA | 100.000.536 |
| КЕГГ | |
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С4Н10О4S | |
| Молярная масса | 154,18 г·моль −1 |
| Появление | Бесцветная жидкость. |
| Плотность | 1,2 г/мл |
| Температура плавления | −25 °C (−13 °F; 248 K) |
| Точка кипения | 209 °C (408 °F; 482 K) (разлагается) |
| разлагается в воде | |
| Давление пара | 0,29 мм рт.ст. |
| -86,8·10 −6 см 3 /моль | |
| Опасности | |
| Маркировка СГС : | |
   | |
| Опасность | |
| Н302 , Н312 , Н314 , Н332 , Н340 , Н350 | |
| Р201 , Р202 , Р260 , Р261 , Р264 , Р270 , Р271 , Р280 , Р281 , Р301+Р312 , Р301+Р330+Р331 , Р302+Р352 , Р303+Р361+Р353 , Р304+Р312 , Р304+Р340 , Р305+Р351+Р338 , Р308+Р313 , Р310 , Р312 , Р321 , Р322 , Р330 , Р363 , Р405 , Р501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 104 °C (219 °F; 377 К) |
| Родственные соединения | |
Родственные соединения | Диметилсульфат ; диэтилсульфит |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
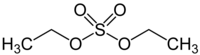
Диэтилсульфат ( DES ) — это сероорганическое соединение с формулой ( C2H5 ) 2SO4 . [1] [ 2 ] Он представляет собой бесцветную маслянистую жидкость со слабым запахом перечной мяты . Это токсичное , горючее и, вероятно, канцерогенное химическое соединение . [3] [ 2 ] Диэтилсульфат используется в качестве этилирующего агента .
Структура и свойства
Хотя формула диэтилсульфата обычно записывается как (C 2 H 5 ) 2 SO 4 , более описательной формулой будет (C 2 H 5 O) 2 SO 2 . Это диэфир серной кислоты. Сера имеет тетраэдрическую структуру.
Диэтилсульфат легко гидролизуется, образуя этанол и этилсульфат . В конечном итоге с избытком воды образуется серная кислота .
Реакции
Диэтилсульфат используется в качестве алкилирующего агента для получения этиловых эфиров, этиламинов [4] и солей аммония, а также этиловых тиоэфиров. При получении этиловых эфиров жирных кислот переносятся оба эквивалента этилового электрофила, в отличие от обычного алкилирования феноксидов : [1]
- 2RCO2Na + ( C2H5O ) 2SO2 → 2RCO2C2H5 + Na2SO4
И диметилсульфат, и диэтилсульфат реагируют также с неорганическими нуклеофилами. Например, йодид калия дает этилйодид.
Подготовка
Диэтилсульфат не может быть эффективно получен аналогично методу, используемому для диметилсульфата . Реакция олеума с диэтиловым эфиром приводит к чрезмерному окислению этильных групп. Вместо этого диэтилсульфат получают в два этапа, начиная с хлорсульфурной кислоты : [1]
- ClSO3H + C2H5OH → C2H5OSO3H + HCl
Полученный этилсульфат затем нагревают с сульфатом натрия , что приводит к реакции перераспределения :
- 2 C 2 H 5 OSO 3 H + Na 2 SO 4 → (C 2 H 5 O) 2 SO 2 + 2 NaHSO 4
Безопасность
Как и другие сильные алкилирующие агенты и особенно диметилсульфат, диэтилсульфат токсичен [2] и генотоксичен . [5] Он классифицируется МАИР как канцероген Группы 2А (вероятно, канцерогенный для человека). [6] Эксперименты на животных показали, что это соединение, вероятно, канцерогенно для человека, поскольку оно было связано с развитием рака гортани . [7] Также отсутствуют доказательства воздействия этого химического соединения на репродуктивное здоровье или развитие. [8]
Нейтрализация
Диалкилсульфаты можно сделать нетоксичными путем обработки водным раствором аммиака . [1]
Дальнейшее чтение
- Теодор, С.; Сай, ПСТ (2001). «Этерификация этанола серной кислотой: кинетическое исследование». Канадский журнал химической инженерии . 79 (1): 54–64. doi :10.1002/cjce.5450790109.
Ссылки
- ^ abcd Вайзенбергер, Карл; Майер, Дитер; Сандлер, Стэнли Р. (2000). «Диалкилсульфаты и алкилсерные кислоты». Энциклопедия промышленной химии Ульмана . doi :10.1002/14356007.a08_493. ISBN 978-3-527-30385-4.
- ^ abc "Диэтилсульфат | CAMEO Chemicals | NOAA". cameochemicals.noaa.gov . Получено 2021-03-04 .
- ^ "NCI Thesaurus". ncit.nci.nih.gov . Получено 2021-04-02 .
- ^ Бак, JR; Парк, M.; Ванг, Z.; Прюдомм, DR; Риццо, CJ (2000). "9-Этил-3,6-диметилкарбазол (DMECZ)". Органические синтезы . 77 : 153. doi :10.15227/orgsyn.077.0153.
- ^ «Агенты, классифицированные в монографиях МАИР, тома 1–129 – Монографии МАИР по выявлению канцерогенных опасностей для человека». monographs.iarc.who.int . Получено 2021-04-02 .
- ^ IARC (1999). «Диэтилсульфат». Резюме и оценки. Международное агентство по изучению рака (IARC). стр. 1405.
- ^ "NCI Thesaurus". ncit.nci.nih.gov . Получено 2021-02-18 .
- ^ "Диэтилсульфат" (PDF) . Агентство по охране окружающей среды США . Архивировано (PDF) из оригинала 2016-10-14.
Внешние ссылки
- "Диэтилсульфат". Веб-книга . NIST.
- «ДИЭТИЛСУЛЬФАТ — ICSC: 0570».
- «Диэтилсульфат» (PDF) . Монографии МАИР. МАИР. 1992.



