Деферазирокс
 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | de FER а сэр вол |
| Торговые наименования | Эксиджад, другие |
| Другие имена | CGP-72670, ICL-670A, IC L670 |
| AHFS / Drugs.com | Монография |
| МедлайнПлюс | а606002 |
| Данные лицензии |
|
Категория беременности |
|
| Пути введения | Через рот |
| код АТС |
|
| Правовой статус | |
| Правовой статус |
|
| Фармакокинетические данные | |
| Биодоступность | 70% |
| Связывание с белками | 99% |
| Метаболизм | Глюкуронирование печени |
| Период полувыведения | от 8 до 16 часов |
| Выделение | Фекалии (84%) и почки (8%) |
| Идентификаторы | |
| |
| Номер CAS | |
| CID PubChem |
|
| DrugBank | |
| ChemSpider | |
| УНИИ |
|
| КЕГГ | |
| ЧЭБИ |
|
| ChEMBL | |
| Панель инструментов CompTox ( EPA ) |
|
| Информационная карта ECHA | 100.211.077 |
| Химические и физические данные | |
| Формула | С21Н15Н3О4 |
| Молярная масса | 373,368 г·моль −1 |
| 3D модель ( JSmol ) |
|
| Плотность | 1,4±0,1 г/см 3 [3] |
| |
 Н Н И (что это?) (проверить) И (что это?) (проверить) | |
Деферазирокс , продаваемый под торговой маркой Exjade среди прочих, является пероральным хелатором железа . Его основное применение заключается в снижении хронической перегрузки железом у пациентов, получающих длительные переливания крови при таких состояниях, как бета- талассемия и другие хронические анемии . [4] [5] Это первый пероральный препарат, одобренный в Соединенных Штатах для этой цели. [6]
Он был одобрен Управлением по контролю за продуктами и лекарствами США (FDA) в ноябре 2005 года. [4] [6] Согласно FDA (май 2007 года), почечная недостаточность и цитопения были зарегистрированы у пациентов, получавших таблетки деферасирокса для пероральной суспензии. Он одобрен в Европейском союзе Европейским агентством по лекарственным средствам (EMA) для детей от шести лет и старше при хронической перегрузке железом из-за повторных переливаний крови. [7] [8] [9] Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [10]
В июле 2020 года компания Teva решила прекратить выпуск деферасирокса. [11] Он доступен в виде дженерика . [12]
Характеристики
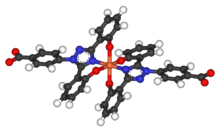
Период полураспада деферасирокса составляет от 8 до 16 часов, что позволяет принимать препарат один раз в день. Две молекулы деферасирокса способны связываться с 1 атомом железа, которые впоследствии выводятся с фекалиями. Его низкая молекулярная масса и высокая липофильность позволяют принимать препарат внутрь в отличие от дефероксамина , который необходимо вводить внутривенно (внутривенно). Вместе с деферипроном деферазирокс, по-видимому, способен удалять железо из клеток (сердечных миоцитов и гепатоцитов), а также удалять железо из крови.
Синтез
Деферазирокс можно получить из простых коммерчески доступных исходных материалов (салициловой кислоты, салициламида и 4-гидразинобензойной кислоты) в следующей двухэтапной последовательности синтеза:

Конденсация салицилилхлорида (образованного in situ из салициловой кислоты и тионилхлорида) с салициламидом в условиях дегидратирующей реакции приводит к образованию 2-(2-гидроксифенил)-1,3(4 H )-бензоксазин-4-она. Этот промежуточный продукт выделяют и подвергают реакции с 4-гидразинобензойной кислотой в присутствии основания, получая 4-(3,5-бис(2-гидроксифенил)-1,2,4-триазол-1-ил)бензойную кислоту (деферазирокс). [13]
Риски
Деферазирокс занял второе место в списке препаратов, наиболее часто подозреваемых в зарегистрированных случаях смерти пациентов, составленном Институтом безопасной медицинской практики за 2019 год, с 1320 предполагаемыми случаями смерти. [14] В том же году было добавлено предупреждение в рамке в отношении почечной недостаточности , печеночной недостаточности и желудочно-кишечного кровотечения . [15] Предполагается, что основной причиной этого всплеска предполагаемых случаев смерти является повторный анализ данных о нежелательных явлениях компанией Novartis . [14]
Ссылки
- ^ «Список всех препаратов с предупреждениями в черном ящике, составленный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»). nctr-crs.fda.gov . FDA . Получено 22 октября 2023 г. .
- ^ "Exjade EPAR". Европейское агентство по лекарственным средствам . 28 августа 2006 г. Получено 21 июня 2024 г.
- ^ "Паспорт безопасности материала (MSDS): Деферазирокс". ChemSrc . 2018.
- ^ ab Choudhry VP, Naithani R (август 2007 г.). «Текущее состояние перегрузки железом и хелатирования с деферасироксом». Indian Journal of Pediatrics . 74 (8): 759–64. doi :10.1007/s12098-007-0134-7. PMID 17785900. S2CID 19930076.Бесплатный полный текст Архивировано 29 апреля 2014 г. на Wayback Machine
- ^ Yang LP, Keam SJ, Keating GM (2007). «Деферазирокс: обзор его использования при лечении хронической перегрузки железом в результате трансфузии». Drugs . 67 (15): 2211–30. doi :10.2165/00003495-200767150-00007. PMID 17927285. S2CID 195686285.
- ^ ab "FDA одобряет первый пероральный препарат для лечения хронической перегрузки железом" (пресс-релиз). Управление по контролю за продуктами и лекарствами США . 9 ноября 2005 г. Получено 31 октября 2007 г.
- ^ "Exjade – deferasirox" (PDF) . Европейское агентство по лекарственным средствам. 2018. Архивировано из оригинала (PDF) 29 декабря 2017 г. Получено 26 ноября 2012 г.
- ^ Kontoghiorghes GJ (апрель 2013 г.). «Закрывать глаза на токсичность деферасирокса?». Lancet . 381 (9873): 1183–4. doi : 10.1016/S0140-6736(13)60799-0 . PMID 23561999. S2CID 27794849.
- ^ "Обзор: побочные эффекты Exjade". Архивировано из оригинала 4 марта 2016 года . Получено 20 апреля 2013 года .
- ^ Всемирная организация здравоохранения (2023). Выбор и использование основных лекарственных средств 2023: веб-приложение A: Модельный список основных лекарственных средств Всемирной организации здравоохранения: 23-й список (2023) . Женева: Всемирная организация здравоохранения. hdl : 10665/371090 . WHO/MHP/HPS/EML/2023.02.
- ^ "Прекращение приема деферасирокса". Управление по контролю за продуктами и лекарствами США (FDA) . Получено 20 июля 2020 г.
- ^ "Drugs@FDA: FDA-Approved Drugs". Управление по контролю за продуктами и лекарствами США . Получено 15 августа 2020 г.
- ^ Steinhauser S, Heinz U, Bartholomä M, Weyhermüller T, Nick H, Hegetschweiler K (2004). «Образование комплекса ICL670 и родственных лигандов с Fe III и Fe II ». European Journal of Inorganic Chemistry . 2004 (21): 4177–4192. doi :10.1002/ejic.200400363.]
- ^ ab "QuarterWatch™ (итоговые данные за 4-й квартал и 2009 год): зарегистрированные случаи смерти пациентов увеличились на 14% в 2009 году". Институт безопасной практики приема лекарств . Получено 28 июня 2021 г.
- ^ Pediatrics AA (19 февраля 2010 г.). «Предупреждение черного ящика добавлено в Exjade». AAP News . doi :10.1542/aapnews.20100219-1 (неактивен 1 ноября 2024 г.). ISSN 1073-0397. Архивировано из оригинала 28 июня 2021 г. . Получено 28 июня 2021 г. .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка )
