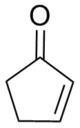
Циклопентенон
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Циклопент-2-ен-1-он | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ЧЭБИ |
| ||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.012.012 | ||
CID PubChem |
| ||
| УНИИ | |||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| Характеристики | |||
| С5Н6О | |||
| Молярная масса | 82.102 г·моль −1 | ||
| Плотность | 0,98 г·мл −1 | ||
| Точка кипения | 150 °C (302 °F; 423 К) | ||
| почти нерастворим в воде | |||
| Опасности | |||
| Охрана труда и техника безопасности (OHS/OSH): | |||
Основные опасности | Вредный | ||
| точка возгорания | 42 °C (108 °F; 315 К) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
2-Циклопентенон — органическое соединение с химической формулой (CH 2 ) 2 (CH) 2 CO . 2-Циклопентенон содержит две функциональные группы: кетон и алкен. Это бесцветная жидкость. Его изомер, 3-циклопентенон, встречается реже.
Термин циклопентенон может также относиться к структурному мотиву , в котором фрагмент циклопентенона является субъединицей более крупной молекулы. Циклопентеноны встречаются во многих природных продуктах , включая жасмон , афлатоксины и несколько простагландинов . [1]
Синтез
2-Циклопентеноны можно синтезировать несколькими способами. Один из путей включает устранение α- бром - циклопентанона с использованием карбоната лития [2] и каскадов конденсации - декарбоксилирования - изомеризации Кляйзена ненасыщенных диэфиров , как показано ниже. [3]

Катализируемая кислотой дегидратация циклопентадиолов дает циклопентенон. [4]
Как функциональная группа, синтез 2-циклопентенонов осуществляется различными другими способами, включая реакцию циклизации Назарова из дивинилкетонов , окисление Саегусы-Ито из циклопентанонов , метатезис с замыканием кольца из соответствующих диенов , окисление соответствующих циклических аллильных спиртов и реакцию Паусона-Ханда из алкенов , алкинов и оксида углерода . [5]
Реакции
Как енон , 2-циклопентенон подвергается типичным реакциям α-β ненасыщенных кетонов, включая нуклеофильное сопряженное присоединение , реакцию Бейлиса-Хиллмана и реакцию Михаэля . Циклопентенон также действует как превосходный диенофил в реакции Дильса-Альдера , реагируя с широким спектром диенов . В одном примере диен типа Данишефского реагирует с циклопентеноном, давая конденсированную трициклическую систему на пути к синтезу кориолина. [6]

Происшествие
Он был выделен из свиной печени, приготовленной под давлением, путем одновременной паровой дистилляции и непрерывной экстракции растворителем . [7] [8]
Родственные соединения
- циклопропенон
- циклобутенон [9]
- циклогексенон
- циклогептенон [10]
Ссылки
- ^ Симеонов, Свилен П.; Нуньес, Жуан Премьер-министр; Герра, Крассимира; Куртева Ваня Б.; Афонсу, Карлос А.М. (25 мая 2016 г.). «Синтез хиральных циклопентенонов». Химические обзоры . 116 (10): 5744–5893 . doi : 10.1021/cr500504w. ISSN 0009-2665. ПМИД 27101336.
- ^ US EP1418166, Дайсуке, Фукусима и Норихико, Хирата, «Процесс производства 2-бромциклопентанона», опубликовано 12 мая 2004 г.
- ^ US EP1422212, Liang, Shelue; Haunert, Andrea & Huber-Dirr, Sylvia et al., «Процесс получения циклопентенона», опубликовано 25 ноября 2004 г.
- ^ Чарльз Х. ДеПей; К. Л. Эйлерс (1962). «2-Циклопентенон». Орг. Синтез . 42:38 . дои :10.15227/orgsyn.042.0038.
- ^ Мюллер, Рето. "Синтез циклопентенонов". Портал органической химии . Получено 3 марта 2015 г.
- ^ Данишефски, Сэмюэл; Замбони, Роберт; Кан, Майкл; Этередж, Сара Джейн (март 1980 г.). «Полный синтез dl-кориолина». Журнал Американского химического общества . 102 (6): 2097– 2098. doi :10.1021/ja00526a061.
- ^ Муссинан, Синтия Дж.; Уолрадт, Джон П. (май 1974 г.). «Летучие компоненты свиной печени, приготовленной под давлением». Журнал сельскохозяйственной и пищевой химии . 22 (5): 827– 831. doi :10.1021/jf60195a002.
- ^ Симеонов, Свилен П.; Нуньес, Жуан Премьер-министр; Герра, Крассимира; Куртева Ваня Б.; Афонсу, Карлос AM (2016). «Синтез хиральных циклопентенонов». Химические обзоры . 116 (10): 5744–5893 . doi : 10.1021/cr500504w. ПМИД 27101336.
- ^ AG Ross, X. Li, SJ Danishefsky (2012). «Получение циклобутенона». Organic Syntheses . 89 : 491. doi : 10.15227/orgsyn.089.0491 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Y. Ito, S. Fujii, M. Nakatuska, F. Kawamoto, T. Saegusa (1979). "Расширение одноуглеродного кольца циклоалканонов до сопряженных циклоалкенонов: 2-циклогептен-1-он". Organic Syntheses . 59 : 113. doi :10.15227/orgsyn.059.0113.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )