Биохимия
| Часть серии статей о |
| Биохимия |
|---|
 |
Биохимия или биологическая химия — это изучение химических процессов внутри и в отношении живых организмов . [1] Биохимия , являющаяся субдисциплиной как химии, так и биологии , может быть разделена на три области: структурную биологию , энзимологию и метаболизм . За последние десятилетия 20-го века биохимия добилась успеха в объяснении жизненных процессов с помощью этих трех дисциплин. Почти все области наук о жизни раскрываются и развиваются с помощью биохимической методологии и исследований. [2] Биохимия фокусируется на понимании химической основы, которая позволяет биологическим молекулам вызывать процессы, происходящие внутри живых клеток и между клетками, [3] в свою очередь, тесно связанные с пониманием тканей и органов , а также структуры и функции организма. [4] Биохимия тесно связана с молекулярной биологией , изучением молекулярных механизмов биологических явлений. [5]
Большая часть биохимии занимается структурами, функциями и взаимодействиями биологических макромолекул, таких как белки , нуклеиновые кислоты , углеводы и липиды . Они обеспечивают структуру клеток и выполняют многие функции, связанные с жизнью. [6] Химия клетки также зависит от реакций малых молекул и ионов . Они могут быть неорганическими (например, вода и ионы металлов ) или органическими (например, аминокислоты , которые используются для синтеза белков ). [7] Механизмы, используемые клетками для извлечения энергии из окружающей среды посредством химических реакций , известны как метаболизм . Результаты биохимии применяются в основном в медицине , питании и сельском хозяйстве . В медицине биохимики исследуют причины и методы лечения болезней . [8] Питание изучает, как поддерживать здоровье и хорошее самочувствие, а также последствия дефицита питательных веществ . [9] В сельском хозяйстве биохимики исследуют почву и удобрения с целью улучшения выращивания сельскохозяйственных культур, хранения урожая и борьбы с вредителями . В последние десятилетия биохимические принципы и методы были объединены с подходами к решению проблем, применяемыми в инженерии, для манипулирования живыми системами с целью создания полезных инструментов для исследований, промышленных процессов, диагностики и контроля заболеваний — дисциплины биотехнологии .
История
_and_Carl_Ferdinand_Cori_-_restoration1.jpg/440px-Gerty_Theresa_Radnitz_Cori_(1896-1957)_and_Carl_Ferdinand_Cori_-_restoration1.jpg)
В наиболее полном определении биохимию можно рассматривать как изучение компонентов и состава живых существ и того, как они объединяются, чтобы стать жизнью. В этом смысле история биохимии может восходить к древним грекам . [10] Однако биохимия как особая научная дисциплина началась где-то в 19 веке или немного раньше, в зависимости от того, на каком аспекте биохимии сосредоточено внимание. Некоторые утверждали, что началом биохимии, возможно, было открытие первого фермента , диастазы (теперь называемой амилазой ), в 1833 году Ансельмом Пайеном , [11] в то время как другие считали первую демонстрацию Эдуардом Бухнером сложного биохимического процесса спиртового брожения в бесклеточных экстрактах в 1897 году рождением биохимии. [12] [13] Некоторые также могут указать на ее начало с влиятельной работы 1842 года Юстуса фон Либиха « Химия животных, или Органическая химия в ее приложениях к физиологии и патологии» , в которой была представлена химическая теория метаболизма, [10] или даже ранее с исследований 18-го века по брожению и дыханию Антуана Лавуазье . [14] [15] Многие другие пионеры в этой области, которые помогли раскрыть слои сложности биохимии, были провозглашены основателями современной биохимии. Эмиль Фишер , который изучал химию белков , [16] и Ф. Гоуленд Хопкинс , который изучал ферменты и динамическую природу биохимии, представляют собой два примера ранних биохимиков. [17]
Термин «биохимия» был впервые использован, когда Винценц Клетцинский (1826–1882) напечатал свой «Compendium der Biochemie» в Вене в 1858 году; он произошел от сочетания биологии и химии . В 1877 году Феликс Хоппе-Зейлер использовал термин ( biochemie на немецком языке) как синоним физиологической химии в предисловии к первому выпуску Zeitschrift für Physiologische Chemie (Журнал физиологической химии), где он выступал за создание институтов, посвященных этой области исследований. [18] [19] Однако часто упоминается, что немецкий химик Карл Нойберг придумал это слово в 1903 году, [20] [21] [22] хотя некоторые приписывают его Францу Хофмайстеру . [23]
Когда-то считалось, что жизнь и ее материалы обладают неким существенным свойством или субстанцией (часто называемой « жизненным принципом »), отличным от любого, обнаруженного в неживой материи, и считалось, что только живые существа могут производить молекулы жизни. [25] В 1828 году Фридрих Вёлер опубликовал статью о своем счастливом синтезе мочевины из цианата калия и сульфата аммония ; некоторые считали это прямым ниспровержением витализма и установлением органической химии . [26] [27] Однако синтез Вёлера вызвал споры, поскольку некоторые отрицают смерть витализма от его рук. [28] С тех пор биохимия продвинулась вперед, особенно с середины 20-го века, с развитием новых методов, таких как хроматография , рентгеновская дифракция , двухполяризационная интерферометрия , ЯМР-спектроскопия , радиоизотопная маркировка , электронная микроскопия и моделирование молекулярной динамики . Эти методы позволили открыть и детально проанализировать многие молекулы и метаболические пути клетки , такие как гликолиз и цикл Кребса (цикл лимонной кислоты), и привели к пониманию биохимии на молекулярном уровне. [ необходима цитата ]
Другим важным историческим событием в биохимии является открытие гена и его роли в передаче информации в клетке. В 1950-х годах Джеймс Д. Уотсон , Фрэнсис Крик , Розалинд Франклин и Морис Уилкинс сыграли важную роль в решении структуры ДНК и предположении ее связи с генетической передачей информации. [29] В 1958 году Джордж Бидл и Эдвард Татум получили Нобелевскую премию за работу с грибами, показывающую, что один ген производит один фермент . [30] В 1988 году Колин Питчфорк стал первым человеком, осужденным за убийство с использованием доказательств ДНК , что привело к росту судебной экспертизы . [31] Совсем недавно Эндрю З. Файер и Крейг К. Мелло получили Нобелевскую премию 2006 года за открытие роли РНК-интерференции (РНКi) в подавлении экспрессии генов . [32]
Исходные материалы: химические элементы жизни
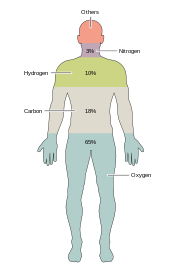
Около двух десятков химических элементов необходимы для различных видов биологической жизни . Большинство редких элементов на Земле не нужны для жизни (исключениями являются селен и йод ), [33] в то время как несколько распространенных ( алюминий и титан ) не используются. Большинство организмов разделяют потребности в элементах, но есть несколько различий между растениями и животными . Например, морские водоросли используют бром , но наземные растения и животные, похоже, не нуждаются в нем. Всем животным требуется натрий , но он не является необходимым элементом для растений. Растениям нужны бор и кремний , но животным они могут не понадобиться (или могут потребоваться в очень малых количествах). [ требуется цитата ]
Всего шесть элементов — углерод , водород , азот , кислород , кальций и фосфор — составляют почти 99% массы живых клеток, включая клетки человеческого тела (см. состав человеческого тела для полного списка). В дополнение к шести основным элементам, которые составляют большую часть человеческого тела, людям требуются меньшие количества, возможно, еще 18. [34]
Биомолекулы
Четыре основных класса молекул в биохимии (часто называемых биомолекулами ) — это углеводы , липиды , белки и нуклеиновые кислоты . [35] Многие биологические молекулы являются полимерами : в этой терминологии мономеры — это относительно небольшие макромолекулы, которые связаны друг с другом для создания больших макромолекул, известных как полимеры. Когда мономеры связаны вместе для синтеза биологического полимера , они подвергаются процессу, называемому дегидратационным синтезом . Различные макромолекулы могут собираться в более крупные комплексы, часто необходимые для биологической активности .
Углеводы
Две основные функции углеводов — хранение энергии и обеспечение структуры. Один из распространенных сахаров , известный как глюкоза , является углеводом, но не все углеводы являются сахарами. На Земле углеводов больше, чем любого другого известного типа биомолекул; они используются для хранения энергии и генетической информации , а также играют важную роль во взаимодействиях и коммуникациях между клетками . [ необходима цитата ]
Простейшим типом углеводов является моносахарид , который среди прочих свойств содержит углерод , водород и кислород , в основном в соотношении 1:2:1 (обобщенная формула C n H 2 n O n , где n равно не менее 3). Глюкоза (C 6 H 12 O 6 ) является одним из важнейших углеводов; другие включают фруктозу (C 6 H 12 O 6 ), сахар, обычно ассоциируемый со сладким вкусом фруктов , [36] [a] и дезоксирибозу (C 5 H 10 O 4 ), компонент ДНК . Моносахарид может переключаться между ациклической (открытоцепочечной) формой и циклической формой. Открытоцепочечная форма может быть превращена в кольцо атомов углерода, соединенных мостиком с помощью атома кислорода, созданного из карбонильной группы одного конца и гидроксильной группы другого. Циклическая молекула имеет полуацетальную или полукетальную группу, в зависимости от того, была ли линейная форма альдозой или кетозой . [38]
В этих циклических формах кольцо обычно имеет 5 или 6 атомов. Эти формы называются фуранозами и пиранозами , соответственно, — по аналогии с фураном и пираном , простейшими соединениями с тем же углеродно-кислородным кольцом (хотя у них отсутствуют углеродно-углеродные двойные связи этих двух молекул). Например, альдогексозаглюкоза может образовывать полуацетальную связь между гидроксилом на углероде 1 и кислородом на углероде 4, давая молекулу с 5-членным кольцом, называемую глюкофураноза . Та же реакция может происходить между углеродами 1 и 5, образуя молекулу с 6-членным кольцом, называемую глюкопираноза . Циклические формы с 7-атомным кольцом, называемые гептозами, встречаются редко. [ необходима цитата ]
Два моносахарида могут быть соединены гликозидной или эфирной связью в дисахарид посредством реакции дегидратации, в ходе которой высвобождается молекула воды. Обратная реакция, в которой гликозидная связь дисахарида разрывается на два моносахарида, называется гидролизом . Самый известный дисахарид — сахароза или обычный сахар , который состоит из соединенных молекулы глюкозы и молекулы фруктозы . Другим важным дисахаридом является лактоза , содержащаяся в молоке, состоящая из молекулы глюкозы и молекулы галактозы . Лактоза может гидролизоваться лактазой , а дефицит этого фермента приводит к непереносимости лактозы .
Когда несколько (около трех-шести) моносахаридов соединены, это называется олигосахаридом ( oligo- означает «немного»). Эти молекулы, как правило, используются в качестве маркеров и сигналов , а также имеют некоторые другие применения. [39] Многие соединенные моносахариды образуют полисахарид . Они могут быть соединены в одну длинную линейную цепь, или они могут быть разветвленными . Два из наиболее распространенных полисахаридов - целлюлоза и гликоген , оба состоят из повторяющихся мономеров глюкозы . Целлюлоза является важным структурным компонентом клеточных стенок растений , а гликоген используется как форма хранения энергии у животных.
Сахар можно охарактеризовать по наличию восстанавливающих или невосстанавливающих концов. Восстанавливающий конец углевода — это атом углерода, который может находиться в равновесии с альдегидной ( альдозной ) или кетоформой ( кетозой ) с открытой цепью. Если присоединение мономеров происходит у такого атома углерода, свободная гидроксильная группа пиранозной или фуранозной формы обменивается с боковой цепью ОН другого сахара, давая полный ацеталь . Это предотвращает раскрытие цепи в альдегидную или кетоформу и делает модифицированный остаток невосстанавливающим. Лактоза содержит восстанавливающий конец в своей глюкозной части, тогда как галактозная часть образует полный ацеталь с группой C4-OH глюкозы. Сахароза не имеет восстанавливающего конца из-за образования полного ацеталя между альдегидным углеродом глюкозы (C1) и кетоуглеродом фруктозы (C2).
Липиды

Липиды включают в себя разнообразный спектр молекул и в некоторой степени являются всеобъемлющим понятием для относительно нерастворимых в воде или неполярных соединений биологического происхождения, включая воски , жирные кислоты , фосфолипиды , полученные из жирных кислот, сфинголипиды , гликолипиды и терпеноиды (например, ретиноиды и стероиды ). Некоторые липиды представляют собой линейные алифатические молекулы с открытой цепью, в то время как другие имеют кольцевые структуры. Некоторые являются ароматическими (с циклической [кольцевой] и плоской [плоской] структурой), а другие — нет. Некоторые из них гибкие, а другие — жесткие. [42]
Липиды обычно состоят из одной молекулы глицерина, объединенной с другими молекулами. В триглицеридах , основной группе объемных липидов, есть одна молекула глицерина и три жирные кислоты . Жирные кислоты считаются мономером в этом случае и могут быть насыщенными (нет двойных связей в углеродной цепи) или ненасыщенными (одна или несколько двойных связей в углеродной цепи). [ необходима цитата ]
Большинство липидов имеют некоторый полярный характер и в значительной степени неполярны. В целом, основная часть их структуры неполярна или гидрофобна («боится воды»), что означает, что она плохо взаимодействует с полярными растворителями, такими как вода . Другая часть их структуры полярна или гидрофильна («любит воду») и будет иметь тенденцию ассоциироваться с полярными растворителями, такими как вода. Это делает их амфифильными молекулами (имеющими как гидрофобные, так и гидрофильные части). В случае холестерина полярная группа представляет собой просто –ОН (гидроксил или спирт). [ необходима цитата ]
В случае фосфолипидов полярные группы значительно больше и более полярны, как описано ниже.
Липиды являются неотъемлемой частью нашего ежедневного рациона. Большинство масел и молочных продуктов , которые мы используем для приготовления и употребления в пищу, таких как масло , сыр , топленое масло и т. д., состоят из жиров . Растительные масла богаты различными полиненасыщенными жирными кислотами (ПНЖК). Продукты, содержащие липиды, перевариваются в организме и расщепляются на жирные кислоты и глицерин, конечные продукты распада жиров и липидов. Липиды, особенно фосфолипиды , также используются в различных фармацевтических продуктах , либо в качестве со-солюбилизаторов (например, в парентеральных инфузиях), либо в качестве компонентов- носителей лекарств (например, в липосоме или трансферсоме ).
Белки

Белки — это очень большие молекулы — макробиополимеры — состоящие из мономеров, называемых аминокислотами . Аминокислота состоит из альфа-атома углерода, присоединенного к аминогруппе , –NH 2 , карбоксильной группы, –COOH (хотя они существуют как –NH 3 + и –COO − в физиологических условиях), простого атома водорода и боковой цепи, обычно обозначаемой как «–R». Боковая цепь «R» различна для каждой аминокислоты, из которых существует 20 стандартных . Именно эта группа «R» делает каждую аминокислоту разной, а свойства боковых цепей в значительной степени влияют на общую трехмерную конформацию белка. Некоторые аминокислоты выполняют функции сами по себе или в измененной форме; например, глутамат выполняет функции важного нейромедиатора . Аминокислоты могут быть соединены с помощью пептидной связи . В этом синтезе дегидратации молекула воды удаляется, и пептидная связь соединяет азот аминогруппы одной аминокислоты с углеродом карбоксильной группы другой. Полученная молекула называется дипептидом , а короткие отрезки аминокислот (обычно менее тридцати) называются пептидами или полипептидами . Более длинные отрезки заслуживают названия белков . Например, важный белок сыворотки крови альбумин содержит 585 аминокислотных остатков . [43]


Белки могут иметь структурные и/или функциональные роли. Например, движения белков актина и миозина в конечном итоге отвечают за сокращение скелетных мышц. Одно свойство многих белков заключается в том, что они специфически связываются с определенной молекулой или классом молекул — они могут быть чрезвычайно избирательны в том, что они связывают. Антитела являются примером белков, которые прикрепляются к одному определенному типу молекул. Антитела состоят из тяжелых и легких цепей. Две тяжелые цепи будут связаны с двумя легкими цепями через дисульфидные связи между их аминокислотами. Антитела специфичны через вариации, основанные на различиях в N-концевом домене. [44]
Иммуноферментный анализ (ИФА), который использует антитела, является одним из самых чувствительных тестов, которые современная медицина использует для обнаружения различных биомолекул. Однако, вероятно, наиболее важными белками являются ферменты . Практически каждая реакция в живой клетке требует фермента для снижения энергии активации реакции. Эти молекулы распознают определенные молекулы реагентов, называемые субстратами ; затем они катализируют реакцию между ними. Снижая энергию активации , фермент ускоряет эту реакцию со скоростью 10 11 или более; реакция, которая обычно занимает более 3000 лет, чтобы завершиться спонтанно, может занять менее секунды с ферментом. Сам фермент не используется в этом процессе и может свободно катализировать ту же самую реакцию с новым набором субстратов. Используя различные модификаторы, можно регулировать активность фермента, что позволяет контролировать биохимию клетки в целом.
Структура белков традиционно описывается в иерархии из четырех уровней. Первичная структура белка состоит из его линейной последовательности аминокислот; например, «аланин-глицин-триптофан-серин-глутамат-аспарагин-глицин-лизин-...». Вторичная структура связана с локальной морфологией (морфология является изучением структуры). Некоторые комбинации аминокислот будут иметь тенденцию сворачиваться в спираль, называемую α-спиралью , или в лист, называемый β-листом ; некоторые α-спирали можно увидеть на схеме гемоглобина выше. Третичная структура представляет собой всю трехмерную форму белка. Эта форма определяется последовательностью аминокислот. Фактически, одно изменение может изменить всю структуру. Альфа-цепь гемоглобина содержит 146 аминокислотных остатков; замена остатка глутамата в положении 6 на остаток валина настолько изменяет поведение гемоглобина, что это приводит к серповидноклеточной анемии . Наконец, четвертичная структура касается структуры белка с несколькими пептидными субъединицами, как гемоглобин с его четырьмя субъединицами. Не все белки имеют более одной субъединицы. [45]


Принятые внутрь белки обычно расщепляются на отдельные аминокислоты или дипептиды в тонком кишечнике , а затем всасываются. Затем они могут быть объединены для образования новых белков. Промежуточные продукты гликолиза, цикла лимонной кислоты и пентозофосфатного пути могут быть использованы для образования всех двадцати аминокислот, и большинство бактерий и растений обладают всеми необходимыми ферментами для их синтеза. Однако люди и другие млекопитающие могут синтезировать только половину из них. Они не могут синтезировать изолейцин , лейцин , лизин , метионин , фенилаланин , треонин , триптофан и валин . Поскольку они должны быть усвоены, это незаменимые аминокислоты . Млекопитающие обладают ферментами для синтеза аланина , аспарагина , аспартата , цистеина , глутамата , глутамина , глицина , пролина , серина и тирозина — заменимых аминокислот. Хотя они могут синтезировать аргинин и гистидин , они не могут производить их в достаточном количестве для молодых растущих животных, поэтому их часто считают незаменимыми аминокислотами.
Если аминогруппа удаляется из аминокислоты, она оставляет углеродный скелет, называемый α - кетокислотой . Ферменты, называемые трансаминазами, могут легко переносить аминогруппу с одной аминокислоты (делая ее α-кетокислотой) на другую α-кетокислоту (делая ее аминокислотой). Это важно в биосинтезе аминокислот, так как для многих путей промежуточные продукты из других биохимических путей преобразуются в скелет α-кетокислоты, а затем добавляется аминогруппа, часто посредством трансаминирования . Затем аминокислоты могут быть связаны вместе, образуя белок.
Похожий процесс используется для расщепления белков. Сначала он гидролизуется до его составляющих аминокислот. Свободный аммиак (NH3), существующий в виде иона аммония (NH4+) в крови, токсичен для форм жизни. Поэтому должен существовать подходящий метод его выведения. У разных животных развились различные тактики в зависимости от потребностей животных. Одноклеточные организмы выделяют аммиак в окружающую среду. Аналогично, костистые рыбы могут выделять аммиак в воду, где он быстро разбавляется. В целом, млекопитающие преобразуют аммиак в мочевину через цикл мочевины .
Чтобы определить, связаны ли два белка, или, другими словами, решить, являются ли они гомологичными или нет, ученые используют методы сравнения последовательностей. Такие методы, как выравнивание последовательностей и структурное выравнивание, являются мощными инструментами, которые помогают ученым выявлять гомологии между родственными молекулами. Значимость поиска гомологии среди белков выходит за рамки формирования эволюционной модели семейств белков . Выявляя, насколько похожи две белковые последовательности, мы получаем знания об их структуре и, следовательно, об их функции.
Нуклеиновые кислоты

Нуклеиновые кислоты , так называемые из-за их распространенности в клеточных ядрах , являются общим названием семейства биополимеров . Они представляют собой сложные, высокомолекулярные биохимические макромолекулы, которые могут передавать генетическую информацию во всех живых клетках и вирусах. [2] Мономеры называются нуклеотидами , и каждый состоит из трех компонентов: азотистого гетероциклического основания ( пурина или пиримидина ), пентозного сахара и фосфатной группы. [46]

Наиболее распространенными нуклеиновыми кислотами являются дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). Фосфатная группа и сахар каждого нуклеотида связываются друг с другом, образуя остов нуклеиновой кислоты, в то время как последовательность азотистых оснований хранит информацию. Наиболее распространенными азотистыми основаниями являются аденин , цитозин , гуанин , тимин и урацил . Азотистые основания каждой цепи нуклеиновой кислоты будут образовывать водородные связи с некоторыми другими азотистыми основаниями в комплементарной цепи нуклеиновой кислоты. Аденин связывается с тимином и урацилом, тимин связывается только с аденином, а цитозин и гуанин могут связываться только друг с другом. Аденин, тимин и урацил содержат две водородные связи, в то время как водородные связи, образованные между цитозином и гуанином, составляют три.
Помимо генетического материала клетки, нуклеиновые кислоты часто играют роль вторичных мессенджеров , а также формируют базовую молекулу для аденозинтрифосфата (АТФ), первичной молекулы-переносчика энергии, обнаруженной во всех живых организмах. Кроме того, азотистые основания, возможные в двух нуклеиновых кислотах, различны: аденин, цитозин и гуанин встречаются как в РНК, так и в ДНК, тогда как тимин встречается только в ДНК, а урацил встречается в РНК.
Метаболизм
Углеводы как источник энергии
Глюкоза является источником энергии в большинстве форм жизни. Например, полисахариды расщепляются на мономеры ферментами ( гликогенфосфорилаза удаляет остатки глюкозы из гликогена, полисахарида). Дисахариды, такие как лактоза или сахароза, расщепляются на два компонента моносахариды. [47]
Гликолиз (анаэробный)
Метаболический путь гликолиза преобразует глюкозу в пируват через ряд промежуточных метаболитов. Каждая химическая модификация выполняется отдельным ферментом. Шаги 1 и 3 потребляют АТФ и Шаги 7 и 10 производят АТФ. Поскольку шаги 6–10 происходят дважды на молекулу глюкозы, это приводит к чистому производству АТФ. |
Глюкоза в основном метаболизируется очень важным десятиступенчатым путем , называемым гликолизом , конечным результатом которого является расщепление одной молекулы глюкозы на две молекулы пирувата . Это также производит чистые две молекулы АТФ , энергетической валюты клеток, вместе с двумя восстановительными эквивалентами преобразования НАД + (никотинамидадениндинуклеотид: окисленная форма) в НАДН (никотинамидадениндинуклеотид: восстановленная форма). Для этого не требуется кислород; если кислород отсутствует (или клетка не может использовать кислород), НАД восстанавливается путем преобразования пирувата в лактат (молочную кислоту) (например, у людей) или в этанол плюс углекислый газ (например, у дрожжей ). Другие моносахариды, такие как галактоза и фруктоза, могут быть преобразованы в промежуточные продукты гликолитического пути. [48]
Аэробика
В аэробных клетках с достаточным количеством кислорода , как и в большинстве клеток человека, пируват далее метаболизируется. Он необратимо преобразуется в ацетил-КоА , выделяя один атом углерода в качестве побочного продукта углекислого газа , генерируя другой восстановительный эквивалент в виде НАДН . Две молекулы ацетил-КоА (из одной молекулы глюкозы) затем входят в цикл лимонной кислоты , производя две молекулы АТФ, еще шесть молекул НАДН и два восстановленных (убихинона) (через ФАДН 2 как связанный с ферментом кофактор), и высвобождая оставшиеся атомы углерода в виде углекислого газа. Произведенные молекулы НАДН и хинола затем поступают в ферментные комплексы дыхательной цепи, системы переноса электронов, в конечном итоге передающей электроны кислороду и сохраняющей высвобождаемую энергию в виде протонного градиента через мембрану ( внутренняя митохондриальная мембрана у эукариот). Таким образом, кислород восстанавливается до воды, а исходные акцепторы электронов НАД + и хинон регенерируются. Вот почему люди вдыхают кислород и выдыхают углекислый газ. Энергия, высвобождаемая при переносе электронов из высокоэнергетических состояний в NADH и хиноле, сначала сохраняется в виде протонного градиента и преобразуется в АТФ через АТФ-синтазу. Это генерирует дополнительные 28 молекул АТФ (24 из 8 NADH + 4 из 2 хинолов), что в общей сложности составляет 32 молекулы АТФ, сохраняемые на каждую деградированную глюкозу (две из гликолиза + две из цитратного цикла). [49] Очевидно, что использование кислорода для полного окисления глюкозы обеспечивает организм гораздо большим количеством энергии, чем любая независимая от кислорода метаболическая функция, и это, как полагают, является причиной того, что сложная жизнь появилась только после того, как атмосфера Земли накопила большое количество кислорода.
Глюконеогенез
У позвоночных энергично сокращающиеся скелетные мышцы (например, во время поднятия тяжестей или бега на короткие дистанции) не получают достаточного количества кислорода для удовлетворения потребности в энергии, и поэтому они переходят на анаэробный метаболизм , преобразуя глюкозу в лактат. Сочетание глюкозы из неуглеводного происхождения, такого как жир и белки. Это происходит только тогда, когда запасы гликогена в печени израсходованы. Путь является критическим обращением гликолиза от пирувата к глюкозе и может использовать многие источники, такие как аминокислоты, глицерин и цикл Кребса . Крупномасштабный катаболизм белков и жиров обычно происходит, когда те страдают от голода или определенных эндокринных расстройств. [50] Печень регенерирует глюкозу, используя процесс, называемый глюконеогенезом . Этот процесс не совсем противоположен гликолизу и на самом деле требует в три раза больше энергии, полученной от гликолиза (используется шесть молекул АТФ по сравнению с двумя, полученными при гликолизе). Аналогично вышеприведенным реакциям, произведенная глюкоза может затем подвергаться гликолизу в тканях, которым нужна энергия, храниться в виде гликогена (или крахмала в растениях) или преобразовываться в другие моносахариды или соединяться в ди- или олигосахариды. Объединенные пути гликолиза во время упражнений, перехода лактата через кровоток в печень, последующего глюконеогенеза и высвобождения глюкозы в кровоток называются циклом Кори . [51]
Связь с другими биологическими науками «молекулярного масштаба»
В этом разделе есть несколько проблем. Помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти сообщения )
|

Исследователи в области биохимии используют специфические методы, присущие биохимии, но все чаще объединяют их с методами и идеями, разработанными в области генетики , молекулярной биологии и биофизики . Между этими дисциплинами нет четкой границы. Биохимия изучает химию, необходимую для биологической активности молекул, молекулярная биология изучает их биологическую активность, генетика изучает их наследственность, которая, как оказалось, передается их геномом . Это показано на следующей схеме, которая изображает один из возможных взглядов на отношения между областями:
- Биохимия — это изучение химических веществ и жизненно важных процессов, происходящих в живых организмах . Биохимики уделяют большое внимание роли, функции и структуре биомолекул . Изучение химии, лежащей в основе биологических процессов, и синтез биологически активных молекул являются приложениями биохимии. Биохимия изучает жизнь на атомном и молекулярном уровне.
- Генетика — это изучение эффекта генетических различий в организмах. Это часто можно вывести из отсутствия нормального компонента (например, одного гена ). Изучение « мутантов » — организмов, у которых отсутствует один или несколько функциональных компонентов по сравнению с так называемым « диким типом » или нормальным фенотипом . Генетические взаимодействия ( эпистаз ) часто могут запутать простые интерпретации таких « нокаутных » исследований.
- Молекулярная биология — это изучение молекулярных основ биологических явлений, фокусирующееся на молекулярном синтезе, модификации, механизмах и взаимодействиях. Центральная догма молекулярной биологии , где генетический материал транскрибируется в РНК, а затем транслируется в белок , несмотря на чрезмерное упрощение, по-прежнему является хорошей отправной точкой для понимания этой области. Эта концепция была пересмотрена в свете появления новых ролей РНК .
- Химическая биология стремится разрабатывать новые инструменты на основемалых молекул, которые позволяют минимально возмущение биологических систем, предоставляя подробную информацию об их функции. Кроме того, химическая биология использует биологические системы для создания неприродных гибридов между биомолекулами и синтетическими устройствами (например, пустыевирусные капсиды, которые могут доставлятьгенную терапиюилимолекулы лекарств).
Смотрите также
Списки
Смотрите также
- Астробиология
- Биохимия (журнал)
- Биологическая химия (журнал)
- Биофизика
- Химическая экология
- Вычислительное биомоделирование
- Специализированный биохимический препарат
- Номер ЕС
- Гипотетические типы биохимии
- Международный союз биохимии и молекулярной биологии
- Метаболом
- Метаболомика
- Молекулярная биология
- Молекулярная медицина
- Биохимия растений
- Протеолиз
- Малая молекула
- Структурная биология
- цикл ТСА
Примечания
- ^ Фруктоза — не единственный сахар, содержащийся во фруктах. Глюкоза и сахароза также содержатся в разных количествах в различных фруктах и иногда превышают количество присутствующей фруктозы. Например, 32% съедобной части финика — это глюкоза, по сравнению с 24% фруктозы и 8% сахарозы. Однако персики содержат больше сахарозы (6,66%), чем фруктозы (0,93%) или глюкозы (1,47%). [37]
Ссылки
- ^ "Биологическая/Биохимия". acs.org . Архивировано из оригинала 2019-08-21 . Получено 2016-01-04 .
- ^ ab Voet (2005), стр. 3.
- ^ Карп (2009), стр. 2.
- ^ Миллер (2012). стр. 62.
- ↑ Эстбери (1961), стр. 1124.
- ^ Элдра (2007), стр. 45.
- ↑ Маркс (2012), Глава 14.
- ^ Финкель (2009), стр. 1–4.
- ^ ЮНИСЕФ (2010), стр. 61, 75.
- ^ ab Helvoort (2000), стр. 81.
- ↑ Хантер (2000), стр. 75.
- ^ Хэмблин (2005), стр. 26.
- ↑ Хантер (2000), стр. 96–98.
- ↑ Берг (1980), стр. 1–2.
- ↑ Холмс (1987), стр. xv.
- ^ Фельдман (2001), стр. 206.
- ^ Рейнер-Кэнхэм (2005), с. 136.
- ^ Зиесак (1999), стр. 169.
- ^ Кляйнкауф (1988), стр. 116.
- ^ Бен-Менахем (2009), с. 2982.
- ^ Амслер (1986), стр. 55.
- ^ Хортон (2013), стр. 36.
- ^ Кляйнкауф (1988), стр. 43.
- ↑ Эдвардс (1992), стр. 1161–1173.
- ↑ Фиске (1890), стр. 419–420.
- ^ Вёлер, Ф. (1828). «Ueber künstliche Bildung des Harnstoffs». Аннален дер Физик и Химия . 88 (2): 253–256. Бибкод : 1828AnP....88..253W. дои : 10.1002/andp.18280880206. ISSN 0003-3804. Архивировано из оригинала 28 октября 2023 г. Проверено 4 мая 2021 г.
- ^ Кауфман (2001), стр. 121–133.
- ^ Липман, Тимоти О. (август 1964 г.). «Подготовка мочевины Вёлером и судьба витализма». Журнал химического образования . 41 (8): 452. Bibcode : 1964JChEd..41..452L. doi : 10.1021/ed041p452. ISSN 0021-9584. Архивировано из оригинала 28.10.2023 . Получено 04.05.2021 .
- ^ Тропп (2012), стр. 19–20.
- ^ Кребс (2012), стр. 32.
- ^ Батлер (2009), стр. 5.
- ^ Чандан (2007), стр. 193–194.
- ^ Кокс, Нельсон, Ленингер (2008). Принципы биохимии Ленингера . Macmillan.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Нильсен (1999), стр. 283–303.
- ^ Слабо (2007), стр. 3–6.
- ↑ Уайтинг (1970), стр. 1–31.
- ^ Уайтинг, GC (1970), стр. 5.
- ↑ Voet (2005), стр. 358–359.
- ^ Варки (1999), стр. 17.
- ^ Страйер (2007), стр. 328.
- ^ Voet (2005), Гл. 12 Липиды и мембраны.
- ^ Ахмед, Саба; Шах, Парини; Ахмед, Оваис (2023), «Биохимия, Липиды», StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 30247827 , получено 30 ноября 2023 г.
- ^ Мецлер (2001), стр. 58.
- ^ Фейге, Маттиас Дж.; Хендершот, Линда М.; Бухнер, Йоханнес (2010). «Как сворачиваются антитела». Тенденции в биохимических науках . 35 (4): 189–198. doi :10.1016/j.tibs.2009.11.005. PMC 4716677. PMID 20022755 .
- ^ Фромм и Харгроув (2012), стр. 35–51.
- ^ Сэнгер (1984), стр. 84.
- ^ "Дисахарид". Encyclopedia Britannica . Архивировано из оригинала 19 октября 2023 г. Получено 14 октября 2023 г.
- ^ Фромм и Харгроув (2012), стр. 163–180.
- ^ Воэт (2005), Гл. 17 Гликолиз.
- ↑ Биологический словарь. Oxford University Press. 17 сентября 2015 г. ISBN 9780198714378. Архивировано из оригинала 10 июля 2020 . Получено 29 апреля 2020 .
- ^ Фромм и Харгроув (2012), стр. 183–194.
Цитируемая литература
- Амслер, Марк (1986). Языки творчества: модели, решение проблем, дискурс. Издательство Делавэрского университета. ISBN 978-0-87413-280-9. Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Astbury, WT (1961). «Молекулярная биология или ультраструктурная биология?». Nature . 190 (4781): 1124. Bibcode : 1961Natur.190.1124A. doi : 10.1038/1901124a0 . PMID 13684868. S2CID 4172248.
- Бен-Менахем, Ари (2009). Историческая энциклопедия естественных и математических наук. Springer. С. 2982. Bibcode :2009henm.book.....B. ISBN 978-3-540-68831-0.
- Бертон, Фельдман (2001). Нобелевская премия: история гения, противоречий и престижа. Arcade Publishing. ISBN 978-1-55970-592-9.
- Батлер, Джон М. (2009). Основы судебно-медицинского ДНК-типирования. Academic Press. ISBN 978-0-08-096176-7.
- Сен, Чандан К.; Рой, Сашвати (2007). «MiRNA: лицензия на убийство посланника». ДНК и клеточная биология . 26 (4): 193–194. doi :10.1089/dna.2006.0567. PMID 17465885. S2CID 10665411.
- Кларенс, Питер Берг (1980). Университет Айовы и биохимия с самого начала. Университет Айовы. ISBN 978-0-87414-014-9. Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Эдвардс, Карен Дж.; Браун, Дэвид Г.; Спинк, Нил; Скелли, Джейн В.; Нидл, Стивен (1992). «Молекулярная структура додекамера B-ДНК d(CGCAAATTTGCG)2: исследование крутки пропеллера и структуры воды в малых канавках при разрешении 2,2Å». Журнал молекулярной биологии . 226 (4): 1161–1173. doi :10.1016/0022-2836(92)91059-x. PMID 1518049.
- Элдра П. Соломон; Линда Р. Берг; Диана В. Мартин (2007). Биология, 8-е издание, Международное студенческое издание. Thomson Brooks/Cole. ISBN 978-0-495-31714-2. Архивировано из оригинала 2016-03-04.
- Фаризелли, П.; Росси, И.; Каприотти, Э.; Касадио, Р. (2006). «WWWH дистанционного обнаружения гомологов: современное состояние». Briefings in Bioinformatics . 8 (2): 78–87. doi : 10.1093/bib/bbl032 . PMID 17003074.
- Фиске, Джон (1890). Очерки космической философии, основанной на доктринах эволюции, с критикой позитивной философии, том 1. Бостон и Нью-Йорк: Houghton, Mifflin. Архивировано из оригинала 28 октября 2023 г. Получено 16 февраля 2015 г.
- Финкель, Ричард; Кубедду, Луиджи; Кларк, Мишель (2009). Иллюстрированные обзоры Липпинкотта: Фармакология (4-е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7155-9. Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Кребс, Джоселин Э.; Голдштейн, Эллиотт С.; Левин, Бенджамин; Килпатрик, Стивен Т. (2012). Essential Genes. Jones & Bartlett Publishers. ISBN 978-1-4496-1265-8.
- Фромм, Герберт Дж.; Харгроув, Марк (2012). Основы биохимии. Springer. ISBN 978-3-642-19623-2. Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Хамблин, Якоб Дарвин (2005). Наука в начале двадцатого века: Энциклопедия. ABC-CLIO. ISBN 978-1-85109-665-7. Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Helvoort, Ton van (2000). Arne Hessenbruch (ред.). Справочник читателя по истории науки. Fitzroy Dearborn Publishing. ISBN 978-1-884964-29-9. Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Холмс, Фредерик Лоуренс (1987). Лавуазье и химия жизни: исследование научного творчества. Издательство Висконсинского университета. ISBN 978-0-299-09984-8. Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Хортон, Дерек, ред. (2013). Достижения в области химии и биохимии углеводов, том 70. Academic Press. ISBN 978-0-12-408112-3. Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Хантер, Грэм К. (2000). Жизненные силы: открытие молекулярной основы жизни. Academic Press. ISBN 978-0-12-361811-5. Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Карп, Джеральд (2009). Клеточная и молекулярная биология: концепции и эксперименты. John Wiley & Sons. ISBN 978-0-470-48337-4.
- Кауфман, Джордж Б.; Чулджиан, Стивен Х. (2001). «Фридрих Вёлер (1800–1882), к двухсотлетию со дня его рождения». The Chemical Educator . 6 (2): 121–133. doi :10.1007/s00897010444a. S2CID 93425404.
- Кляйнкауф, Хорст; Дёрен, Ганс фон; Янике Лотар (1988). Корни современной биохимии: закорючка Фрица Липпмана и ее последствия. Уолтер де Грюйтер и компания, с. 116. ИСБН 978-3-11-085245-5. Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Ноулз, Дж. Р. (1980). «Реакции переноса фосфорила, катализируемые ферментами». Annual Review of Biochemistry . 49 : 877–919. doi : 10.1146/annurev.bi.49.070180.004305. PMID 6250450. S2CID 7452392.
- Метцлер, Дэвид Эверетт; Метцлер, Кэрол М. (2001). Биохимия: Химические реакции живых клеток. Том 1. Academic Press. ISBN 978-0-12-492540-3.
- Миллер Г.; Спулман Скотт (2012). Наука об окружающей среде – Биоразнообразие является важнейшей частью природного капитала Земли. Cengage Learning . ISBN 978-1-133-70787-5. Архивировано из оригинала 2023-04-13 . Получено 2016-01-04 .
- Нильсен, Форрест Х. (1999). «Ультратрейсовые минералы». В Морис Э. Шилс и др. (ред.). Современное питание в здоровье и болезнях . Балтимор: Уильямс и Уилкинс. стр. 283–303. hdl :10113/46493.
- Пит, Алиса (2012). Маркс, Аллан; Либерман Майкл А. (ред.). Базовая медицинская биохимия Маркса (Lieberman, Marks's Basic Medical Biochemistry) (4-е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-1-60831-572-7. Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Рейнер-Кэнхэм, Марелин Ф.; Рейнер-Кэнхэм, Марелин; Рейнер-Кэнхэм, Джеффри (2005). Женщины в химии: их меняющиеся роли от алхимических времен до середины двадцатого века. Фонд химического наследия. ISBN 978-0-941901-27-7.
- Рохас-Руис, Фернандо А.; Варгас-Мендес, Леонор И.; Кузнецов, Владимир В. (2011). «Проблемы и перспективы химической биологии, успешной междисциплинарной области естественных наук». Molecules . 16 (3): 2672–2687. doi : 10.3390/molecules16032672 . PMC 6259834 . PMID 21441869.
- Saenger, Wolfram (1984). Принципы структуры нуклеиновых кислот. Нью-Йорк: Springer-Verlag. ISBN 978-0-387-90762-8. Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Slabaugh, Michael R.; Seager, Spencer L. (2013). Органическая и биохимия сегодня (6-е изд.). Pacific Grove: Brooks Cole. ISBN 978-1-133-60514-0. Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Шервуд, Лорали; Кландорф, Хиллар; Янси, Пол Х. (2012). Физиология животных: от генов к организмам. Cengage Learning. ISBN 978-0-8400-6865-1.
- Страйер Л., Берг Дж.М., Тимочко Дж.Л. (2007). Биохимия (6-е изд.). Сан-Франциско: WH Freeman. ISBN 978-0-7167-8724-2.
- Tropp, Burton E. (2012). Молекулярная биология (4-е изд.). Jones & Bartlett Learning. ISBN 978-1-4496-0091-4. Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- ЮНИСЕФ (2010). Факты для жизни (PDF) (4-е изд.). Нью-Йорк: Детский фонд ООН. ISBN 978-92-806-4466-1. Архивировано (PDF) из оригинала 2022-10-09.
- Ulveling, Damien; Francastel, Claire; Hubé, Florent (2011). «Когда один лучше двух: РНК с двойными функциями» (PDF) . Biochimie . 93 (4): 633–644. doi :10.1016/j.biochi.2010.11.004. PMID 21111023. S2CID 22165949. Архивировано (PDF) из оригинала 2022-10-09.
- Varki A, Cummings R, Esko J, Jessica F, Hart G, Marth J (1999). Основы гликобиологии. Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-560-6. Архивировано из оригинала 2023-10-28 . Получено 2020-06-05 .
- Воэт, Д; Воэт, Дж. Г. (2005). Биохимия (3-е изд.). Хобокен, Нью-Джерси: ISBN John Wiley & Sons Inc. 978-0-471-19350-0. Архивировано из оригинала 11 сентября 2007 года.
- Whiting, GC (1970). "Сахара". В AC Hulme (ред.). Биохимия фруктов и их продуктов . Том 1. Лондон и Нью-Йорк: Academic Press. ISBN 978-0-12-361201-4.
- Зиесак, Анн-Катрин; Крам Ханс-Роберт (1999). Издательство Уолтера де Грютера, 1749–1999. ISBN Уолтера де Грютера и компании 978-3-11-016741-2. Архивировано из оригинала 2023-10-28 . Получено 2015-07-27 .
- Эшкрофт, Стив. «Профессор сэр Филип Рэндл; Исследователь метаболизма: [1-е издание]». Independent . ProQuest 311080685.
Дальнейшее чтение
- Фрутон, Джозеф С. Белки, ферменты, гены: взаимодействие химии и биологии . Издательство Йельского университета: Нью-Хейвен, 1999. ISBN 0-300-07608-8
- Кит Робертс, Мартин Рафф, Брюс Альбертс, Питер Уолтер, Джулиан Льюис и Александр Джонсон, Молекулярная биология клетки
- 4-е издание, Routledge, март 2002 г., твердый переплет, 1616 стр. ISBN 0-8153-3218-1
- 3-е издание, Гарланд, 1994, ISBN 0-8153-1620-8
- 2-е издание, Гарланд, 1989, ISBN 0-8240-3695-6
- Колер, Роберт. От медицинской химии к биохимии: становление биомедицинской дисциплины . Cambridge University Press, 1982.
- Маджио, Лорен А.; Виллински, Джон М.; Стейнберг, Райан М.; Митчен, Дэниел; Уасс, Джозеф Л.; Донг, Тин (2017). «Википедия как шлюз к биомедицинским исследованиям: относительное распределение и использование цитат в английской Википедии». PLOS ONE . 12 (12): e0190046. Bibcode : 2017PLoSO..1290046M. doi : 10.1371/journal.pone.0190046 . PMC 5739466. PMID 29267345 .
Внешние ссылки
- «Биохимическое общество».
- Виртуальная библиотека биохимии, молекулярной биологии и клеточной биологии
- Биохимия, 5-е изд. Полный текст Берга, Тимочко и Страйера, любезно предоставлен NCBI .
- SystemsX.ch – Швейцарская инициатива в области системной биологии
- Полный текст книги «Биохимия» Кевина и Индиры, вводного учебника по биохимии.







