серия Бальмера

Серия Бальмера , или линии Бальмера в атомной физике , является одной из шести серий, описывающих спектральные линии излучения атома водорода . Серия Бальмера рассчитывается с использованием формулы Бальмера, эмпирического уравнения, открытого Иоганном Бальмером в 1885 году.
Видимый спектр света водорода отображает четыре длины волн : 410 нм , 434 нм, 486 нм и 656 нм, которые соответствуют излучению фотонов электронами в возбужденных состояниях , переходящих на квантовый уровень, описываемый главным квантовым числом n, равным 2. [1] Существует несколько заметных ультрафиолетовых линий Бальмера с длинами волн короче 400 нм. Серия продолжается бесконечным числом линий, длины волн которых асимптотически приближаются к пределу 364,5 нм в ультрафиолете.
После открытия Бальмера было обнаружено еще пять спектральных серий водорода , соответствующих переходам электронов к значениям n, отличным от двух.
Обзор
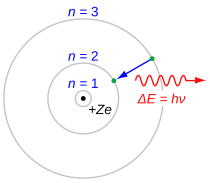
Серия Бальмера характеризуется переходом электрона от n ≥ 3 к n = 2, где n относится к радиальному квантовому числу или главному квантовому числу электрона. Переходы именуются последовательно греческими буквами: от n = 3 к n = 2 называется H-α, от 4 к 2 — H-β, от 5 к 2 — H-γ, а от 6 к 2 — H-δ. Поскольку первые спектральные линии, связанные с этой серией, расположены в видимой части электромагнитного спектра , эти линии исторически называются «H-альфа», «H-бета», «H-гамма» и т. д., где H — элемент водород.
Переход н 3→2 4→2 5→2 6→2 7→2 8→2 9→2 ∞→2 Имя H-α / Ba-α H-β / Ba-β H-γ / Ba-γ H-δ / Ba-δ H-ε / Ba-ε H-ζ / Ba-ζ H-η / Ba-η брейк Бальмера Длина волны (нм, воздух) 656.279 [2] 486.135 [2] 434.0472 [2] 410.1734 [2] 397.0075 [2] 388.9064 [2] 383.5397 [2] 364,5 Разница энергий (эВ) 1.89 2.55 2.86 3.03 3.13 3.19 3.23 3.40 Цвет Красный 
Голубой 
Синий 
Фиолетовый 
( Ультрафиолет ) 
(Ультрафиолет) 
(Ультрафиолет) 
(Ультрафиолет)
Хотя физики знали об атомных эмиссиях до 1885 года, у них не было инструмента, чтобы точно предсказать, где должны появиться спектральные линии. Уравнение Бальмера предсказывает четыре видимые спектральные линии водорода с высокой точностью. Уравнение Бальмера вдохновило уравнение Ридберга как его обобщение, и это, в свою очередь, привело физиков к открытию серий Лаймана , Пашена и Брэкетта , которые предсказали другие спектральные линии водорода, обнаруженные за пределами видимого спектра .
Красная спектральная линия H-альфа серии Бальмера атомарного водорода, которая является переходом от оболочки n = 3 к оболочке n = 2, является одним из заметных цветов Вселенной . Она вносит яркую красную линию в спектры эмиссионной или ионизационной туманности, такой как туманность Ориона , которые часто являются областями H II, обнаруженными в областях звездообразования. На фотографиях в истинном цвете эти туманности имеют красновато-розовый цвет из-за комбинации видимых линий Бальмера, которые испускает водород.
Позже было обнаружено, что когда линии серии Бальмера спектра водорода были исследованы с очень высоким разрешением, они представляли собой близко расположенные дублеты. Это расщепление называется тонкой структурой . Было также обнаружено, что возбужденные электроны из оболочек с n больше 6 могут переходить на оболочку с n = 2, испуская при этом оттенки ультрафиолета.

Формула Бальмера
Бальмер заметил, что одна длина волны связана с каждой линией в спектре водорода, которая находится в видимой области света . Эта длина волны была364,506 82 нм . Если любое целое число больше 2 возвести в квадрат, а затем разделить на само себя в квадрате минус 4, то это число умножить на364,506 82 нм (см. уравнение ниже) дало длину волны другой линии в спектре водорода. С помощью этой формулы он смог показать, что некоторые измерения линий, сделанные в его время с помощью спектроскопии, были немного неточными, и его формула также предсказала линии, которые еще не наблюдались, но были обнаружены позже. Его число также оказалось пределом ряда. Уравнение Бальмера можно было использовать для нахождения длины волны линий поглощения/испускания, и первоначально оно было представлено следующим образом (за исключением изменения обозначений, чтобы дать постоянную Бальмера как B ): Где
- λ — длина волны.
- B — константа со значением3,645 0682 × 10 −7 м или364,506 82 нм .
- m — начальное состояние
- n — конечное состояние
В 1888 году физик Иоганнес Ридберг обобщил уравнение Бальмера для всех переходов водорода. Уравнение, обычно используемое для вычисления серии Бальмера, является конкретным примером формулы Ридберга и следует как простая обратная математическая перестановка формулы выше (традиционно используя обозначение m вместо n как единственной интегральной константы, необходимой):
где λ — длина волны поглощенного/испускаемого света, а R H — постоянная Ридберга для водорода. Видно, что постоянная Ридберга равна 4/Б в формуле Бальмера, и это значение для бесконечно тяжелого ядра равно 4/3,645 0682 × 10 −7 м =10 973 731 .57 м −1 . [3]
Роль в астрономии
Серия Бальмера особенно полезна в астрономии , поскольку линии Бальмера появляются во многих звездных объектах из-за обилия водорода во Вселенной , и поэтому они обычно видны и относительно сильны по сравнению с линиями других элементов. Первые две линии Бальмера соответствуют линиям Фраунгофера C и F.
Спектральная классификация звезд, которая в первую очередь является определением температуры поверхности, основана на относительной силе спектральных линий, и серия Бальмера в частности очень важна. Другие характеристики звезды, которые можно определить путем тщательного анализа ее спектра, включают поверхностную гравитацию (связанную с физическим размером) и состав.
Поскольку линии Бальмера обычно видны в спектрах различных объектов, они часто используются для определения лучевых скоростей из-за доплеровского смещения линий Бальмера. Это имеет важное применение во всей астрономии, от обнаружения двойных звезд , экзопланет , компактных объектов, таких как нейтронные звезды и черные дыры (по движению водорода в аккреционных дисках вокруг них), идентификации групп объектов с похожими движениями и предположительно происхождением ( движущиеся группы , звездные скопления , скопления галактик и обломки от столкновений), определения расстояний (фактически красных смещений ) галактик или квазаров и идентификации незнакомых объектов путем анализа их спектра.
Линии Бальмера могут появляться в спектре как линии поглощения или испускания в зависимости от природы наблюдаемого объекта. В звездах линии Бальмера обычно видны в поглощении, и они «сильнее всего» у звезд с температурой поверхности около 10 000 кельвинов ( спектральный тип A). В спектрах большинства спиральных и неправильных галактик, активных ядер галактик , областей H II и планетарных туманностей линии Бальмера являются линиями испускания.
В звездных спектрах линия H-эпсилон (переход 7→2, 397,007 нм) часто смешивается с другой линией поглощения, вызванной ионизированным кальцием, известной как «H» ( первоначальное обозначение, данное Йозефом фон Фраунгофером ). H-эпсилон отделена на 0,16 нм от Ca II H при 396,847 нм и не может быть разрешена в спектрах с низким разрешением. Линия H-дзета (переход 8→2) аналогичным образом смешивается с линией нейтрального гелия, наблюдаемой в горячих звездах.
Смотрите также
- Астрономическая спектроскопия
- модель Бора
- Спектральные серии водорода
- Серия Лайман
- формула Ридберга
- Звездная классификация
Ссылки
- ^ Nave, CR (2006). "Спектр водорода". HyperPhysics . Университет штата Джорджия . Получено 1 марта 2008 г.
- ^ abcdefg Kramida, A., Ralchenko, Yu., Reader, J. и NIST ASD Team (2019). База данных атомных спектров NIST (версия 5.7.1), [Онлайн]. Доступно: https://physics.nist.gov/asd [2020, 11 апреля]. Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд. DOI: https://doi.org/10.18434/T4W30F
- ^ "CODATA Recommended Values of the Fundamental Physical Constants: 2006" (PDF) . Комитет по данным для науки и технологий (CODATA) . NIST .










